基于优化MSER算法的宫颈细胞核分割方法
2021-03-14何勇军张雪媛邵慧丽丁博
何勇军 张雪媛 邵慧丽 丁博


摘 要:随着人工智能技术的发展,自动阅片系统在辅助病理医生阅片诊断,提高病理诊断准确率、降低劳动强度等方面起着越来越重要的作用。细胞核的准确分割是影响该自动阅片系统性能的首要因素。由于细胞核、细胞浆与背景之间的边界不清,且细胞之间颜色差异大,对细胞核分割提出了挑战。为解决这一问题,提出了一种基于优化最大极值稳定区域(maximally stable extremal regions,MSER)算法的宫颈细胞核分割方法。该方法首先将图像转换到HSV(hue,saturation,value)颜色空间。然后针对S和V通道做加权组合后,采用优化后的MSER算法处理,获得灰度值均匀的粗分割区域。再利用参数自适应的阈值分割方法进行精细分割。最后通过提取细胞核特征训练人工神经网络分类器来判断分割后得到的结果是否为细胞核。实验表明,该方法能够准确地分割宫颈细胞核。
关键词:细胞核分割;稳定区域;凸包检测;颜色空间
DOI:10.15938/j.jhust.2021.06.002
中图分类号: TP315.69
文献标志码: A
文章编号: 1007-2683(2021)06-0010-08
Cervical Cell Nuclear Segmentation Method Based on Optimized MSER Algorithm
HE Yong-jun, ZHANG Xue-yuan, SHAO Hui-li, DING Bo
(School of Computer Science and Technology, Harbin University of Science and Technology, Harbin 150080, China)
Abstract:With the development of artificial intelligence technology, the automatic reading system plays an increasingly important role in assisting the diagnosis of pathologists, improving the accuracy of pathology diagnosis and reducing labor intensity. Accurate segmentation of the nucleus is the primary factor affecting the performance of the automated reading system. Because the boundary between the nucleus, the cytoplasm and the background is unclear, and the color difference between the cells is large, the nuclear segmentation is challenged. In order to solve this problem, a method of cervical nucleus segmentation based on optimal maximum stability regions(Maximally Stable Extremal Regions, MSER) algorithm is proposed. This method first converts the image to the HSV (Hue, Saturation, Value) color space. Then, after weighted combination of S and V channels, the optimized MSER algorithm is used to obtain a coarse segmentation region with uniform gray values. The parameter segmentation method is used to perform fine segmentation. Finally, the feature extraction technique is used to extract various features from the nuclear image, and the artificial neural network classifier is trained to judge whether the result obtained after segmentation is the nucleus. Experiments show that the method can accurately segment the cervical nucleus.
Keywords:nuclear segmentation; stable region; convex hull detection; color space
0 引 言
宮颈癌是威胁女性健康的第二大杀手,其死亡率仅次于乳腺癌。研究表明,宫颈癌主要由HPV感染引起细胞的不正常生长引起。早期筛查对降低宫颈癌的死亡率至关重要。据调查,宫颈原位癌的治愈率高达100%,早期浸润癌为90%,而浸润癌仅为67%,晚期扩散后治愈率低于10%。宫颈细胞涂片检测是筛查宫颈癌的重要手段[1-2],对发现宫颈异常细胞具有较高的准确性。但该方法需要病理学专家用人眼看显微镜去判断,主观性较强,同时耗费大量的人力物力,准确性也不稳定,难以适应现实的应用需求。而宫颈细胞涂片的自动化分析,即自动阅片能够有效地解决这一问题。
自动阅片主要目的是通过自动化的扫片、识别和分析,找出病变的细胞,以辅助医生诊断。由于宫颈涂片中细胞分布的复杂性和背景的多样性,自动阅片一直存在着诸多挑战。在此过程中,细胞核的准确分割是后期细胞识别的重要前提。但宫颈细胞图像内容多样,背景复杂,有上皮细胞、淋巴细胞、中性粒细胞、各种团状细胞和垃圾杂质。且人体细胞的种类繁多,颜色存在较大差异。其次标本制作后存在大量的粘连和重叠细胞。此外,染色不均及其细胞自身的病理性改变等上述种种原因给细胞核的准确分割带来了很大的困难,利用常用的图像分割方法极易造成细胞核的欠分割或过分割等问题。
细胞核分割主要是利用细胞图像中的灰度、颜色、边缘、纹理、形状等信息将细胞图像中的细胞核准确地提取出来。目前国内外研究者已经提出了大量有效的方法。Phoulady等[3]提出了迭代阈值法分割细胞核,以形态学方法获得的细胞核尺寸、灰度值和凹凸性为依据,利用迭代阈值法分割细胞核。Plissiti等[4]提出了一种基于分水岭的细胞核分割的全自动方法。首先通过形态学重建步骤检测图像区域极小值的质心,再用分水岭变换定义核的边界,然后使用模糊C均值算法(fuzzy C-means,FCM)执行聚类步骤,从边界封闭区域中提取特征,检测核的真实位置。Asli等[5]提出了一种无监督的宫颈细胞分割和分类的方法。具体过程涉及使用自动阈值处理以将细胞区域和背景分离,基于均一性和圆形度采用多尺度分层分割算法划分细胞区域,以及采用二元分类器分类细胞区域的细胞核。Li等[6]采用辐射梯度矢量(radiating gradient vector flow, RGVF)从单细胞子宫颈细胞涂片中准确提取细胞核和细胞浆。该方法首先将每张单细胞子宫颈涂片图像转换为CIELAB颜色空间,并将L维数据归一化形成灰度图像,使用非局部均值滤波器去除噪声。然后利用K均值聚类算法将图像中的区域大致聚类为细胞核、细胞浆和背景。最后利用RGVF驱动下的Snake模型对细胞核和细胞浆边界进行准确的估计。Zhang等[7]提出了一种基于稀疏形状先验引导变分水平集框架的胶质母细胞瘤组织的细胞核分割方法。通过谱聚类和稀疏编码,利用一组形状先验来适应复杂的形状变换。然后通过种子检测算法实现目标轮廓的自动初始化。最后通过最小能量函数实现目标函数的变形。Zhang等[8]采用局部自适应图分割(local adaptive graph cut,LAGC)用于异常细胞核的分割。首先进行细胞核的预分割,将预分割后的图像从笛卡尔坐标系映射到极坐标系构造图。然后为图中的每个节点分配核的特定成本,确定成本最低的全局最优路径。最后通过反转初始展开变换,将路径映射到原子图像上,得到改进的核边界。刘侠等[9]提出使用改进的基于隐马尔科夫随机场框架分割脊柱CT图像。由隐马尔科夫随机场建立分类的先验分布,并添加记忆器的模拟退火算法、期望最大化算法和最大后验估计准则来进行参数估计并得到最终结果。刘露等[10]提出一种基于视觉显著模型的正电子发射型计算机断层显像(positron emission computed tomography,PET)图像快速分割算法。首先使用优化的Itti视觉显著模型替代人工操作对PET图像进行快速识别,并将获得的显著图进行预处理,初始化前景区与背景区的高斯混合模型,最后使用优化的GrabCut算法对PET显著图进行分割获得结果。杨金鑫和Song等[11-12]以卷积神经网络为基础,结合染色校正方法和简单线性迭代的超像素聚类算法,提出了一种新的结构来分割细胞图像。Song等[13]提出了一种多尺度卷积神经网络(multi-scale convolutional network, MSCN)和基于图形分割的宫颈细胞浆和细胞核精准分割方法。通过MSCN进行深度学习[14],提取尺度不变的特征进行粗分割;然后利用一种基于预训练特征的自动图像分割方法改进粗分割;同时利用超像素代替原始像素,降低了分割的复杂度。Hou等[15]提出一种稀疏卷积自动编码器(convolutional autoencoder,CAE)方法,检测组织病理学图像中的细胞核。CAE检测组织图像中的核并将其编码为稀疏特征图,包括核的位置和外观。Ronneberger等[16]提出了将U-Net网络应用于医学图像分割任务。U-Net是一个“完全卷积网络”,采用的是一个包含下采样和上采样的网络结构,下采样来逐渐展现环境信息,而上采样的过程是结合下采样各层信息和上采样的输入信息来还原细节信息,逐步还原图像精度。Johnson[17]提出使用带有特征金字塔网络结构的Mask R-CNN模型用于细胞核的分割。
以上提出的阈值分割方法存在对比度较低,背景噪声较大、核不规则的情况下分割效果不理想等问题,并易于出現欠分割或者过分割。图分割方法在处理大规模图像时需要耗费大量的时间。且上述方法大都针对不含有病变细胞的阴性细胞图像,对含有阳性细胞的图像不具有鲁棒性。将深度神经网络应用于图像的语义分割任务,虽能较好的解决上述问题,但是训练深度网络在计算和调试方面的成本较高,且可解释性较差。
为了便于分割,本文首先将获取的原宫颈细胞图像由RGB颜色空间转换为HSV颜色空间。然后根据细胞图像的特点,按照固定的权值组合通道。对获得的单通道图像,采用优化后的最大稳定极值区域 (maximally stable extremal regions, MSER)算法进行细胞核的粗分割。最后对粗分割区域做灰度直方图统计,利用直方图做凸包检测,寻找其中的最远距离点,对图像做自适应的阈值分割,并对得到的轮廓做特征提取,训练分类器,确实最终获得的有效细胞核区域。本文的方法在稳定性、鲁棒性和精度等方面对细胞核的分割均有较好的性能。
1 算法的实现
1.1 基于优化MSER算法的细胞核粗分割
1.1.1 颜色空间转换
本文获取的源宫颈细胞图像均为RGB三通道图像。RGB颜色空间是一种很不均匀的颜色空间,红(R)、绿(G)、蓝(B)三种颜色分量相互联系,相关性较高,且直接利用这些分量很难达到分割所需的效果[18]。而HSV(hue-saturation-value)颜色空间更侧重于色彩表示,是较为均匀的颜色空间[19]。它共有H、S、V 3个分量,其中H表示色相,是在不同波长的光照射下,人眼所感觉到的不同的颜色;S表示饱和度,是颜色的纯度,与图像的颜色深浅有关,颜色越深,饱和度越高;V表示明度,是颜色的明亮程度,和图像的颜色信息无关。
本文采用的细胞图像,在RGB颜色空间中,细胞核经过巴氏染色主要为深蓝色,上皮细胞的细胞浆主要被染为绿色、粉红色、蓝色等[20],细胞核和细胞浆的颜色区分度不大。而且,在不同的光照条件下,RGB各通道的值较为分散,且细胞核区域在RGB空间下的表示不稳定。针对以上问题,本文将图像由RGB颜色空间转换为HSV颜色空间。由于H通道对于细胞核和细胞浆的区分度不大,在本文算法中,我们不予考虑。在多数的液基薄层细胞检测(thinprep cytologic test,TCT)图像中,细胞核与细胞浆和背景相比,颜色较深,饱和度相对较高,亮度较低。MSER[21]检测的是区域特征,变换后图像的细胞核区域更加显著,方便后续的细胞核分割,避免了根据RGB颜色信息难以准确分割的问题。
实验表明,有些图像存在细胞核着色过浅或着色过深的情况,综合考虑上述情况,将上述的饱和度通道(S)和亮度通道(V)图像分别赋予一定的权值进行组合。为了统一标准,首先反转S通道,然后用参数α控制饱和度和明度所占的权重,如下所示:
I=α(255-S)+(1-α)V(1)
其中:I表示最终获得的图像;α表示饱和度所占的比重,通过多次实验的对比效果确定参数α的值。通过上述处理,增强了图像中细胞核区域的稳定性,将上述得到的图像作为MSER算法的输入。
1.1.2 基于灰度均值和差异量的MSER优化算法
MSER算法由Matas等[22]借鉴分水岭算法的思想提出[23],首先对图像进行二值化,二值化阈值从0至255不断上升,这样二值化图像就经历一个从全黑到全白的过程。在这个过程中,有些连通区域的面积随阈值上升的变化很小,这种区域就叫MSER。该算法最初用于在两个不同视角的图像中寻找对应关系,这种方法从图像中提取全面的元素对应关系,最初用于宽基线匹配问题以及更好的立体匹配和物体识别算法。一直以来,人们对MSER的研究和应用主要集中在和视觉相关的单模图像处理中,如立体匹配任务和目标跟踪任务中,在车牌的检测和识别中也应用较多。MSER算法主要描述的是漫水过程中具有局部稳定特性的极值区域。由于细胞核形态的特殊性,它通常有小的均勻的较灰暗的区域组成,MSER算法的思想很适用于细胞核的分割任务。
区域分割是本文的细胞核分割算法中最重要的一部分,分割出的疑似细胞核区域不仅可以加快后续的处理速度,同时可以在其区域上提取形态学特征,并最终根据提取到的特征训练分类器确定该区域是否为最终的细胞核区域。本文通过灰度均值和灰度差异量对MSER算法进行优化,然后将其引入到宫颈细胞核的分割中,取得了良好的效果。下面首先给出原MSER算法的数学定义:
q(i)=|Qi+Δ-Qi-Δ||Qi|(2)
式中:Qi表示阈值为i时的某一连通区域;Δ为灰度阈值的微小变化量;q(i)为阈值是i时区域Qi的变化率。当q(i)为局部极小值时,则Qi为最大稳定极值区域。
由于细胞核和细胞浆的灰度值差异,且MSER算法在计算极值区域的过程中有灰度值的统计,在MSER算法中加入灰度均值变量,数学表示如下:
gi=Qi-Δgi-Δ+(Qi-Qi-Δ)iQi(3)
式中:gi表示阈值为i时的某一连通区域的灰度均值。在一张宫颈细胞图像中,细胞核的大小不一,且多数情况下,阳性细胞核比正常的细胞核面积大。为了尽可能多的找到所有的细胞核且不遗漏阳性细胞核,在进行MSER算法处理的过程中,将连通区域的面积设置为一个较大的范围,避免细胞核的过分割。同时由于面积范围设置的较大,导致得到的轮廓会包含多余的细胞浆部分,存在欠分割的问题。为了去除这些冗余的轮廓,在MSER算法中加入衡量轮廓灰度值稳定性的灰度差异量,数学表示如下:
di=(Qi-Qi-Δ)Qi-Δ(gi-gi-Δ)(4)
式中:di表示阈值为i时的某一连通区域的灰度差异量。在处理细胞图像的过程中,通过上述两个变量的加入,MSER算法在处理细胞核的过程中能够有效地过滤掉多余的胞浆区域。
1.2 自适应阈值的细胞核精细分割
1.2.1 自适应阈值分割
经过粗分割得到的区域轮廓内会包含部分颜色较深的细胞浆区域。为了去除细胞浆区域,首先对得到的轮廓做灰度直方图,然后利用直方图做凸性检测选取合适的阈值进行阈值分割。本文利用灰度直方图统计图像的灰度值,灰度直方图的计算公式如下:
p(rk)=nkMN(5)
式中:rk为像素的灰度级;nk为具有灰度rk的像素的个数;MN为图像中总的像素个数。为了去除部分随机噪声的影响,将绘制的直方图作均值滤波以实现图像的平滑模糊处理。
多数情况下,粗分割后的图像中除细胞核外还存在部分的细胞浆区域,在灰度直方图中常会形成双峰。而细胞核和细胞浆的灰度值有着明显的差异,细胞核颜色较暗,灰度值较低;而细胞浆相对而言较亮,灰度值较高。在直方图中,这两个双峰分别对应于细胞核和细胞浆部分,如图1所示。若MSER算法的分割效果较好,则细胞浆的含量较低,在灰度直方图中表现为单峰和右侧的一个较小峰,如图1(a)和图1(b)所示。同样,左侧的单峰对应于细胞核的灰度值范围。本文通过选取合适的阈值进行阈值分割,将细胞浆去除。阈值分割中选取合适的阈值至关重要,根据灰度直方图,双峰之间的谷底应为所求的阈值。
Fig.1 The histogram of contours after segmentation
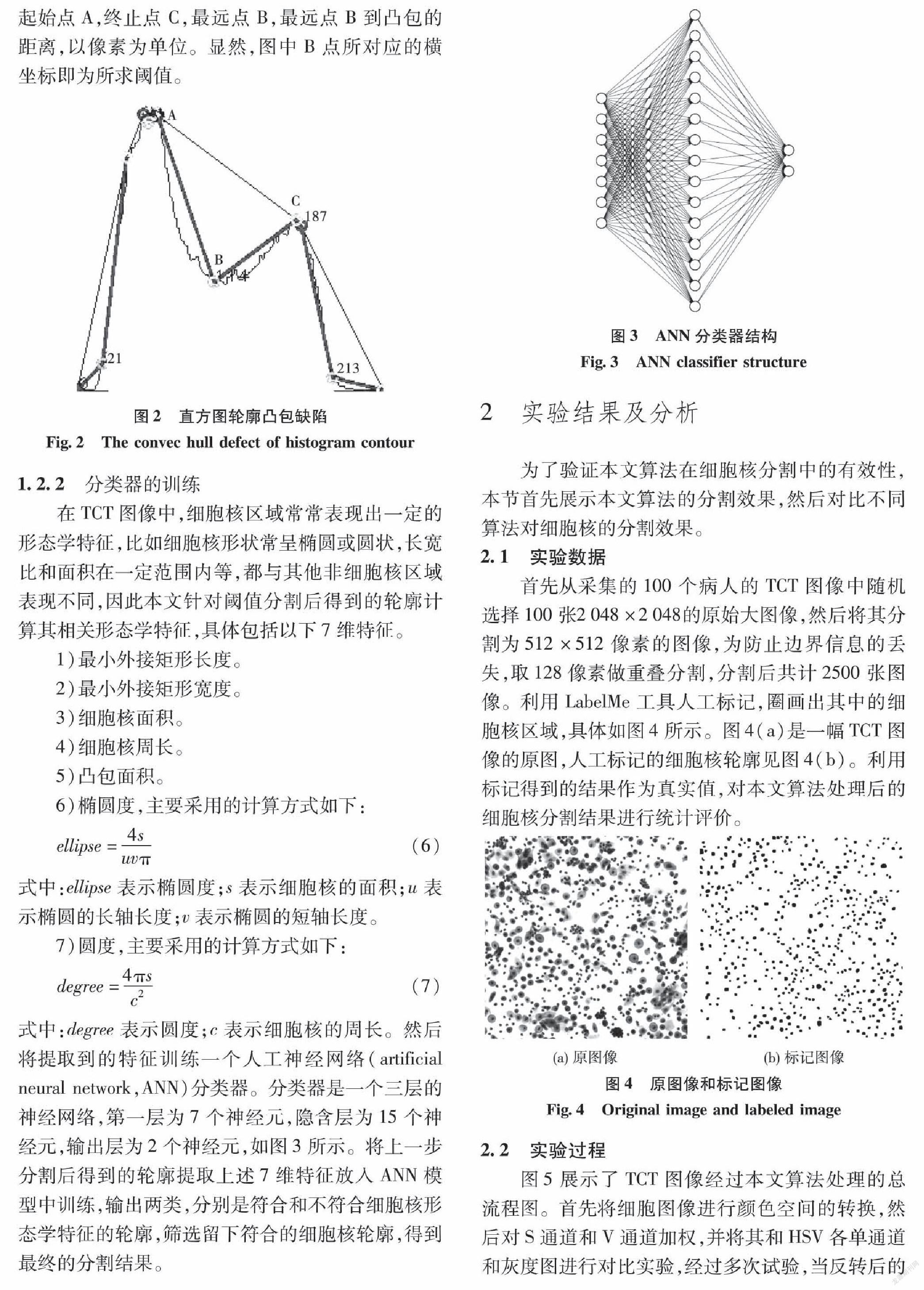
为了获得直方图谷底阈值,本文采用滤波处理后的图像做凸性缺陷检测[24]。首先采用快速凸包算法获得灰度直方图轮廓的凸包,然后利用缺陷点计算出波谷的坐标。根据图像的灰度直方图计算轮廓的凸缺陷,如图2所示。凸包缺陷包含4个信息:起始点A,终止点C,最远点B,最远点B到凸包的距离,以像素为单位。显然,图中B点所对应的横坐标即为所求阈值。
1.2.2 分类器的训练
在TCT图像中,细胞核区域常常表现出一定的形态学特征,比如细胞核形状常呈椭圆或圆状,长宽比和面积在一定范围内等,都与其他非细胞核区域表现不同,因此本文针对阈值分割后得到的轮廓计算其相关形态学特征,具体包括以下7维特征。
1)最小外接矩形长度。
2)最小外接矩形宽度。
3)细胞核面积。
4)细胞核周长。
5)凸包面积。
6)椭圆度,主要采用的计算方式如下:
ellipse=4suvπ(6)
式中:ellipse表示椭圆度;s表示细胞核的面积;u表示椭圆的长轴长度;v表示椭圆的短轴长度。
7)圆度,主要采用的计算方式如下:
degree=4πsc2(7)
式中:degree表示圆度;c表示细胞核的周长。然后将提取到的特征训练一个人工神经网络(artificial neural network,ANN)分类器。分类器是一个三层的神经网络,第一层为7个神经元,隐含层为15个神经元,输出层为2个神经元,如图3所示。将上一步分割后得到的轮廓提取上述7维特征放入ANN模型中训练,输出两类,分别是符合和不符合细胞核形态学特征的轮廓,筛选留下符合的细胞核轮廓,得到最终的分割结果。
2 实验结果及分析
为了验证本文算法在细胞核分割中的有效性,本节首先展示本文算法的分割效果,然后对比不同算法对细胞核的分割效果。
2.1 实验数据
首先从采集的100个病人的TCT图像中随机选择100张2048×2048的原始大图像,然后将其分割为512×512像素的图像,为防止边界信息的丢失,取128像素做重叠分割,分割后共计2500张图像。利用LabelMe工具人工标记,圈画出其中的细胞核区域,具体如图4所示。图4(a)是一幅TCT图像的原图,人工标记的细胞核轮廓见图4(b)。利用标记得到的结果作为真实值,对本文算法处理后的细胞核分割结果进行统计评价。
2.2 实验过程
圖5展示了TCT图像经过本文算法处理的总流程图。首先将细胞图像进行颜色空间的转换,然后对S通道和V通道加权,并将其和HSV各单通道和灰度图进行对比实验,经过多次试验,当反转后的S通道和V通道以3∶7加权后的图像在本算法中表现最好,具体如图6所示。接下来采用优化后的MSER算法对加权后的图像进行处理,图7显示了MSER算法优化前后处理的对比图。将经过筛选后的图像做凸性缺陷检测,找到合适的阈值,在上一步得到的轮廓基础上做阈值分割。最后提取轮廓特征,并训练分类器进行识别,以确定最终的细胞核轮廓,分类器识别前后的对比图如图8所示。
2.3 评价指标
如图9所示,中部的轮廓部分为真实的边界部分,即人工标记的部分,上部的轮廓部分为算法处理得到的分割结果图。图中A为过分割的部分,即假阳性(FP);B为欠分割的部分,即假阴性(FN);C为正确分割的部分,即真阳性(TP)。则准确率(accuracy)可表示为算法分割得到的轮廓中正确分割所占的比例,可用如下公式计算:
accuracy=TP(FP+TP)(8)
召回率(Recall)可表示为针对真实的标记轮廓,算法分割得到的轮廓所占的比例,计算方式如下:
recall=TP(TP+FN)(9)
交并比(intersection-over-union,IoU)[25]可表示为,分割得到的轮廓和标记得到的轮廓之间的交集和并集的比值,可用如下公式表示:
IoU=C/(A+B+C)(10)
本文采用上述3个指标进行分割效果的评价。
2.4 效果评价
将本文提出的算法与文[3]中的迭代阈值分割方法进行对比,从而验证文本分割算法的有效性。迭代阈值分割主要通过不断增加阈值使其区域自然生长,然后根据其特征(例如平均强度,坚固性,标准偏差,圆形度和尺寸大小)进行过滤。同时文[16]中提出的U-Net是近几年提出主要用于医学图像语义分割的网络模型,U-Net是一个编码器-解码器结构,编码器逐渐减少池化层的空间维度,解码器逐步修复图像的细节和空间维度。它们之间存在快捷连接,因此能帮助解码器更好地修复目标的细节。如图10所示,展示了本文的分割算法和两个对比方法对TCT图像的分割效果。
其中图10(a)是宫颈细胞原图像,图10(b)是手工标记的细胞核轮廓,图10(c)是用迭代阈值分割方法得到的细胞核轮廓,图10(d)是用U-Net分割方法得到的细胞核轮廓,图10(e)是本文算法得到的细胞核轮廓。表1是采用上述评价方法对分割效果进行统计得到的数据。如图10所示,采用迭代阈值分割方法和U-Net分割方法时,存在欠分割问题,部分灰度值较低的细胞浆被误认为细胞核区域。图11是以交并比在0.05~0.5之间,图像中细胞核找到的概率。结果表明,本文算法优于迭代阈值分割方法和U-Net分割方法。
3 结 论
本文算法主要是利用优化的MSER算法对细胞核进行欠分割,通过阈值分割提取形态学特征训练分类器等方法提升分割的效果。本文所提出的方法针对阴性细胞核和阳性细胞核均有较好的分割效果。从实验结果来看,本文算法提升了粗分割效率,能够基本满足自动阅片系统中宫颈癌筛查的细胞核分割需求。但是由于人体细胞自身的复杂性和制片等原因造成的细胞粘连过严重的情况,或者由于采图过程中聚焦不清获得的细胞图像较为模糊,都会降低本文分割算法的准确度,故此算法还有待进一步改进。
参 考 文 献:
[1] 尤小燕, 王雅莉, 刘文枝, 等. 高危型 HPV 联合细胞学检测在宫颈癌及癌前病变筛查中临床意义[J]. 实用预防医学,2017,24(8):986.
YOU X, WANG Y, LIU W, et al. Clinical Significance of High-risk HPV-DNA Detection Combined with Liquid-based Cytology Test in Screening for Cervical Cancer and Precancerous Lesions[J]. Practical Preventive Medicine, 2017,24(8):986.
[2] 杨敏. 美国最新子宫颈癌筛查指南的介绍[J].中华妇产科杂志,2013,48(5): 394.
YANG M. Introduction of the Latest Cervical Cancer Screening Guidelines in the United States[J]. Chinese Journal of Obstetrics and Gynecology, 2013,48(5):394.
[3] PHOULADY H A, GOLDGOF D, HALL L O, et al. A Framework for Nucleus and Overlapping Cytoplasm Segmentation in Cervical Cytology Extended Depth of Field and Volume Images[J]. Computerized Medical Imaging and Graphics, 2017, 59: 38.
[4] PLISSITI M E, NIKOU C, CHARCHANTI A. Watershed-based Segmentation of Cell Nuclei Boundaries in Pap Smear Images[J]. Information Technology & Applications in Biomedicine IEEE International Conference, 2010:1.
[5] ASLI G, AKSOY S, SEVGEN O. Unsupervised Segmentation and Classification of Cervical Cell Images[J]. Pattern Recognition, 2012, 45(12):4151.
[6] LI K, LU Z, LIU W, et al. Cytoplasm and Nucleus Segmentation in Cervical Smear Images Using Radiating GVF Snake[J]. Pattern Recognition, 2012, 45(4):1255.
[7] ZHANG P, WANG F, TEODORO G, et al. Effective Nuclei Segmentation with Sparse Shape Prior and Dynamic Occlusion Constraint for Glioblastoma Pathology Images[J]. Journal of Medical Imaging, 2019, 6(1): 017502.
[8] ZHANG L, KONG H, LIU S, et al. Graph-based Segmentation of Abnormal Nuclei in Cervical Cytology[J]. Computerized Medical Imaging and Graph, 2017, 56:38.
[9] 劉侠, 匡瑞雪, 王波, 等. 基于隐马尔可夫场的脊柱CT 图像分割算法[J]. 哈尔滨理工大学学报, 2018(2):1.
LIU X, KUANG R, WANG B, et al. Segmentation Algorithm of Spine CT Image Based on Hidden Markov Random Field[J]. Journal of Harbin University of Science and Technology, 2018(2):1.
[10]刘露, 于晓婷, 丁博. 一种基于视觉显著模型的PET图像快速分割算法[J]. 哈尔滨理工大学学报, 2017(4):40.
[11]杨金鑫, 李灵巧, 潘细朋, 等. 结合卷积神经网络和超像素聚类的细胞图像分割方法[J]. 计算机应用研究, 2018(5):1569.
YANG J, LI L, PAN X, et al. Cell image Segmentation Method Based on Convolution Neural Network and Super Pixel Clustering[J]. Application Research of Computers, 2018(5):1569.
[12]SONG Y, ZHANG L, CHEN S,et al. A Deep Learning Based Framework for Accurate Segmentation of Cervical Cytoplasm and Nuclei//2014 36th Annual International Conference of the IEEE Engineering in Medicine and Biology Society, Chicago, 2014.
[13]SONG Y, ZHANG L, CHEN S, et al. Accurate Segmentation of Cervical Cytoplasm and Nuclei Based on Multiscale Convolutional Network and Graph Partitioning[J]. IEEE Transactions on Biomedical Engineering, 2015, 62(10):2421.
[14]LECUN Y, BENGIO Y, HINTON G. Deep Learning[J]. Nature, 2015, 521(7553):436.
[15]HOU L, NGUYEN V, KANEVSKY A B, et al. Sparse Autoencoder for Unsupervised Nucleus Detection and Representation in Histopathology Images[J]. Pattern Recognition, 2019, 86: 188.
[16]RONNEBERGER O, FISCHER P, BROX T. U-Net: Convolutional Networks for Biomedical Image Segmentation[C]//International Conference on Medical Image Computing & Computer-assisted Intervention, 2015.
[17]JOHNSON J W. Adapting Mask-RCNN for Automatic Nucleus Segmentation[J]. Proceeding of the 2019 Computer Vision Conference, 2018,2:1.
[18]NANDAL A, BHASKAR V, DHAKA A. Contrast-based Image Enhancement Algorithm Using Grey-scale and Colour Space[J]. Iet Signal Processing, 2018, 12(4):514.
[19]UEDA Y, KOGA T, MISAWA H, et al. Gradient-norm-based Histogram Equalization Taking Account of HSV Color Space Distribution[J]. Optical Review, 2017, 24(3):1.
[20]SINGH U, ANJUM, QURESHI S, et al. Comparative Study Between Liquid-based Cytology & Conventional Pap Smear for Cytological Follow Up of Treated Patients of Cancer Cervix[J]. Indian Journal of Medical Research, 2018, 147(3):263.
[21]DONOSER M, BISCHOF H. Efficient Maximally Stable Extremal Region (MSER) Tracking[C]//2006 IEEE Computer Society Conference on Computer Vision and Pattern Recognition, 2006, 1: 553.
[22]MATAS J, CHUM O, URBAN M, et al. Robust Wide-baseline Stereo from Maximally Stable Extremal Regions[J]. Image and Vision Computing, 2004, 22(10): 761.
[23]TAREEF A, SONG Y, HUANG H, et al. Multi-pass Fast Watershed for Accurate Segmentation of Overlapping Cervical Cells[J]. IEEE Transactions on Medical Imaging, 2018, 99:1.
[24]CUPEC, FILKO R, NYARKO D, et al. Segmentation of Depth Images into Objects Based on Local and Global Convexity[C]// Proceedings of the European Conference on Mobile Robotics, 2017.
[25]JACCARD P. The Distribution of the Flora in the Alpine Zone[J]. New Phytologist, 1912, 11(2): 37.
(編辑:温泽宇)
收稿日期: 2019-09-06
基金项目: 国家自然科学基金面上项目(61673142);黑龙江省自然科学基金杰出青年项目(JJ2019JQ0013);哈尔滨市杰出青年人才基金(2017RAYXJ013);黑龙江省自然科学基金面上项目(F2017013);黑龙江省普通本科高等学校青年创新人才项目(UNPYSCT-2016034).
作者简介:
张雪媛(1994—),女,硕士;
邵慧丽(1994—),女,硕士.
通信作者:
何勇军(1980—),男,教授,博士研究生导师,E-mail:holywit@163.com.
