小麦应对Cu2+胁迫的生理响应及ASA-GSH合成酶基因表达
2021-03-12郑永兴李鸽子康国章
郑永兴, 李鸽子, 康国章
(河南农业大学农学院, 国家小麦工程技术研究中心, 省部共建小麦玉米作物学国家重点实验室, 郑州 450046)
铜(Cu2+)是植物生长发育必需的微量元素之一,它参与植物的光合作用和一些必需的氧化还原反应,对植物的生长发育至关重要。然而过量的Cu2+损害植物细胞产生活性氧(reactive oxygen species,ROS),进而导致膜脂过氧化,使其体内的生理代谢紊乱,严重阻碍植物的生长发育[1-3]。近年来的研究表明,Cu2+作为重要的污染元素之一,影响农作物的正常生长和代谢,已对人类健康造成了较为严重的危害[4-5]。薛盈文等[6]研究表明,低浓度Cu2+促进小麦种子萌发,而高浓度Cu2+则抑制小麦种子发芽,且小麦生长发育随着Cu2+浓度的增高而受阻,说明高浓度Cu2+严重影响了小麦种子萌发和生长发育。张刚等[7]对黑麦草进行不同浓度Cu2+胁迫处理发现,高浓度和长时间Cu2+胁迫降低黑麦草的发芽率、抑制根系生长和叶片叶绿素含量的增加。植物在长期的自然进化过程中已形成了一系列较为完善的自我防御机制,主要包括酶促反应和非酶促反应[8],其中超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)、过氧化氢酶(catalase,CAT)等参与酶促反应,抗坏血酸(ascorbate,ASA)和谷胱甘肽(glutathione,GSH)等参与非酶促反应。其中,ASA-GSH循环是植物应对胁迫反应中不可或缺的非酶促反应,主要通过还原型的抗氧化物ASA和GSH、抗坏血酸过氧化物酶(ascorbate peroxidase, APX)、单脱水抗坏血酸还原酶(monodehydroascorbate reductase, MDHAR)、抗坏血酸还原酶(dehydroascorbate reductase, DHAR)和谷胱甘肽合成酶(glutathione reductase, GR)等多个酶促反应共同作用从而实现H2O2清除及ASA和GSH再生的过程,最终实现ASA-GSH循环反应来维持细胞氧化还原稳态,进而提高植物在逆境胁迫条件下的抗逆性[8-10]。Zeng等[11]研究发现,水稻汞耐性相关突变体植株中ASA-GSH循环比野生型植株能更有效地清除胁迫条件下产生的活性氧,说明ASA-GSH循环在水稻应对Hg2+胁迫过程中发挥了重要的作用,但具体的作用机制研究还未见报道。
目前,植物铜胁迫的研究多集中在其应对胁迫耐性的酶促和非酶促反应等生理作用机制方面,不能明确具体的相关作用机理[12-14]。因此,本研究利用不同浓度的Cu2+处理小麦幼苗,测定了胁迫条件下的生长参数、受伤害程度、及非酶促反应相关参数ASA和GSH等生理指标,并在此基础上,检测了ASA-GSH循环中 4个关键酶基因APX、DHAR、GR和MDHAR在转录水平上的表达差异,同时在生理和转录水平上探究了铜胁迫对小麦的伤害机理,为后续小麦铜污染相关的防御治理和小麦等粮食作物的生态环境评价提供了一定的理论依据。
1 材料与方法
1.1 试验材料
供试材料为现今在黄淮海麦区大面积种植的小麦品种‘百农207’,种子由河南科技学院欧行奇教授和朱启迪博士提供。
1.2 试验方法
1.2.1试验设计 种子经0.01% HgCl2消毒处理后,用蒸馏水清洗3次。在培养皿中用清水浸泡种子,直至种子萌动,挑选大小一致的萌动种子约60颗分别放于直径为15 cm的培养皿中,将其置于LED光照培养箱(宁波扬辉仪器有限公司)进行培养,昼/夜培养条件16/8 h、24/18 ℃,光照10 000 lx,参照Li等[15]和Kang等[16]的研究方法,每隔1 d换一次1/2 Hoagland’s营养液。将小麦幼苗培养至三叶期,对小麦幼苗进行不同浓度CuSO4·5H2O处理,共设置0、0.05、0.10、0.50、1.00 mmol·L-1Cu2+5个处理,处理液为不同浓度Cu2++ 1/2 Hoagland’s营养液,处理10 d后,每个处理单独采样,测定相关生理指标。
1.2.2生长参数及生理指标测定 在胁迫处理的第10 d, 每个处理随机挑选3~5棵小麦幼苗,测定其株高、根长、总鲜重、总干重等生长参数。分别取小麦幼苗的叶片及根各0.2 g,每个处理重复3次,利用组织研磨仪(SCIENTZ-48, 宁波新芝生物科技股份有限公司)研磨后分别加入2 mL 10% 三氯乙酸(TCA),混匀后再分别加入4 mL 10% TCA, 4 ℃、4 537 r·min-1离心10 min, 转移上清液到新的离心管中,用于丙二醛(malondialdehyde,MDA)、抗坏血酸(ascorbate, ASA)、谷胱甘肽(glutathione, GSH)含量的测定。丙二醛含量采用硫代巴比妥酸法[15-16];抗坏血酸含量的测定,参考Kampfenkel等[17]方法;谷胱甘肽含量的测定参考Simth[18]方法;H2O2含量的测定参考Shan等[19]方法。
1.2.3基因表达量的测定 利用Trizol法提取小麦叶片和根系RNA,用TAKARA荧光定量反转录试剂盒合成dsDNA,于-20 ℃保存;进而采用荧光定量PCR(quantitative real-time PCR, qPCR)测定基因的表达量[20]。由于普通小麦为异源六倍体(AABBDD),每个基因至少存在3个以上的拷贝,且3个拷贝之间cDNA序列的同源性在95%以上[21]。基于此,本研究根据已知的基因序列,在小麦IWGSC数据库同源搜索到相对应的染色体信息,在Ohdan等[22]研究基础上,利用Primer 5.0软件设计ASA-GSH合成途径的4个合成酶基因的引物(表1)。引物合成由河南尚亚生物技术有限公司完成。qPCR反应程序参考Li等[23]和Livak等[24]方法进行,以Actin为内参基因,每个处理重复3次,以2-ΔΔCT方法检测相关基因的表达量。

表1 qPCR引物Table 1 Primers for qPCR
1.3 数据处理
利用SPSS Statistics 19.0软件(IBM)进行方差分析,并利用Origin 9.0进行制图。
2 结果与分析
2.1 不同浓度Cu2+处理对小麦生长的影响
不同浓度Cu2+溶液处理三叶期的小麦幼苗10 d后,小麦植株的生长发育受到限制,叶片出现下垂、发黄、卷曲等症状(图1)。生长参数测定结果(表2)表明,与对照相比,0.05、0.10、0.50、1.00 mmol·L-1Cu2+处理的小麦植株的株高分别下降13.90%、12.36%、27.32%、33.01%;根长分别下降21.20%、20.61%、32.60%、41.47%;植株总鲜重分别显著降低了6.19%、21.41%、44.39%、59.53%;植株总干重与对照相比也显著降低,分别降低了15.11%、15.11%、19.76%、40.31%, 其中,0.05、0.10、0.50 mmol·L-1Cu2+处理间总干重差异不显著。同时,小麦长势观察显示,小麦植株受伤害的程度随着Cu2+浓度的增高而不断增加,其中,0.50和1.00 mmol·L-1两个浓度处理的小麦植株出现了叶片下垂、失绿甚至枯萎现象(图1,表2)。说明小麦植株在防御逆境胁迫条件下其自身的抗氧化系统被激发,影响了植株体内水分的分配和利用,进而阻碍了其自身正常的生长发育。
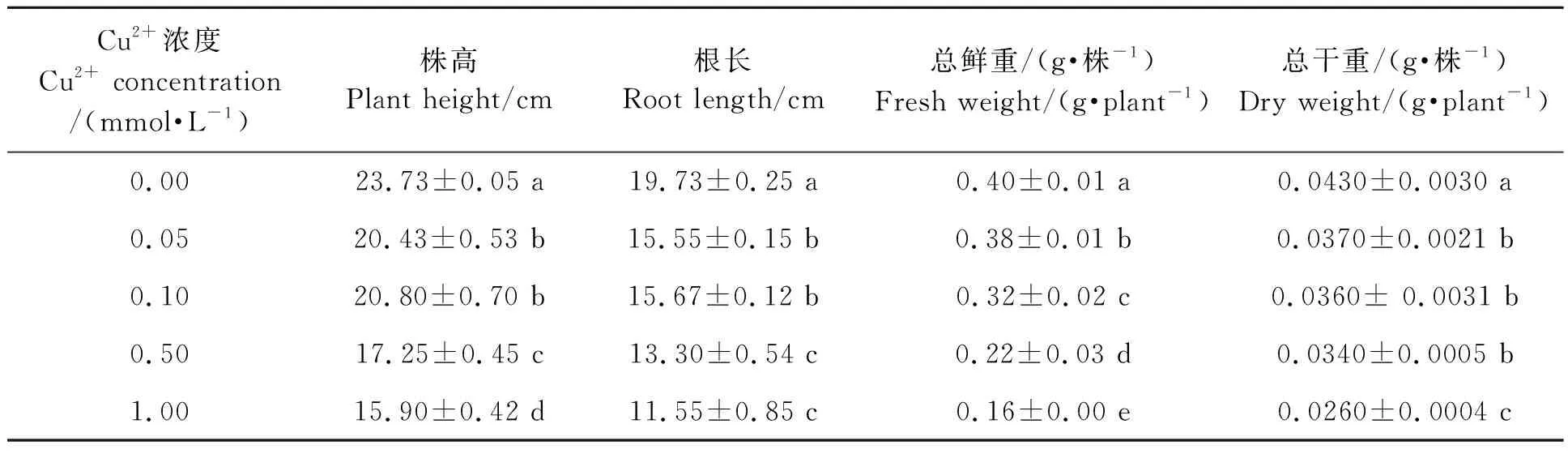
表2 不同浓度Cu2+处理的小麦幼苗生物量Table 2 Biomass of wheat seedlings treated with different Cu2+concentrations
2.2 不同浓度Cu2+处理对MDA和H2O2含量的影响
植物在应对胁迫反应过程中,其体内的膜脂过氧化物MDA和活性氧(如H2O2)不断增加。小麦叶片和根系的MDA和H2O2含量结果(图2)显示,随着Cu2+浓度的升高,叶片和根系的MDA和H2O2含量均呈现不断增加的趋势。不同处理间的叶片和根系的MDA含量均存在显著性差异,且高浓度(1.00 mmol·L-1)Cu2+处理的小麦植株的叶片和根系中MDA含量达到最大值,其含量分别是对照植株的7.56和19.15倍;0.10、0.50和1.00 mmol·L-1Cu2+处理的小麦植株叶片和根系的H2O2含量与对照也均存在显著差异,其在叶片中的含量分别是对照处理的1.31、1.50和1.80倍,在根系中的含量分别是对照的1.17、1.36和1.72倍。3个处理间叶片和根系的H2O2含量也均存在显著差异。由此说明,Cu2+胁迫诱导小麦植株体内H2O2含量增加,从而引起其细胞膜的膜脂过氧化,破坏植株的正常生长发育。
2.3 不同浓度Cu2+处理对ASA和GSH含量的影响
胁迫条件下,植物体内抗氧化系统的重要成员ASA和GSH增加,能有效清除其体内活性氧的积累,来维护植物细胞免受胁迫所引发的氧化损伤。由表3可知,叶片中ASA含量在0.05 mmol·L-1处理条件下达到最高值,其含量比对照处理提高13.11%;0.10和1.00 mmol·L-1处理分别比对照显著增加5.54%和6.70%,而0.50 mmol·L-1处理则显著减少22.59%;在根系中,0.50 mmol·L-1Cu2+处理的ASA含量最高,是对照处理的10.33倍,0.05和1.00 mmol·L-1处理分别比对照显著增加25.19%和286.63%,0.10 mmol·L-1处理比对照显著降低69.77%。在0.05 mmol·L-1Cu2+处理条件下叶片中GSH 含量比对照显著降低32.28%,而根系中GSH 含量则与对照处理无显著差异;0.10、0.50和1.00 mmol·L-1Cu2+处理的叶片GSH含量显著高于对照处理32.54%、40.06% 和129.11%,0.50和1.00 mmol·L-1Cu2+处理的根系GSH含量显著高于对照201.86%和368.18%。表明不同浓度 Cu2+处理条件下,小麦植株可通过体内ASA和GSH含量的差异变化来维持和适应逆境胁迫所引发的体内抗氧化平衡系统,进而参与小麦应对Cu2+胁迫的响应。

表3 不同浓度Cu2+处理小麦幼苗的ASA和GSH含量Table 3 Contents of ASA and GSH of wheat seedling in different Cu2+ concentrations
2.4 不同浓度Cu2+处理条件下4个ASA-GSH关键酶基因的变化
由图3可知,APX基因在叶片和根系中的表达谱基本一致,在低浓度(0.05和0.10 mmol·L-1)Cu2+处理下表达显著低于对照处理,其表达量在叶片中分别比对照显著降低11.05%、31.74%,根系中较对照显著降低19.79%、68.13%;高浓度(0.50和1.0 mmol·L-1)Cu2+处理下其表达量在叶片中分别比对照处理显著增加2.19、2.67倍,根系中显著增加1.18、3.25倍。DHAR和GR基因在叶片和根系中表达谱基本相似,其在叶片中均表现出低浓度(0.05和0.10 mmol·L-1)Cu2+处理表达量升高,而高浓度(0.50和1.0 mmol·L-1)Cu2+处理降低的趋势。DHAR在0.05和0.10 mmol·L-1浓度分别增加到对照的2.05、2.00倍,GR增加到对照的2.10、2.56倍;在0.50和1.00 mmol·L-1浓度处理下DHAR的表达量分别比对照处理降低96.34%和69.42%,而GR的表达量在0.50 mmol·L-1Cu2+处理条件下为对照的1.42倍,但1.00 mmol·L-1Cu2+处理与对照无显著差异。在根系中,DHAR和GR的表达量均随着Cu2+处理浓度增加呈现递增趋势,0.05、0.10、0.50和1.00 mmol·L-1Cu2+处理的DHAR表达量分别增加到对照的1.42、3.06、5.33和3.56倍,4个处理的GR表达量分别增加到对照的1.63、2.09、3.61和3.77倍。在小麦叶片中,基因MDHAR在0.05和0.1 mmol·L-1Cu2+的表达谱与DHAR和GR基因相似,表达量均显著高于对照植株,为对照的2.82倍和2.23倍;在1.0 mmol·L-1Cu2+处理的表达量显著提高,为对照的2.61倍;但0.50 mmol·L-1Cu2+的表达量显著低于对照处理。在小麦根系中,MDHAR基因的表达谱与基因APX相似,在0.10、0.50和1.00 mmol·L-1Cu2+处理下表达量分别显著提高为对照的1.45、2.71和8.13倍。推测这些基因在不同组织间的差异表达可能与物种响应Cu2+胁迫的机制及处理浓度有关。
3 讨论
重金属胁迫影响作物的生长发育、使其产量下降,严重情况下可使其死亡甚至物种消失[5]。小麦作为世界上最重要的粮食作物之一,在其生长发育过程中经受着不同的胁迫伤害。有研究指出,过量Cu2+激活植物的POD、CAT、SOD酶促相关的保护酶系统,进而通过其在体内活性的增加来参与细胞活性氧的清除,引起膜质过氧化,进而影响小麦正常的生长发育[6]。MDA和H2O2是植物胁迫过程中评价其自身氧化胁迫程度和耐受性的关键指标[25-26]。本研究中,小麦MDA和H2O2含量随着Cu2+浓度的升高呈现逐渐上升趋势,并且小麦长势受阻的表型相对于对照也逐渐明显,说明小麦幼苗对Cu2+非常敏感,铜刺激可使幼苗细胞活性氧增加,引起膜质过氧化,进而阻止小麦幼苗的生长发育。Singh等[27]研究发现,Cu2+毒害通过膜脂损伤影响了小麦根系的生长和生物量的积累,进而影响小麦的正常生长发育;Janas等[28]对Cu2+胁迫下黄瓜幼苗研究也发现,高浓度Cu2+胁迫减缓黄瓜根系生长,使其叶片变黄枯萎,且叶片数量减少。本研究中高浓度的Cu2+积累引起小麦根系细胞氧化损伤,进而形成膜脂损伤,阻止植物对其他矿质元素的吸收利用,使小麦体内营养元素失调,影响其自身的代谢,从而抑制了小麦植株的正常生长发育。
在非生物胁迫条件下,植物抗氧化系统的重要成员ASA和GSH能阻止叶绿体中的ROS 积累,而高浓度ASA和GSH能保护植物细胞免受非生物胁迫引起的氧化损伤[29-30]。本研究结果显示,Cu2+胁迫条件下,除0.10 mmol·L-1处理外,小麦根系ASA和GSH含量显著高于对照处理,尤其在0.50 和1.00 mmol·L-1的高浓度处理下。这与Li等[15]和Kang等[16]的研究结果一致。但在0.50 mmol·L-1Cu2+条件下,小麦幼苗叶片中ASA含量显著低于对照处理,而同处理的根系ASA含量是对照处理的10.33倍,可能是因为在此浓度条件下根系吸收Cu2+水平达到极限水平进而促使该器官中ASA的大量积累,同时植物为维持自身的体内平衡,阻止其向叶片转移,显著降低叶片ASA含量。这些结果表明,植物在不同浓度Cu2+胁迫条件下通过调控其体内不同器官的含量变化来应对逆境胁迫的伤害,进而维持其自身的生命活动。
对Cu2+胁迫的研究多集中在生理水平上,但转录水平通常比酶活性能更准确地反映某一或多种酶在胁迫下的变化,这是因为植物细胞内的酶大多数是由许多不同的同工酶组成,转录水平能够定量测定单一同工酶在植物细胞内不同时空的变化。已有研究表明,不同物种在响应盐、干旱、冷害等的非生物胁迫条件下,ASA-GSH合成相关酶在转录水平上的表达存在差异[15-16,31]。如Li等[15]对小麦幼苗盐胁迫耐性研究发现,其通过影响APX,DHAR,MDHAR等8个ASA-GSH循环相关基因表达,进而参与其对逆境胁迫的伤害。因为,植物应对胁迫耐性中,ASA-GSH循环通过APX酶将胁迫产生H2O2还原为H2O,并生成不稳定的单脱氢抗坏血酸盐(monodehydroascorbate, MDHA)或者发生歧化反应产生脱氢抗坏血酸盐(dehydroascorbate, DHA);进而,MDHA通过MDHAR将其还原为ASA,而DHA则通过DHAR形成氧化型谷胱甘肽(oxidized glutathione, GSSG),在GR的催化下重新生成GSH,达到活性氧清除的目的[32]。因此,本研究利用qPCR的方法辨析了ASA-GSH合成相关4个酶基因APX、DHAR、MDHAR、GR在Cu2+胁迫下的转录表达变化,结果与之前研究[15-16,31]相似,铜胁迫对APX、DHAR、MDHAR、GR基因均有不同程度的诱导表达,且在根系中,参与ASA合成相关酶基因APX和MDHAR的表达趋势一致(图3),而参与GSH合成相关酶基因DHAR和GR的表达趋势相同(图3),说明这些基因在根系受铜胁迫条件下被诱导表达,与ASA和GSH含量的结果一致(表1)。在小麦叶片中,仅参与GSH合成相关酶基因DHAR和GR表达趋势相同(图3),而ASA合成相关酶基因APX仅受高浓度铜胁迫诱导,而MDAHR的表达与铜胁迫浓度相关性不大,是因为APX作为响应胁迫的受体,在低浓度范围内,可维持其正常生长发育,而高浓度则受胁迫诱导而大量表达[32]。而MDAHR则是ASA生产的一个关键酶,因此,该基因在逆境胁迫中均能表达,因此对胁迫浓度不敏感。上述结果说明,小麦在应对铜胁迫耐性过程中,叶片和根系器官ASA-GSH循环存在一定的差异,进而导致了其合成相关基因的差异表达。因此,在铜胁迫条件下,小麦植株通过诱导ASA和GSH合成相关酶基因在根系和叶片器官中的差异表达来协调其植株体内胁迫耐性相关氧化平衡系统,进而提高ASA和GSH的含量来应对Cu2+胁迫。
