南蛇藤多萜通过抑制Chk1介导胃癌细胞DNA损伤并诱导其凋亡
2021-03-11姜壮壮刘延庆
姜壮壮,游 越,赵 阳,陶 丽,刘延庆
(扬州大学 1. 医学院, 2. 国家中医管理局胃癌毒邪论治重点研究室,江苏 扬州 225009)
南蛇藤系为卫矛科植物南蛇藤的藤茎[1],又名过山枫,含有多种药理活性成份如萜类、皂苷类及脂肪类化合物等,具有祛风除湿、通经止痛、抗肿瘤、抗炎等多重药理作用[2]。近年来课题组发现,南蛇藤对多种消化道肿瘤具有显著的体内外抗肿瘤活性,同时对荷瘤小鼠的正常胃肠道、肝肾与造血机能无显著的毒副作用[3]。通过活性追踪、化学分离与结构鉴定,从中药南蛇藤中开发研制南蛇藤多萜(the total terpenoids ofCelastrusorbiculatusThunb.,TTC)主要以五环二萜和三萜类化合物为主[4]。该有效组分对消化道肿瘤表现出较好的抗肿瘤活性,胃癌作为消化系统最常见的恶性肿瘤之一,对其研究多有报道[5-7],但是其具体作用机制尚未明确。
细胞周期检测点激酶1(checkpoint kinase 1,Chk1)是一种丝氨酸/苏氨酸蛋白激酶,在调节肿瘤细胞周期和DNA损伤应答及修复中发挥着关键作用[8]。当癌细胞DNA损伤后细胞的存活依赖于Chk1的激活并启动DNA损伤修复系统,而Chk1被抑制时癌细胞则会失去对DNA损伤的反应和修复能力[9]。因此,抑制Chk1能使癌细胞对细胞毒性药物敏感,已被证明是一个有前途的策略[10]。本研究旨在探讨南蛇藤多萜对Chk1激酶活化的影响以及对胃癌细胞核内DNA完整性的影响,进一步阐明南蛇藤多萜抑制胃癌细胞增殖和诱导凋亡的机制,以期为南蛇藤多萜抗胃癌临床研究提供实验依据。
1 材料与方法
1.1 细胞及细胞培养人胃癌细胞株AGS,MKN-45细胞株购买于中国科学院上海细胞生物学研究所的细胞库,细胞培养在含有10%胎牛血清和1%的抗生素混合物(100 mg·L-1链霉素和100 mg·L-1青霉素)的RPMI-1640培养基中。细胞在37 ℃、含5% CO2的恒温培养箱中孵育。取对数生长期细胞以0.25%胰蛋白酶消化进行实验。
1.2 药物与试剂南蛇藤粉碎过筛后,用95%乙醇加热回流提取3次,旋转蒸发仪回收溶剂得到浸膏,真空低温抽干,再用乙酸乙酯热水浴加热回流,过滤,回收得到乙酸乙酯浸膏。其主要成份为南蛇藤多萜(二萜类和三萜类)。二甲基亚砜(<0.05%)溶解,最后用培养基配成实验所需要浓度工作液。使用的试剂包括:RPMI 1640细胞培养基(HyClone,USA);胰蛋白酶(HyClone,USA);胎牛血清(Gibco);核蛋白提取试剂盒(上海生工化工技术,货号:C500009);二甲基亚砜(DMSO);CCK-8(日本同仁,货号:CK04);BCA定量试剂盒(新赛美生物科技,货号:WB6501);抗体包括Chk1(CST,货号:2360);p-Chk1-Ser345(CST,货号:2348);γH2AX-Ser139(Sigma-Aldrich,货号:05-636);poly-PAR(Trevigen,货号:4335-MC-100);PARP1(CST,货号:9542),GAPDH(Abcam,货号:ab8245);Anti-Lamin A+Lamin C(Abcam,货号:EPR4519)。
1.3 实验仪器二氧化碳恒温培养箱(Thermo Scientific公司,型号:3423);酶标仪(PerkinElmer公司,型号:Enspire);发光成像仪(Bio-Rad公司,型号:ChemiDox XRS);稳压DNA电泳仪(Bio-Rad 公司,型号:PowerPacTMBasic);倒置荧光显微镜(Olympus公司,型号:BX61)。
1.4 CCK-8实验取对数生长期人胃癌AGS、MNK-45细胞以5.0×103个/孔的密度接种在96孔板中。待细胞稳定后,给予不同浓度的TTC(20、40、80、160和320 mg·L-1)分别培养24、48和72 h。另设置阴性对照组(加入细胞和RPMI 1640培养液)和空白对照组(不加细胞,不加药物,加入RPMI 1640培养液)。在各自培养时间段每孔加入10 μL的CCK-8溶液,使用酶标仪在490 nm处读取反应溶液的吸光度值。
细胞抑制率/%=[(对照组吸光度-实验组吸光度)/(对照组吸光度-空白孔吸光度)]×100%。
1.5 克隆形成率实验取对数生长期人胃癌AGS和MKN-45细胞以5.0×102个/孔接种于六孔板。接种后的d 4,用不同浓度的南蛇藤多萜(0、5、10 mg·L-1)的含药培养基。每3 d换1次含药培养基,药物连续作用10 d后,用预冷的PBS溶液清洗细胞2遍,用含甲醇和冰乙酸(7 ∶1)的溶液固定细胞,然后用结晶紫(200 mg·L-1)染色。用肉眼观察和手工计数克隆数(显微镜中大于10个细胞的克隆数)。
根据克隆形成率/%=克隆数目/接种细胞数×100%进行计算。
1.6 彗星实验彗星电泳(comet assay)又称为单细胞凝胶电泳,是一种在单细胞水平上检测有核 DNA 断裂的技术。使用彗星检测试剂盒(Abcam,货号:ab238544),将75 μL已溶解的彗星琼脂糖加到彗星载玻片中创建一个基底层。收集细胞在预冷的PBS(不含Mg2+和Ca2+)中调整细胞密度为每毫升约1.0×105个细胞。将细胞悬浮液与彗星琼脂糖以1 ∶10的比例混合后取75 μL加到基底层中,在4 ℃冰箱中中静置30 min使成凝胶,再将载玻片浸泡在预冷裂解缓冲液(2.5 mol·L-1NaCl、100 mmol·L-1Na2EDTA、10 mmol·L-1Tris、10% DMSO和1% Triton X-100, pH 10)中避光放置4 ℃冰箱中45 min。待细胞裂解后将载玻片置于预冷碱性溶液(0.3 mol·L-1NaOH, 1.0 mmol·L-1EDTA)中,4 ℃避光浸泡30 min。将载玻片浸泡在碱性电泳缓冲液(300 mmol·L-1NaOH和1.0 mmol·L-1Na2EDTA, pH=13)中进行DNA电泳(电泳条件25 V,30 min,另调节碱性电泳溶液的体积,使电流恒定在300 mA)。电泳结束后用75%乙醇脱水处理2遍,最后用1×Vista Green DNA染色液染色。然后用荧光显微镜观察载玻片。DNA损伤是通过测量细胞核的遗传物质(“彗星头”)和产生的“尾巴”之间的位移来量化的。尾矩和拖尾DNA%是分析彗星试验结果最常用的两个参数。
通过CASPlab软件定量荧光强度。
根据拖尾DNA/%=拖尾DNA强度/细胞DNA强度×100%进行计算。
1.7 Western blot实验取对数生长期人胃癌AGS细胞和MKN-45细胞以1.0×104个/孔的密度均匀种植于六孔板中,放置于37 ℃,5% CO2的细胞培养箱中培养。加入不同浓度的南蛇藤多萜(0、25、50、100 mg·L-1)作用24 h后,细胞用预冷的PBS洗涤两次,用含有蛋白酶抑制剂和磷酸酶抑制剂的RIPA裂解缓冲液冰上裂解细胞20 min,以转速为12 000 r·min-1离心10 min后提取细胞总蛋白。细胞核蛋白采用碧云天核蛋白提取试剂盒提取,BCA试剂盒测定总蛋白浓度,然后在100 ℃条件蛋白变性5 min,用10%的SDS-PAGE分解相同数量的细胞裂解液(25 μg蛋白上样量),并转移到PVDF膜上。质量分数为5%脱脂牛奶室温封闭2 h,加入相应抗体4 ℃孵育过夜,TBST溶液漂洗3次后加入相应的二抗(稀释1 ∶5 000),室温孵育2 h后TBST漂洗3次,于凝胶成像系统下成像。
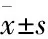
2 结果
2.1 南蛇藤多萜对AGS与MKN-45细胞的毒性影响CCK-8实验检测不同浓度的南蛇藤多萜(20、40、80、160、320 mg·L-1)对AGS和MKN-45细胞的生长抑制情况。结果显示,南蛇藤多萜在24 h、48 h、72 h对AGS细胞的IC50分别是421.1、99.68、58.57 mg·L-1;对MKN-45细胞的IC50分别是308.2、124.1、68.21 mg·L-1,见Fig 1和Tab 1。表明南蛇藤多萜能够有效地抑制胃癌细胞的增殖。

Fig 1 Growth inhibition rates of TTC in AGS andMKN-45 cells at different

GC cell lineIC50(TTC, mg·L-1)24 h48 h72 hAGS>32099.6858.57MKN-45308.2124.168.21
2.2 南蛇藤多萜能够抑制AGS和MKN-45细胞的克隆形成采用克隆形成率实验进一步研究在低浓度下长期给予TTC对胃癌细胞生长的影响。连续分别给予0、5、10 mg·L-1的南蛇藤多萜10 d(每3 d换1次含药培养基)。然后给予冷甲醇固定30 min,弃去固定液加入质量分数为0.5%结晶紫(溶于25%甲醇)染色液,染色30 min,清水轻柔洗涤后拍照。结果如Fig 2所示,随着给药浓度逐渐增加,AGS和MKN-45细胞的克隆形成明显减少。统计结果如Fig 2所示,5、10 mg·L-1的南蛇藤多萜对AGS细胞的克隆形成抑制率分别为29.67%和61.46%,对MKN-45细胞的克隆形成抑制率分别为42.73%和64.39%。

Fig 2 Cloning and inhibition of AGS cells bydifferent concentrations of
2.3 南蛇藤多萜加重胃癌细胞的DNA损伤采用彗星实验检测TTC对胃癌细胞核中DNA损伤情况。如Fig 3所示,空白对照组中胃癌细胞AGS和MKN-45的DNA结构完整,细胞核大小均一,经荧光染色后呈现圆形状的荧光团且强度均匀,无明显的拖尾现象。随着南蛇藤多萜浓度的增加,胃癌细胞核DNA断裂的碎片或碱变性片段增多,彗星尾长相应增加,尾部荧光强度也相应增强,呈现一定的剂量效应关系。同时,为了确定南蛇藤多萜的安全性,选取了人正常胃粘膜上皮细胞作为对照。统计结果如Fig 3,25 mg·L-1、50 mg·L-1和100 mg·L-1给药组与空白对照组相比,DNA均有不同程度的损伤且各检测指标值均显著增加(P<0.05),而对于人正常胃粘膜细胞GES-1的DNA几乎无损伤,差异无统计学意义。
2.4 Western blot检测AGS和MKN45细胞中DNA损伤蛋白、细胞周期检查点蛋白以及细胞凋亡等相关蛋白表达影响给予不同浓度的南蛇藤多萜(0、25、50、100 mg·L-1)处理24 h后提取细胞核蛋白,Western blot检测不同浓度的南蛇藤多萜对胃癌细胞DNA损伤相关蛋白表达的影响。结果显示,随着南蛇藤多萜浓度的增加,DNA单双链断裂标志蛋白Poly-PAR、γH2AX表达均增加,见Fig 4。随后,检测了细胞周期检查点蛋白Chk1的蛋白表达情况,结果显示,随着TTC浓度的增加Chk1没有变化,但是其磷酸化蛋白水平被抑制,见Fig 5-6。说明Chk1蛋白的活性被抑制。最后,检测了细胞凋亡相关蛋白cleaved-PARP1表达情况,结果显示,cleaved-PARP1的蛋白表达水平增加。表明南蛇藤多萜抑制了细胞损伤检查点Chk1的激活而导致DNA损伤的累积,最终导致细胞凋亡。
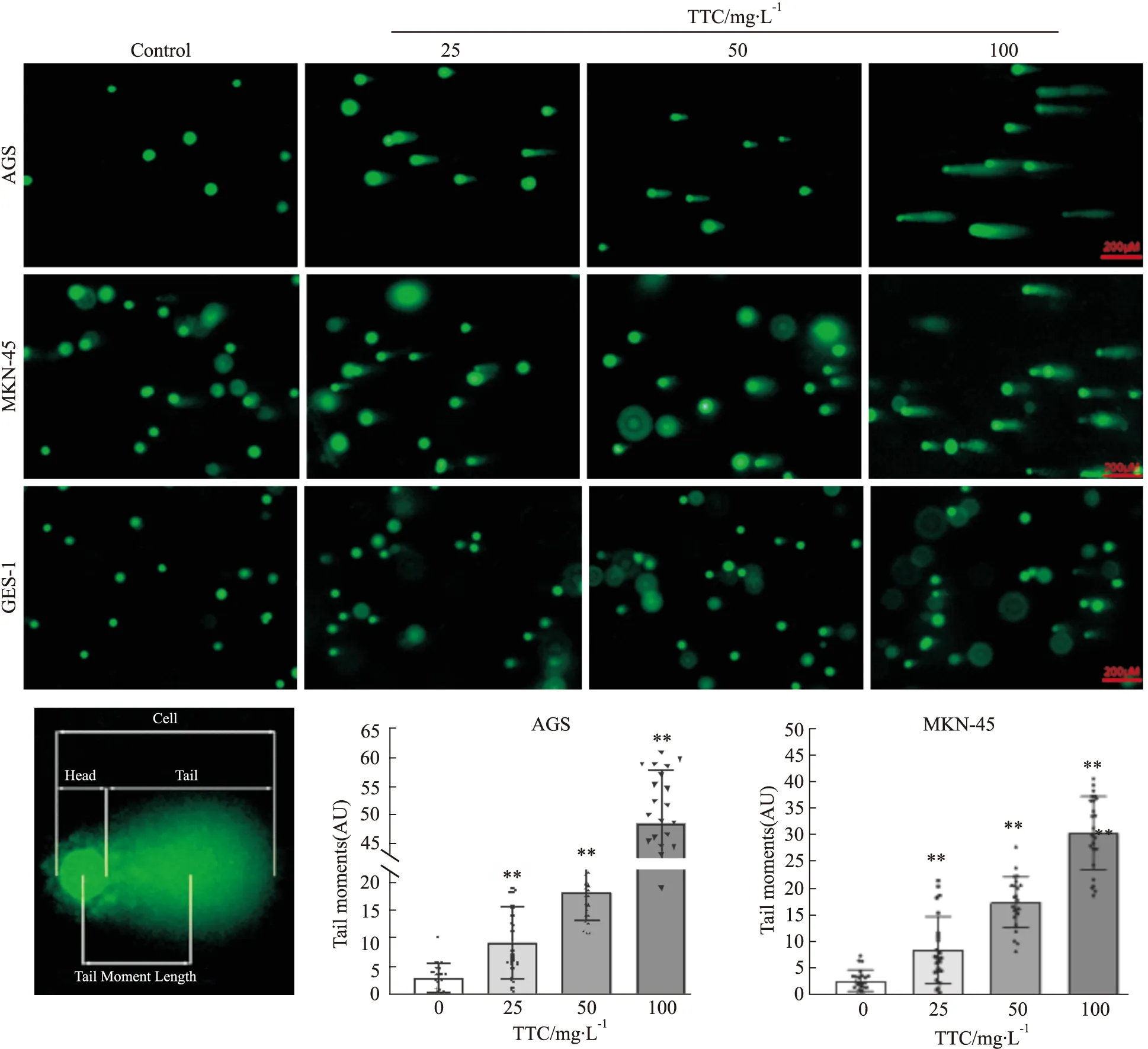
Fig 3 Cometary imaging of DNA damage induced by TTC in AGS cells at different concentrations(

Fig 4 Effects of TTC at different concentrations on expression of nuclear proteinPoly-PARs and γ-H2AX in AGS and MKN-45 cells(n=3)
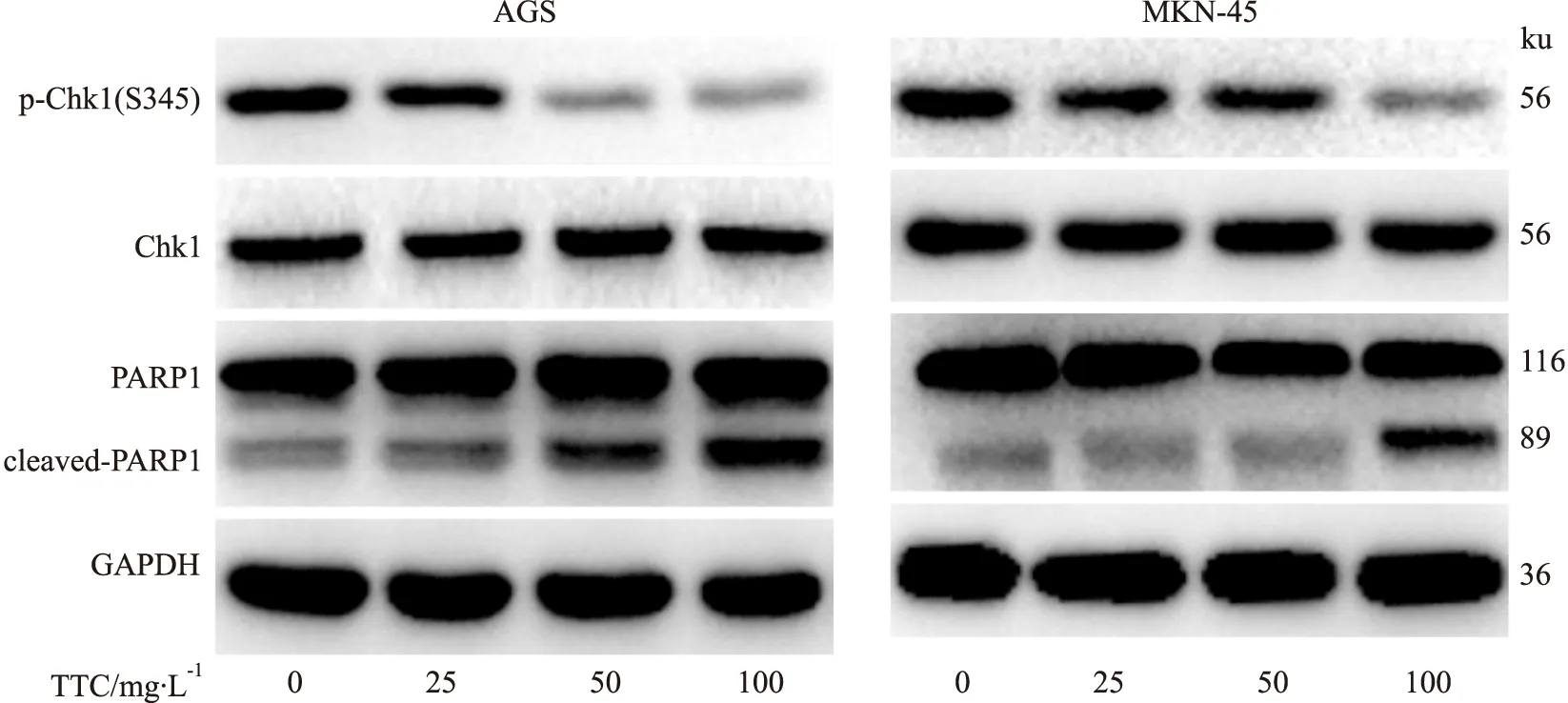
Fig 5 Effects of TTC at different concentrations on expression of Chk1 and PARP1 in AGS and MKN-45 cells(n=3)
Fig 6 Effect of TTC on expression level of Chk1phosphorylated protein under different action time
3 讨论
据流行病学统计,胃癌依旧是我国最致命的恶性肿瘤之一,每年导致30多万人死亡[11-12]。目前,胃癌的治疗方案主要包括手术治疗和化疗,但一些接受手术治疗的患者可能存在肿瘤复发,同时长期使用化疗药可能会导致耐药的发生,故并未显著提高胃癌患者整体生存率,因此,迫切需要寻找能够阻断多种致癌途径的药物靶点,从而为晚期胃癌治疗提供更多可能性[13-14]。基因组DNA作为真核生物最重要的遗传物质,其分子结构的完整和稳定性对细胞的存活及行使正常生理功能具有决定性作用[15]。有研究表明,南蛇藤提取物之一南蛇藤素可诱导癌细胞的DNA损伤,并增加癌细胞对基因毒性化学物质的敏感性[16]。DNA损伤的积累可能是由于DNA的复制压力增加或修复能力下降所引起。ATR-Chk1信号对持续性DNA损伤通过细胞凋亡和有丝分裂突变诱导细胞死亡至关重要。信号传导通路中的上游基因ATR能够感受DNA损伤信号,在每个断裂部位产生大量的p-Chk1[17],本研究结果揭示了南蛇藤多萜具有一种新的活性,即抑制Chk1的激酶活性,而抑制ATR-Chk1信号通路则造成癌细胞子代DNA损伤积累,同时总的Chk1并未发生变化。该研究还发现南蛇藤多萜抑制Chk1磷酸化激活呈现剂量依赖性和时间依耐性。细胞周期检查点的抑制则导致DNA单双链断裂标志蛋白Poly-PAR、γH2AX表达均增加,最终复制性的损伤灾难则导致胃癌细胞诱发凋亡,即PARP羧基端的催化结构域(89 ku)和氨基端的sbDNA结合结构域(24 ku)相分离,从而使PARP失去其酶活力成为Cleaved PARP,最终诱导癌细胞走上凋亡。综上,南蛇藤多萜可能通过抑制Chk1而加速胃癌细胞AGS和MKN-45的DNA的灾难性损伤最终诱导胃癌细胞增殖抑制和凋亡。此结论对南蛇藤多萜抗胃癌临床治疗效益和安全性具有一定的临床前意义,使得具有潜在基因毒性的中药南蛇藤提取物有望作为一种Chk1抑制剂的天然开发产物。
