氟磺胺草醚降解菌株FCX2 的分离及生长特性研究
2021-03-11刘景辉孙倩王帅孙冬梅
刘景辉,孙倩,王帅,孙冬梅
(黑龙江八一农垦大学生命科学技术学院,大庆 163319)
氟磺胺草醚主要用于花生、大豆的芽前芽后使用,高效、低毒、选择性强[1],大豆田常用的25%氟磺胺草醚水剂是一种茎叶处理的除草剂,其较长的半衰期使氟磺胺草醚在连作的土壤中不断积累,甚至影响到后茬作物的正常生长,产生药害[2-4]。此外,该类除草剂长期的使用会造成严重的土壤残留,对土壤与环境造成危害,由于其分布于土壤和自然水体[5-6],不利于用化学方法解除其危害,而微生物降解可能成为一种比较好的解决方案,化学方法不利于解除氟磺胺草醚的药害,微生物降解成为一种比较好的解决方案[7-8]。梁波等[9]从长期受氟磺胺草醚污染的土壤中分离到Lysiniacillus sp.ZB-1 菌株,高效液相法证实其对氟磺胺草醚7 d 降解率为81.32%。吴秋彩等[10]从氟磺胺草醚污染土壤中分离出一株Klebsiella.sp降解菌F-12 菌株,2 d 降解率达80%以上。杨峰山等[11]从土壤中得到一株Pseudomonas mendocina FB8 菌株,对氟磺胺草醚的5 d 降解率为86.75%。李阳等[12]也分离出一株能降解氟磺胺草醚的黑曲霉菌。说明利用微生物降解氟磺胺草醚是完全可行的,而且降解效率是非常高。然而,不同菌株存在多种生理特性,所以氟磺胺草醚生物降解的产物是多样的[13-14],如果想达到无害化处理,还需进一步进行生物测定,对氟磺胺草醚敏感的作物及杂草均可作为降解能力检测的植物,高世杰等[15]利用玉米、向日葵、高粱作为指示植物,对氟磺胺草醚的生测方法进行了研究,白杰[16]也对在氟磺胺草醚危害的土壤的玉米生理指标进行了研究,证明了氟磺胺草醚生物测定的可行性,利用生物检测法不仅可以检测出氟磺胺草醚降解菌的降解力,还可以对其降解产物的部分特性及菌体对指标生物的影响一并表现出来,结合高效液相法色谱分析,可准确测出微生物的氟磺胺草醚的降解率,以便有针对性地对氟磺胺草醚污染的土壤和水体进行环境修复。试验以玉米为研究检测植株,确定其生物测定方法,并对分离到的氟磺胺草醚降解菌进行生物方法验证及液相检测复合验证,以期为农业生产提供有益微生物资源。
1 材料与方法
1.1 材料
1.1.1 供试作物种籽、农药
玉米品种:必祥101(北京化农伟业种子科技有限公司),25%氟磺胺草醚水剂(青岛瀚生生物科技股份有限公司)。
1.1.2 培养基
基础无机盐液体培养基 (g·L-1):NaCl 1.0,K2HPO41.5,KH2PO40.5,(NH4)2SO41.0,MgSO40.2,CoCl2·6H2O 0.1,MnCl2·4H2O 0.425,ZnCl20.05,NiCl2·6H2O 0.01,CuSO4·5H2O 0.015,Na2MoO4·2H2O 0.01,Na2SeO4·2H2O 0.01,pH 7.0~7.5[11]。
PDA 培养基,牛肉膏蛋白胨培养基。
1.1.3 供试土样
分别采自长期使用氟磺胺草醚的黑龙江省牡丹江市军马场大豆田(土样1)和黑龙江垦区856 农场的大豆田(土样2),耕层5~20 cm 深的土壤,快速放入无菌牛皮纸袋[11],阴凉保管。
1.2 实验方法
1.2.1 氟磺胺草醚10 d 龄玉米苗生物检测方法的建立
将砂子过5 mm 筛,烘干,分别配成浓度为A-0、B-0.05、C-0.10、D-0.15、E-0.20、F-0.25、G-0.30 mg·kg-1分装于发芽盒中,每一浓度梯度3 次重复,选取催芽后发芽势整齐一致的玉米种子芽朝上栽种于装有药土浓度梯度的发芽盒内,每盒8 株,并给予一致的光照和适宜的水份管理,10 d 后,取地上部分称重,以药土浓度为自变量,10 d 龄玉米苗鲜重为因变量建立线性关系[9-10]。
1.2.2 降解菌的驯化培养与分离
取五支250 mL 锥形瓶,分别装入适量液体无机盐培养基,第一支加入玻璃珠与氟磺胺草醚水剂,配制成100 mg·L-1的氟磺胺草醚溶液,其余四支锥形瓶不加玻璃珠,以100 mg·L-1氟磺胺草醚浓度递增梯度配成液体无机盐培养基,高压蒸汽灭菌,取土样以10%土样量接种量放入灭菌的装有玻璃珠的无机盐液体培养中,置 30 ℃,150 r·min-1,7 d,以 10%的接种量转接到200 mg·L-1氟磺胺草醚浓度液体无机盐培养基,继续培养7 d,按浓度递增的顺序依次转接,最后采用倾注分离,利用牛肉膏蛋白胨培养基分离细菌,利用PDA 培养基分离真菌[11-12]。
1.2.3 降解菌降解能力的生物检测与高效液相检测
将25%氟磺胺草醚水剂用液体无机盐培养基稀释成含量为500 mg·L-1的稀溶液,分装,灭菌,分别接入驯化分离出的氟磺胺草醚降解菌株,接种量为10%,以不接菌为对照,置 30 ℃,150 r·min-1摇床振荡培养,5 d 后将对照与降解液处理均拌入砂土中,使对照沙土氟磺胺草醚的浓度为0.30 mg·kg-1,依此稀释倍数将接菌的降解液与砂土充分混匀,配成药土。将玉米种子催芽,选发芽势一致的种子芽朝上栽种于装有 0.30 mg·kg-1的药土基质上,3 次重复,给予一致的光照和适宜的水分条件,10 d 后生测地上部分鲜重。
取500 mg·L-1的氟磺胺草醚溶液各150 mL 分装于6 支250 mL 锥形瓶中,封口膜封口,灭菌,其中3 支接入对数期FCX2 菌体,接种量10%,另3 支设为对照,置 30 ℃,150 r·min-1,摇床振荡培养 5 d 后利用高效液相色谱法检测。
高效液相色谱法检测条件:仪器型号SPD-20A,柱温(℃)室温,柱型号C18,梯度方式高压梯度,检测器紫外,波长(nm)245,积分方法面积归一法,谱图文件浙大智达N2000[19-20]。
1.2.4 FCX2 菌株对玉米种子萌发的影响
将 FCX2 菌株发酵液与清水按 0∶1,1∶50,1∶40,1∶30,1∶20,1∶10,1∶0 配制成 7 个处理的溶液[22],分别以培养基和与发酵液pH 相同的NaOH 溶液作为空白对照[23],共 21 个处理,3 次重复,每次重复精选 100 粒玉米种子,用各处理液同时浸种8 h,然后,将浸种后的玉米种子整齐摆入装有双层湿润滤纸的发芽盒中[15-16],封盖保温保湿,28 ℃,48 h 后计算玉米种子萌发率,3 次重复[15-16]。
1.2.5 FCX2 菌株生长特性初探
不同温度下的生长情况:按10%的接种量接入对数期FCX2 菌株培养液于牛肉膏蛋白胨液体培养基内,分别放入 20、25、30、35 ℃和 40 ℃,150 r·min-1条件下培养,利用紫外分光光度计每隔4 h 测定OD值,波长 600 nm,3 次重复[7-8]。
不同pH 下的FCX2 生长情况:用硫酸或氢氧化钠将牛肉膏蛋白胨液体培养基pH 分别调成5、6、7、8 和9,分别按10%接种量接入对数期FCX2 菌株培养液,150 r·min-1条件下培养,并每隔4 h 测定OD值,3 次重复[9]。
不同N 源下的FCX2 的生长情况:基础无机盐液体培养基中分别加等量的牛肉膏、酵母膏和蛋白胨,pH 值 8,30 ℃,150 r·min-1条件下培养,并每隔 4 h测定 OD 值[17-21],3 次重复。
不同C 源下的FCX2 的生长情况:基础无机盐液体培养基中分别加等量的蔗糖、牛肉膏、可溶性淀粉和葡萄糖,pH 值 8,30 ℃,150 r·min-1条件下培养,并每隔 4 h 测定 OD 值,3 次重复[11,13]。
2 结果与分析
2.1 氟磺胺草醚残留量的玉米生苗期测方法
受药土浓度的影响,10 d 苗龄玉米苗药害显著,随着药土浓度的增加,玉米枯斑显著增加,玉米苗低矮、瘦弱、萎蔫和黄化(图1),地上部鲜重显著下降,甚至在0.30 mg·kg-1的药土浓度上,玉米苗已经接近枯死,这也说明了玉米苗对土壤中氟磺胺草醚是敏感的,可以在一定程度上用来指示土壤中氟磺胺草醚的残留量。

图1 不同氟磺胺草醚浓度条件下玉米苗生长情况Fig.1 Growth of maize seedlings under different concentration of fomesafen
对不同浓度氟磺胺草醚的玉米苗鲜重进行测定发现:随着药土浓度增加,10 d 龄玉米鲜重下降显著,且不同浓度氟磺胺草醚的玉米苗鲜重变化相对规律明显,一定程度上可适用于对氟磺胺草醚的残留检测,故以药土浓度为自变量,10 d 玉米苗地上部分鲜重为因变量,用SPSS 软件进行线性回归分析,得到一元线性回归方程:Y=-7.096 x+3.281,R2=0.882,P=0.002≤0.01,自变量变异水平达到显著,表明该方法能够很好的预测氟磺胺草醚残留量对玉米10 d 苗龄地上部分的影响,从而可以用来指示土壤中氟磺胺草醚的残留量(图2)。

图2 不同氟磺胺草醚浓度条件下玉米苗地上部位鲜重Fig.2 Fresh weight of aboveground part of maize seedling under different concentration of fomesafen
2.2 降解菌株的获得
倾注法从土样1 中分离得到一株呈黄色、湿润、小而突起、与培养基结合不紧密菌落的菌株FCX2,进一步划线分离成纯菌落(图3)。
图3 氟磺胺草醚降解菌的划线分离Fig.3 Isolation of fomesafen-degrading bacteria on plate medium
2.3 降解菌株降解能力的生物测定与高效液相检测
由于菌株对氟磺胺草醚是降解利用还是耐受并不能确定,通过对比氟磺胺草醚浓度为0.30 mg·kg-1的药土浓度上生长的玉米苗试验发现,与对照相比,利用FCX2 菌株降解过的氟磺胺草醚药液处理的长势要好很多,枯斑数量明显下降,说明FCX2 菌株有利于改善玉米苗的药害状况(图4)。经玉米苗鲜重均值比较试验,利用FCX2 菌株降解的药液种植的玉米苗鲜重(均值1.687 6 g)比对照(1.509 1 g)增加11.36%,达显著水平,在一定程度上改善了玉米苗的药害状况。

图4 10 d 龄玉米苗地上部分生长情况Fig.4 Growth of aboveground part of 10-day-old maize seedling
色谱图上显示出氟磺胺草醚主峰时间轴上的峰值变化明显(图5),表明发酵液组分上了有明显变化,依据面积归一法,检测结果显示,与对照相比FCX2 降解5 d 后,氟磺胺草醚浓度降低了44.86%,说明了FCX2 菌株有较强的降解能力,虽然并不确定降解产物的种类和特性,但结合生物检测结果,证实了其在改善氟磺胺草醚残留方面的应用价值。

图5 FCX2 菌株处理5 d 后的氟磺胺草醚色谱图Fig.5 HPLC analysis of fomesafen after 5 days of FCX2 treatment
2.4 FCX2 菌株对玉米种子萌发的影响
从玉米种子萌发试验的结果可以看出(图6),玉米种子发芽率在发酵液与水配成的 1∶50、1∶40 和1∶30 处理上,比培养基对照分别高出2.84%、5.78%和3.95%,均达到显著水平,比pH 水溶液分别高出3.66%、5.02%和3.33%,均达到显著水平,说明FCX2菌株发酵液在 1∶50、1∶40 和 1∶30 处理上有明显的促生能力。而随着各处理混合液中FCX2 菌株发酵液含量的增加,则玉米种子发芽率开始缓慢下降,当达到1∶0 的处理后,玉米种子发芽率已降至最低,仅为41.67%,比培养基对照降低了50.20%,达极显著水平,而对比于pH 水溶液对照则差异不显著,说明pH在发芽率降低规律中起了主导作用。
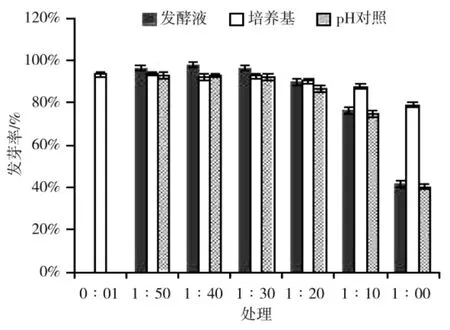
图6 不同处理对玉米种子萌发率的影响Fig.6 Effect of different treatments on corn seed germination rate
2.5 FCX2 的生长特性初探
不同初始的pH 条件下,FCX2 菌株生长趋势相同,即菌液均在8 h 后达到最大OD 值,但不同条件下的最大OD 值并不相同,其中该菌最适的pH 为8。图7 的结果同样说明FCX2 菌株在供试pH6-9 范围内该菌均可达到最大产量,而在pH5 的初始状态下,FCX2菌株培养液OD 几乎不变,菌体生长接近停止,说明菌体无论是在产量还是在生长速率上均较低,可能是因为初始的酸性环境对菌体生长产生了抑制作用。

图7 不同pH 值条件下FCX2 菌株的生长情况Fig.7 Growth of FCX2 strain under different pH conditions
不同温度下的培养表明:30 ℃的条件下,FCX2菌株无论在菌体生长速率还是在菌体最大产量上均较高,表明FCX2 菌株的最适温度为30 ℃;而在20 ℃和25 ℃条件下,FCX2 菌株菌体生长速率均很慢,且达到平稳期的时间较晚,说明温度越低FCX2生长速度越慢;当培养温度为35 ℃和40 ℃时,虽然菌液很快达到稳定期,但明显可以看出,达到稳定期时菌液的浓度是很低的,当培养温度达40 ℃时菌液浓度较其它温度都要低,也说明高温对此菌有一定的抑制作用(图8)。
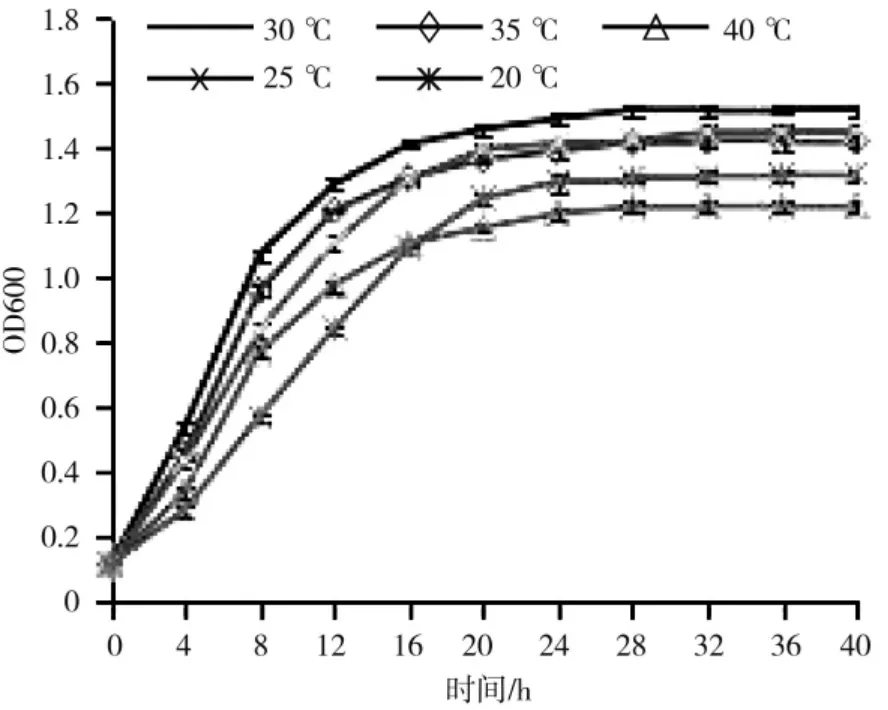
图8 不同温度条件下FCX2 菌株的生长情况Fig.8 growth of FCX2 strain at different temperatures
不同N 源的培养结果表明:牛肉膏、酵母膏和蛋白胨均可作为FCX2 菌株的氮源,且蛋白胨为氮源时FCX2 菌株的生长速率最快,且到稳定期时OD 可达到1.463 7;酵母膏为氮源时,菌液达稳定期时OD 值为1.456 1,但差别并不显著;牛肉膏为氮源时,菌液达稳定期时OD 值为1.384 2,且较上述两者差异显著,而从该生长曲线同样可看出,该菌的生长速率也较慢(图 9)。
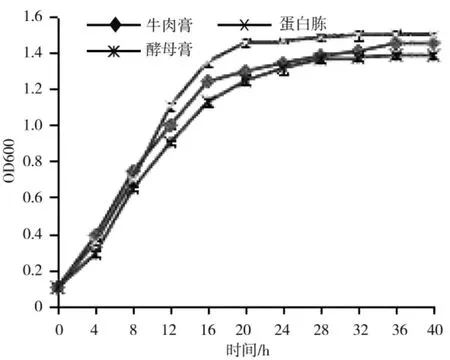
图9 不同氮源条件下FCX2 菌株的生长情况Fig.9 Growth of FCX2 strain under different nitrogen sources
碳源培养试验结果表明:以葡萄糖为碳源时,FCX2 菌株生长速率较快,而牛肉膏为碳源时,虽然生长速率略低于葡萄糖,但FCX2 菌株在稳定期OD值却可以达到最大的1.493 1,但以淀粉为碳源时,无论生长速率还是稳定期OD 值均要比前三者三种碳源低,综合考虑认为葡萄糖为最适碳源,淀粉最不适于作为FCX2 的碳源(图10)。
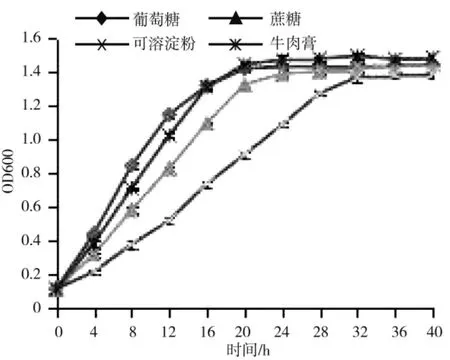
图10 不同碳源条件下FCX2 菌株的生长情况Fig.10 Growth of FCX2 strain under different carbon sources
3 讨论
玉米作为氟磺胺草醚敏感作物,可用来检测氟磺胺草醚的降解能力,试验表明:10 d 苗齡玉米苗的长势随氟磺胺草醚残留量的增加而下降,当残留量达到0.30 mg·kg-1时,玉米苗基本枯死,与高世杰等[15]、白杰等[16]在氟磺胺草醚的对玉米毒害作用研究相比,虽然方法有所不同,但具有相同的变化规律,可作为氟磺胺草醚降解能力的生物检测手段,在检测氟磺胺草醚的降解能力的同时,也检测出FCX2 菌株及其代谢物是对玉米生长特性的综合影响,通过生物检测试验,加有FCX2 菌株的处理上玉米苗的鲜重比未加菌的高出了11.36%,证明FCX2 菌株及其代谢物对玉米苗的药害有显著的改善作用,使玉米苗长势得到显著恢复,这与以往仅仅通过高效液相色谱分析检测而获得氟磺胺草醚降解菌,单一追求降解率不同[8-14],利用生物检测法筛选氟磺胺草醚降解菌,充分考虑了其菌株在生长代谢过程中可能产生的大量未知的代谢成分和菌体本身对检测生物的整体效应,使所获降解菌株更具应用前景。尽管生物检测法有着诸多优点,但生物检测手段的干扰因素较多,比如FCX2 菌株本身或其代谢成分对玉米苗生长的影响,并不能准确的反映出FCX2 降解率,需要利用高效液相色谱检测,测得5 d 降解率达44.86%,与大多数的已获得的氟磺胺草醚降解菌相比[8-14],这样的结果并不是很高,但其发酵液对玉米苗药害的改善明显,可用作为氟磺胺草醚降解菌。通过FCX2 菌株发酵液对玉米种子萌发试验,发现其促生能力显著,亦可作为玉米促生菌来使用,但其发酵液pH 为9.7,会导致玉米发芽率显著下降,应用时要注意控制使用比例或调节pH,这一点与胡凯凤等[23]的研究规律也基本保持了一致性。研究FCX2 菌株生长特性发现,其最适生长温度为30 ℃,但无论在20 ℃,还是40 ℃都能很好的生长,表明对温度的适应能力较强;其最适pH 为8,在pH5 的环境几乎停止生长,但在pH6~pH9 的环境是可以正常生长的,这说明FCX2 菌株适于一些中性或偏碱的土壤;生长营养特性的试验表明,最适碳源为葡萄糖,这与葡萄糖为单糖便于利用也相符[17],而最适氮源为蛋白胨,是比较适合作为FCX2 菌株氮的来源,为了更有效的发挥其降解功能,还需进一步的研究FCX2 菌株应用的条件优化、预防菌体产碱作用对作物的影响,以便最大程度发挥其能力。
