小鼠髓过氧化物酶(MPO)基因克隆分析及真核表达载体的构建
2021-03-10王媛媛赵彩英李怡娜张全伟马友记赵兴绪
甘 泽,王 琪,王媛媛,赵彩英,李怡娜,张全伟,马友记,张 勇,赵兴绪*
(1.甘肃农业大学 动物医学学院,甘肃 兰州 730070;2.甘肃农业大学 生命科学与技术学院,甘肃 兰州 730070;3.甘肃农业大学 动物科学技术学院,甘肃 兰州 730070)
髓过氧化物酶(myeloperoxidase,MPO)是一种血红素辅基蛋白酶,属于血红素过氧化物酶超家族成员,受生长因子的调控,存在于多种细胞中,参与多种疾病的发生和发展过程。MPO是中性粒细胞产生的具有吞噬功能的溶酶体酶,通过将过氧化氢和氯离子变为次氯酸来参与对外来物质的破坏,可作为中性粒细胞的特异性标记物[1]。正常生理情况下,MPO是先天性免疫系统的一部分,通过介导微生物的杀伤作用来促进宿主防御[2];在特定条件下,MPO催化产生过多的活性氧触发氧化应激和氧化性组织损伤[3],导致多种疾病的发生和发展[4]。活性氧的产生取决于专门的酶,例如还原型辅酶Ⅱ(NADPH)、MPO和一氧化氮合酶(NOS)等[5]。一氧化氮(NO)可作用于炎症反应,并在免疫调节反应中起关键作用,主要由3种NOS亚型产生:神经元(nNOS)、内皮(eNOS)和诱导型(iNOS)[6]。研究发现,MPO表达水平与其启动子区域的等位基因多态性有关,在-463位置处(G-463A)的G被A取代后导致MPO转录水平显著降低[7],在-129位置处(G-129A)也发现G被A取代后MPO转录降低的现象[3]。最新研究表明,MPO缺乏症有较高的发生率[8],尽管MPO缺乏症对降低心肌梗塞及其他心血管损伤有保护作用[9],但MPO缺失后发生严重感染和慢性炎症的几率明显增高[9]。但关于MPO介导的神经炎症和神经元死亡的生化基础与机理研究仍然是一个未知领域。总之,MPO是一种既与机体免疫防御有关,又与组织氧化损伤有关的复杂的多功能酶,它与临床疾病的关系已得到越来越多的验证,随着对其分子生物学研究的深入,MPO将会有更为广阔的应用前景。
本研究通过克隆小鼠MPO基因CDS区序列,进行生物信息学分析,为研究MPO生化性质、生物特性和蛋白质结构,及有关信号传导机制提供理论依据;通过构建MPO真核表达载体并转染NSC-34细胞,探究细胞内相关基因蛋白的表达变化,为研究MPO在疾病监测和治疗中的生物学作用及其水平升高与炎症和氧化应激之间的联系奠定基础。
1 材料与方法
1.1 实验仪器与材料1640细胞培养基(GE公司,美国);T4-DNA连接酶、限制性核酸内切酶XhoⅠ和SacⅡ(NEB公司,美国);TransZol Up和DH5α感受态细胞(北京全式金生物技术有限公司);高效裂解液RIPA(北京索莱宝公司);MPO兔多克隆抗体(武汉三鹰生物技术有限公司);兔源GAPDH多克隆抗体、HRP标记的羊抗兔二抗(北京博奥森生物技术有限公司);Alexa Fluor 633(AF633)标记的羊抗兔红色荧光二抗(Thermo Fisher公司,美国);真核表达载体pEGFP-C1(Kanamycin,4 731 bp)购于Clontech公司;小鼠神经元细胞系NSC-34购于上海通派生物科技有限公司。Q6000B微量核酸蛋白测定仪(Quawell公司,美国);IX71型相差显微镜(Olympus公司,日本);5417R型高速冷冻离心机(Eppendorf公司,德国);Mini-PROTEAN Tetra Cell 型垂直电泳槽、电转印槽、梯度PCR仪、凝胶成像系统(Bio-Rad公司,美国);U2800紫外分光光度计(Hitachi公司,日本);LightCycler 96 实时荧光定量PCR仪(Roche,瑞士);LSM800激光共聚焦扫描显微镜(CARL ZEISS,德国)等。
1.2 小鼠神经元细胞RNA提取及cDNA合成小鼠神经元细胞于37 ℃、5%CO2条件下使用完全培养基(含10%胎牛血清的1640培养基)培养,待细胞汇合度达90%后,用PBS清洗培养基收集细胞,根据TransZol Up说明书提取细胞RNA,微量核酸测定仪检测浓度及纯度;根据全式金反转录说明书将RNA反转录为cDNA,保存于-20℃冰箱。
1.3 设计引物根据NCBI已公布的小鼠MPO(NM_010824.2)、NADPH(AF276957.1)、nNOS(NM_008712.3)和GAPDH(GU214026.1)基因序列,利用Primer Premier 5.0软件设计引物,送由西安擎科生物科技有限公司合成,引物的相关信息见表1。

表1 引物序列及扩增片段长度
1.4 MPO基因克隆及生物信息学分析将MPO基因反转录的cDNA为模板进行PCR扩增,产物经1%琼脂糖凝胶电泳,得到MPO基因的目的条带,胶回收后连接pUC-57-Kan载体,再转化 DH5α感受态,在含有卡那霉素抗性(Kan)的固体培养基中培养,挑取单个菌落于液体培养基中扩大培养,并进行菌液 PCR、双酶切和测序鉴定。
通过NCBI网站BLAST工具(http://blast.ncbi.nlm.nih.gov/Blast.cgi) 进行同源序列搜索,用MEGA 7.0软件构建系统进化树[10];采用ProtParam在线工具(http://web.expasy.org/protparam/)预测MPO蛋白的基本理化性质[11];通过DTU Health Tech网站Prediction servers (http://www.cbs.dtu.dk/services/)在线工具预测MPO蛋白信号肽、跨膜结构域、磷酸化和糖基化位点;运用SOPMA软件(https://npsa-prabi.ibcp.fr/cgi-bin/secpred_sopma.pl)预测MPO蛋白的二级结构;采用折叠识别建模法通过phyre2在线软件(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgii?id=index)预测MPO蛋白的三级结构[12];在网页PSORTⅡ(https://psort.hgc.jp/form2.html) 上进行亚细胞定位预测;运用STRING (https://string-db.org/)构建MPO蛋白的互作网络[13]。
1.5 pEGFP-C1-MPO表达载体的构建及鉴定将测序正确的pUC-57-Kan-MPO表达载体和pEGFP-C1载体用XhoⅠ和SacⅡ双酶切,对目的条带进行胶回收;用T4连接酶将纯化的MPO基因与pEGFP-C1载体连接,转化DH5α感受态细胞,接种于含Kan抗性(100 mg/L)的LB琼脂平板上,挑选单一阳性克隆的菌斑进行摇菌、过夜培养、提取质粒,并分别进行菌液 PCR、双酶切及测序鉴定。
1.6 pEGFP-C1-MPO转染NSC-34细胞正常培养小鼠神经元细胞NSC-34,当35 mm培养皿中细胞汇合度达到70%~80%时,利用Lipofectamine 2000参考文献及说明书[14],将pEGFP-C1和pEGFP-C1-MPO两种载体进行稀释,室温静置15~20 min 后,均匀滴入培养皿,于37 ℃、5% CO2正常培养,6 h后换2 mL含10%胎牛血清的1640培养液继续培养,转染48 h后收集各组培养的细胞进行后续试验。
1.7 qRT-PCR及Western blot分析提取上述各组细胞总RNA,反转录合成cDNA。选用GAPDH为内参基因,检测MPO及NADPH、nNOS 基因mRNA的表达水平。结果采用2-△△Ct法进行数据统计分析。
取细胞总蛋白30 μg,通过12% SDS-PAGE分离胶分离,100 V恒压转PVDF膜,脱脂牛奶封闭1.5~2.0 h;选用GAPDH作为内参,一抗4 ℃过夜孵育,二抗37 ℃孵育2 h,ECL发光法显色曝光,运用Image J软件进行灰度扫描分析。
1.8 细胞免疫荧光染色将细胞接种于盖玻片,待转染成功后,置于4%多聚甲醛室温固定30 min,弃去固定液,用0.5% Triton X-100室温孵育10 min,3% H2O2室温孵育10 min,山羊血清4 ℃封闭15 min,弃去封闭液,滴加一抗(MPO),4 ℃湿盒孵育过夜;避光滴加AF633红色荧光标记的二抗,室温避光孵育1 h,PBS洗3次,避光滴加二脒基苯基吲哚(DAPI)染核,室温静置3~5 min,滴加少量的抗荧光淬灭封片剂封片。
在激光共聚焦显微镜下观察:载体表达的EGFP蛋白显绿色,DAPI标记的细胞核显蓝色,AF633标记的阳性表达部位显红色。

2 结果
2.1 MPO基因克隆将pUC-57-Kan载体与MPO基因扩增产物双酶切后进行连接,转化至DH5α感受态细胞后涂板,挑选单一菌落扩大培养。经菌液PCR检测,得到单一条带大小约为2 171 bp(图1A);对pUC57-T-MPO克隆载体进行XhoⅠ和SacⅡ双酶切及测序鉴定,双酶切结果显示目的片段大小和与预期的大小一致(图1B);阳性克隆测序结果与NCBI中序列进行比对,结果相似度达100%;结果表明成功克隆小鼠MPO基因CDS区序列。
2.2 表达载体pEGFP-C1-MPO的鉴定将pUC57-T-MPO克隆载体和pEGFP-C1载体双酶切,回收目的片段连接空载体,转化DH5α感受态细胞后涂板,挑选单一菌落进行扩大培养,菌液PCR电泳检测结果显示,扩增产物条带大小为2 171 bp(图1C);将pEGFP-C1-MPO表达载体进行XhoⅠ和SacⅡ双酶切后获得2条大小分别约为4 700 bp和2 171bp的条带(图1D);结果表明,pEGFP-C1-MPO表达载体构建成功。
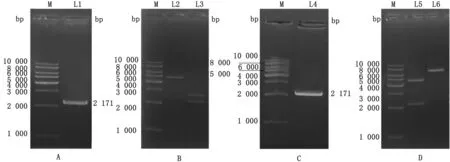
M.DNA相对分子质量标准;L1.pUC-57-Kan-MPO菌液PCR产物;L2.pUC-57-Kan-MPO;L3.pUC-57-Kan-MPO双酶切产物;L4.pEGFP-C1-MPO菌液PCR产物;L5.EGFP-C1-MPO双酶切产物;L6.pEGFP-C1-MPO
2.3 MPO基因生物信息学分析系统发育树结果显示:小鼠MPO基因与章鱼、美洲灰熊、马的亲缘关系最为接近,与人、非洲爪蟾、扬子鳄的亲缘关系较远(图2)。小鼠MPO蛋白氨基酸预测结果表明:小鼠MPO蛋白由718个共19种氨基酸组成,其中亮氨酸(Leu)最多(85,11.80%),组氨酸(His)最少(8,1.11%);理化性质预测结果表明:小鼠MPO蛋白由11 436个原子组成,相对分子质量为81 181.66,718个氨基酸中带负电荷氨基酸残基共60个,正电荷氨基酸残基共88个,理论等电点为9.63,其不稳定系数为43.53,脂肪系数为85.31,亲水性为-0.311,预测该蛋白为不稳定的亲水蛋白;信号肽和跨膜结构域预测表明:MPO蛋白无跨膜结构、无信号肽;磷酸化和糖基化位点预测显示:MPO共有52个磷酸化位点,其中有25个丝氨酸磷酸化位点、6个苏氨酸磷酸化位点和21个酪氨酸磷酸化位点;蛋白质二级结构的预测结果显示: 43.61%的α螺旋、5.69%的β折叠、4.72%的β转角和45.79%的无规卷曲共同构成了MPO蛋白的二级结构;三级结构预测结果显示:该蛋白有18个α-螺旋,4个β折叠及大部分的无规卷曲构成,这与二级结构预测结果基本一致(图3A)。亚细胞定位预测结果表明:MPO蛋白在细胞核 (12.9%)、线粒体 (21.7%)、细胞骨架 (13.0%)和细胞质 (52.2%) 中均发挥一定的生物学作用;string结果表明MPO与NADPH、nNOS、TNF、CAT等蛋白存在一定的互作关系(图3B)。
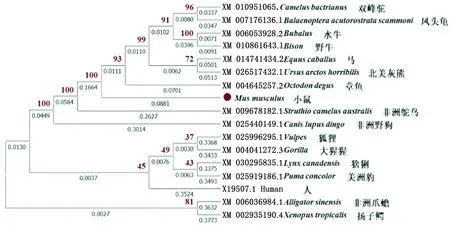
图2 不同物种基于MPO的系统进化树

图3 MPO蛋白三级结构(A)及MPO蛋白互作关系(B)预测结果
2.4 pEGFP-C1-MPO表达载体瞬时转染NSC-34细胞pEGFP-C1空载体及pEGFP-C1-MPO表达载体瞬时转染小鼠NSC-34细胞48 h,用倒置荧光显微镜观察绿色荧光蛋白的表达情况,结果细胞中绿色荧光清晰可见,表明pEGFP-C1空载体与pEGFP-C1-MPO表达载体成功转入细胞内(图4)。
2.5 qRT-PCR及Western blot检测转染效率利用qRT-PCR对MPO目的基因和GAPDH内参基因进行扩增后,检测MPO 基因mRNA的表达情况。结果显示:试验组MPO基因mRNA的表达水平显著升高,且与阴性对照组和空白对照组相比差异极显著(P<0.01),而空白对照组与阴性对照组相比MPO基因mRNA的表达水平无显著性差异(P>0.05)(图5)。
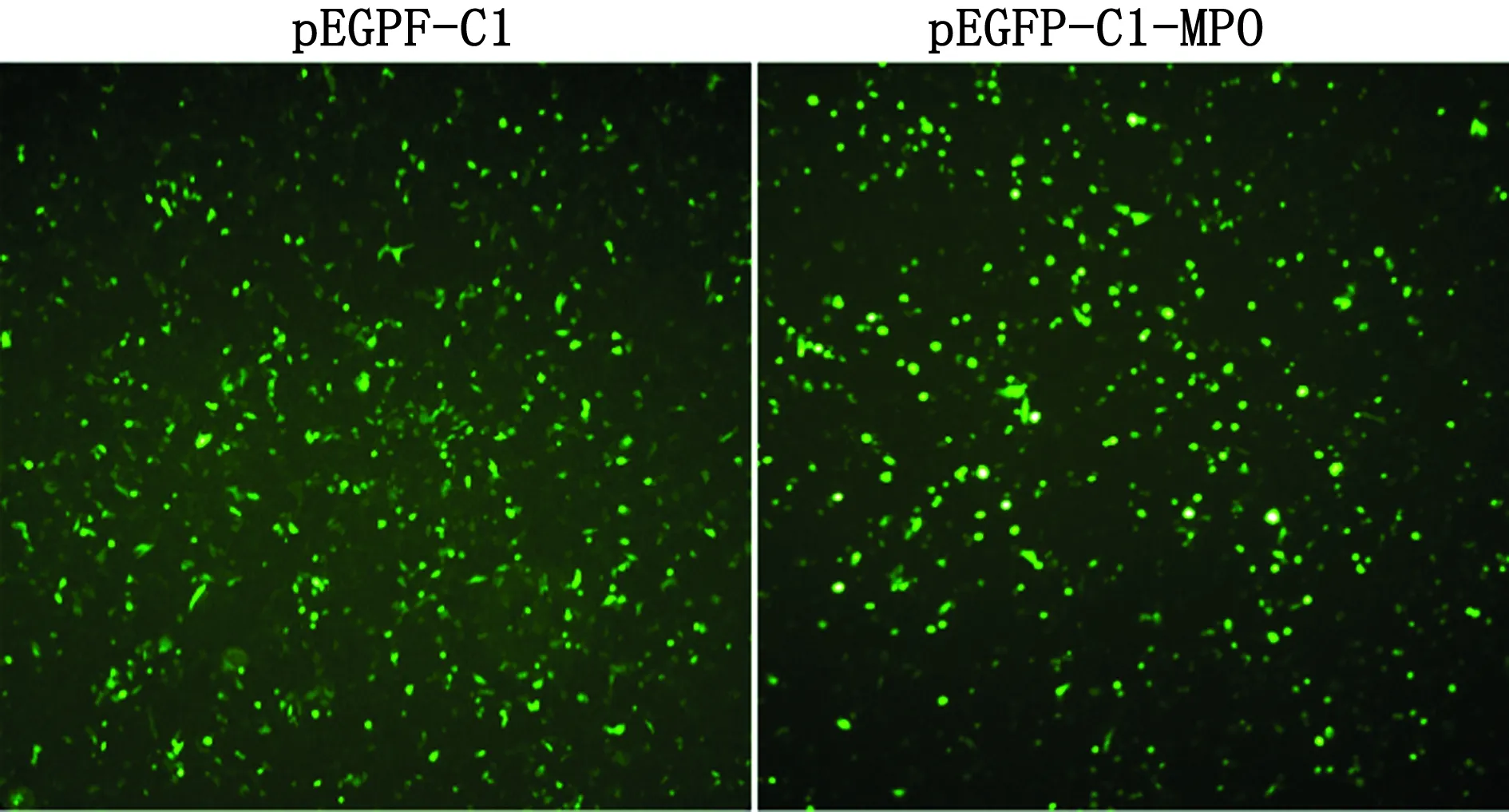
图4 转染NSC-34细胞48 h荧光照片(100×)
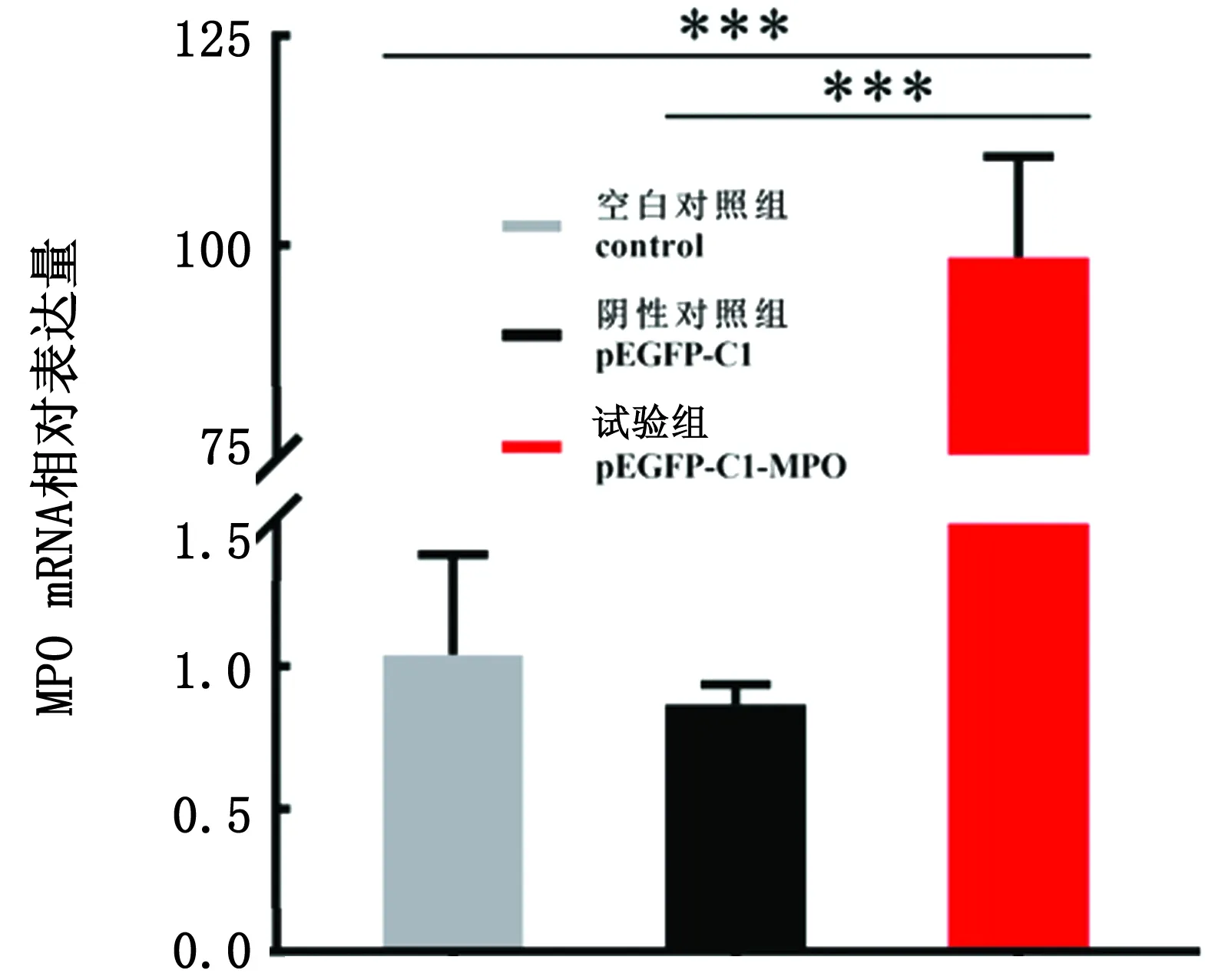
*.P<0.05;***.P<0.01。下同
Western blot检验蛋白表达水平,用GAPDH对小鼠不同组别MPO的表达丰度进行校正,结果显示:试验组MPO蛋白的表达丰度明显上调,极显著高于阴性对照组(P<0.01)(图6),与qRT-PCR的结果一致。
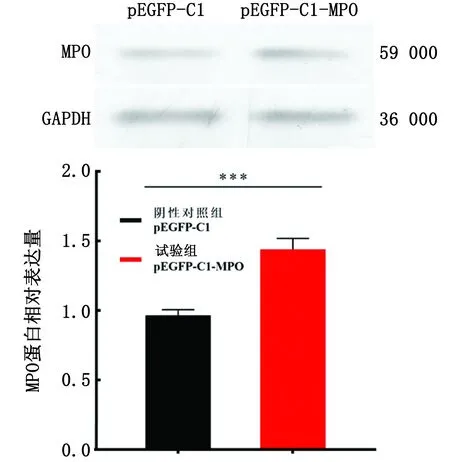
图6 Western blot检测MPO蛋白表达水平
2.6 过表达MPO基因后相关基因表达水平的检测以反转录的cDNA为模板,选择GAPDH为内参基因,以阴性对照组为参照,经qRT-PCR检测NADPH和nNOS 基因的表达情况。结果表明:试验组nNOS mRNA表达水平显著高于阴性对照组(P<0.05),NADPH mRNA表达水平显著低于阴性对照组(P<0.05),表明nNOS 随MPO表达上调而显著升高,NADPH随MPO表达上调而显著降低(图7)。
2.7 细胞免疫荧光染色将瞬时转染pEGFP-C1-MPO和pEGFP-C1载体的NSC-34细胞,通过细胞免疫荧光对小鼠MPO蛋白进行细胞定位检测。结果表明:转染pEGFP-C1载体后,MPO蛋白主要分布于细胞质中,而过表达MPO后,除了在细胞质中存在高表达外,在细胞核中也发现MPO蛋白阳性表达(图8)。

图7 qRT-PCR检测NADPH和nNOS mRNA表达水平
3 讨论
MPO是一种过氧化物酶,也是一种重要的含铁溶酶体,存在于髓系细胞的嗜苯胺蓝颗粒中,是髓细胞的特异性标志。随着对MPO基因研究的深入,人们发现MPO基因的增加或缺失会导致个体对一些疾病易感性的差异,它与人类多种疾病的发生、发展密切相关,因此越来越受到国内外学者的重视。JI等[15]的研究证实MPO基因多态性与患阿尔茨海默氏病(AD)风险的遗传关联;NDREPEPA 等[16]强调MPO水平与心血管疾病的患病率和严重程度相关。本研究通过对小鼠MPO基因的克隆及生物信息学分析,结果发现:小鼠MPO与章鱼、美洲灰熊和马的亲缘关系最为接近,与人、非洲爪蟾和扬子鳄的亲缘关系较远,但氨基酸的同源性都在79.25%以上。胡宝庆等[17]研究表明,在不同物种间MPO存在较高的同源性。综上说明,MPO基因的核苷酸突变反映在蛋白质水平多属同义突变,表明在不同物种间MPO基因有较高的保守性,在生物遗传过程中该基因对于维护机体正常生理功能具有重要的意义[18]。HANSON等[19]与 CARPENA等[20]提出MPO存在4个糖基化位点Asn 323、Asn 355、Asn 391和Asn 483,晶体学数据表明只有3个(Asn 355、Asn 391和Asn 483);VAN ANTWERPEN等[21]认为除Asn 323、Asn 355、Asn 391和Asn 483这4个之外还有一个Asn 729糖基化位点。本试验预测出MPO置信度大于0.7的糖基化位点有4个,与 VAN ANTWERPEN等[21]的结果一致。重链的糖基化对于MPO的酶促活性很重要,去糖基化的MPO氯化活性显着降低。蛋白质结构预测结果显示MPO中主要由无规卷曲构成(45.79%),其次是α螺旋(43.61%),而β折叠和β转角仅占10%左右,α螺旋和β折叠相对较稳定,但含量较少,无规卷曲占比较高使蛋白质分子空间结构相对不稳定[22],这与通过理化参数计算所得的结果一致[11]。亚细胞定位预测结果表明MPO蛋白主要在细胞质 (52.2%)中发挥生物学作用。免疫荧光结果表明,正常情况下MPO主要分布于细胞质中,但当MPO携带一个含有CMV强启动子的表达载体时,MPO 出现了入核现象,这种现象提示其可能与核膜上的核孔复合体有关并与转运受体激活相关[23]。蛋白互作发现MPO与NADPH、nNOS、iNOS、TNF和CAT等蛋白存在相互作用关系。大量研究证实[13]MPO与NADPH[24]和nNOS[25]等蛋白存在互作关系,其中MPO、NADPH和nNOS均在Phagosome(ko04145)这一信号通路上。
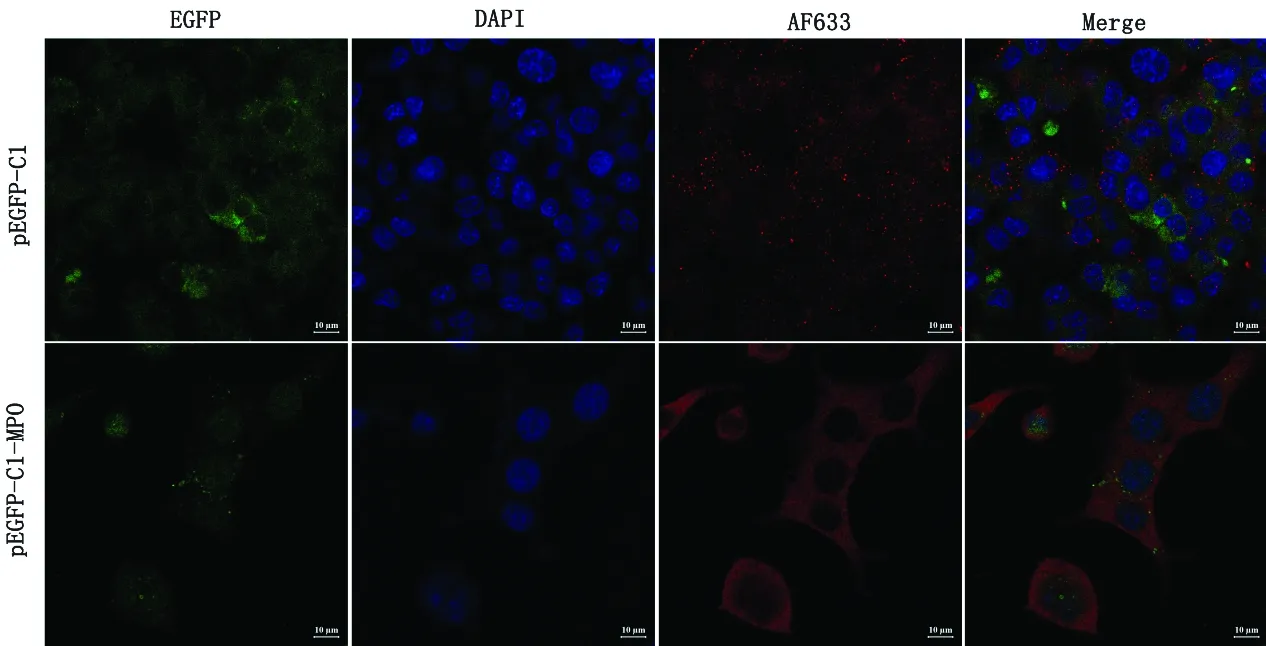
图8 免疫荧光检测MPO在细胞中的分布
为了进一步研究MPO生物学功能,本研究选用pEGFP-C1真核强启动子表达载体,瞬时转染NSC-34细胞。结果表明,试验组绿色荧光表达量低于阴性对照组,推测可能与转染载体的大小有关(pEGFP-C1-MPO, 6 860 bp;pEGFP-C1, 4 689 bp),这种现象与戚顺民等[26]成功构建H-FABP基因的真核表达载体并转染PK15细胞的现象一致。转染结果表明,试验组MPO mRNA和蛋白表达量极显著高于阴性对照组,从mRNA转录和蛋白表达水平均证明过表达载体pEGFP-C1-MPO构建成功而且有效。MPO蛋白在细胞质中表达便于结合和转运低密度脂蛋白(low density lipoprotein,LDL)和载脂蛋白A-1[1]等,进而影响各种代谢酶、受体、细胞内信号传导和基因表达等。研究显示,MPO主要作为氧化应激和系统炎症标志物,是预测急性冠状动脉综合征(ACS)的新型标志物,对ACS患者的诊断及预测均有较高的价值。MPO其水平增高可以反映中性粒细胞在某一组织中的增高,间接反映炎症在组织中的存在,MPO活性越高,说明组织炎症程度越重[3]。炎性状态下MPO能将亚硝酸盐氧化成NO2,从而削弱NO2-依赖性血管紧张素的松弛作用并降低鸟苷酸环化酶的活性,在此过程中,一氧化氮(NO)是MPO的一种重要的生理底物,过表达MPO模拟炎症环境发现这一过程消耗大量的NO,从而诱导合成NO的NOS表达量升高[27]。本研究所用的细胞为小鼠神经元细胞,该细胞中诱导合成NO的NOS为nNOS[6],即nNOS的表达量升高。有研究报道,NO的合成速度降低或消耗速度加快会导致NO的反应性降低,对NADPH的消耗减少[28]。本试验中过表达MPO后NO消耗速度增加,从而使NADPH氧化酶的表达量降低。
本研究成功从NSC-34细胞中克隆小鼠MPO基因的CDS区序列,初步预测小鼠MPO蛋白由718个氨基酸组成,其二级结构含43.61%的α螺旋、5.69%的β折叠、4.72%的β转角和45.79%的无规卷曲,为不稳定的亲水性蛋白。pEGFP-C1-MPO表达载体成功转染NSC-34细胞,结果证实MPO主要表达在细胞质中,MPO 基因体外过表达可促进nNOS表达,抑制NADPH的表达。本研究为MPO基因功能及信号通路的研究提供理论依据。
