口蹄疫病毒3B蛋白的表达纯化及其多克隆抗体的制备
2021-03-10辛旭吴香菊齐静王永志李相安杜正国单虎杜以军
辛旭,吴香菊,齐静,王永志,李相安,杜正国,单虎,杜以军*
(1. 青岛农业大学动物医学院,山东 青岛 266000;2. 山东省畜禽疫病防治与繁育重点实验室,山东 济南 250100;3. 山东省农业科学院畜牧兽医研究所,山东 济南 250100;4. 济南护理职业学院,山东 济南 250100;5. 青岛农业大学海都学院,山东 莱阳 265200;6. 沂水县畜牧局姚店子畜牧兽医工作站,山东 沂水 276400)
口蹄疫(foot-and-mouth disease,FMD)是一类在偶蹄目动物之间传播的严重疾病,传播速度快,危害严重,被世界各国广泛重视[1]。口蹄疫病毒(foot-and-mouth disease virus,FMDV)共有O、A、C、Asia1、SAT1、SAT2、SAT3等7个血清型,不同型病毒的血清之间无交叉保护[2]。目前全球各国对该病的防控方法主要是注射疫苗, 在暴发口蹄疫时,欧盟规定,可进行疫苗的紧急接种[3]。
口蹄疫病毒主要有8个非结构蛋白(L、2A、2B、2C、3A、3B、3C、3D),其中一些非结构蛋白具有免疫原性,3B蛋白便是其中之一[4]。3B蛋白也称Vpg蛋白,共有3种不同的3B蛋白(3B1、3B2、3B3),分别由口蹄疫病毒基因组中的P3编码区里3个相连的基因编码,此现象在RNA病毒中比较少见[5]。目前对于3B蛋白的功能研究已经取得了较大的进展,由于3B蛋白有pUpU结构,故可与新合成的子代RNA相连,在病毒RNA复制合成时可以起引物的作用[6-7]。
本研究通过原核表达系统表达口蹄疫病毒的3B蛋白并进行纯化,再多次免疫试验动物,制备针对3B蛋白的多克隆抗体并进行鉴定,为3B蛋白的相关研究提供了重要的材料。
1 材料与方法
1.1 试验动物
体重约2 kg的新西兰大白兔购自山东大学实验动物中心。
1.2 主要试剂
载体pET28a、pXJ-3B质粒、HEK-293T细胞及HeLa细胞由本实验室保存。大肠杆菌DH5α感受态细胞、大肠杆菌BL21感受态细胞购自上海唯地生物技术有限公司;Millipore超滤浓缩管购自密理博(中国)有限公司;dNTP、PrimeSTAR®HS DNA Polymerase、DL5000 DNA Marker购自TaKaRa生物公司;Lipofectamine®2000 Reagent、Alexa Fluor 594标记的羊抗兔IgG购自Invitrogen公司;Co-IP及Western blot细胞裂解液、PMSF购自碧云天公司;XhoⅠ、BamHⅠ等限制性核酸内切酶以及T4 DNA连接酶均购自Thermo公司;Supersignal®West Pico Trial Kit化学发光试剂盒购自Pierce公司;羊抗兔IgG抗体购自Abcam(中国)有限公司;β-actin抗体购自Santa Cruz公司;凝胶回收试剂盒、质粒小提试剂盒购自北京天根生物有限公司。
1.3 PCR引物的设计与合成
由O型口蹄疫病毒在GenBank中公布的3B基因序列以及pET28a载体的多克隆位点区酶切位点,利用分子生物学软件Primer Premier 5.0设计了1对用于扩增3B基因的特异性引物:F-pET28a-3B-BamHⅠ和R-pET28a-3B-XhoⅠ。序列如下所示:
F-pET28a-3B-BamHⅠ:5′-CGCGGATCCATGGGACCCTACACCGGT-3′;
R-pET28a-3B-XhoⅠ:5′-CCGCTCGAGCTATTACTCAGTGACAATCAA-3′。
2条引物F-pET28a-3B-BamHⅠ和R-pET28a-3B-XhoⅠ横跨3B蛋白的整个蛋白编码区,其中上游引物5′端引入酶切位点BamHⅠ,下游引物5′端引入酶切位点XhoⅠ,预计扩增片段长度为231 bp。
1.4 3B基因的PCR扩增及胶回收纯化
以pXJ-3B质粒为PCR模板,用F-pET28a-3B-BamHⅠ和R-pET28a-3B-XhoⅠ为引物扩增3B基因,PCR反应条件如下:95 ℃预变性30 s;95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min,共30个循环;72 ℃终末延伸10 min。将PCR产物进行1.2%琼脂糖凝胶电泳,将目的条带用胶回收试剂盒进行胶回收。
1.5 重组质粒的构建与鉴定
将回收纯化的3B基因及pET28a载体分别用BamHⅠ/XhoⅠ进行双酶切,双酶切产物进行1.2%琼脂糖凝胶电泳并胶回收纯化,回收产物在T4 DNA连接酶的作用下,16 ℃过夜连接。将连接产物转化到DH5α感受态细胞中,具体步骤按DH5α感受态细胞的操作说明书进行。挑取LB固体培养基上的形成的单菌落,将其接种于含卡那霉素抗性的LB培养基中,在37 ℃条件下培养过夜。第2天提取菌液中的质粒,具体步骤按质粒小提试剂盒的操作说明书进行。用BamHⅠ、XhoⅠ2种酶进行双酶切鉴定,将最终检测结果为阳性的质粒送生物公司测序。测序结果正确的重组质粒命名为pET28a-3B。
1.6 3B蛋白的表达与纯化
将pET28a-3B重组质粒转化BL21感受态细胞,置37 ℃摇床过夜培养,第2天挑取单菌落接种到含卡那霉素抗性的LB培养基中。置摇床中过夜培养。将菌液转接入含卡那霉素抗性的LB培养基中继续培养,OD600=0.6~0.8时,向菌液中加入IPTG至终浓度为1 mmol/L,16 ℃过夜诱导。第2天将菌液4℃离心,弃上清用,PBS溶液重悬后再离心,弃上清,用重悬液重悬后置超生波仪进行超声破碎,离心后上清和沉淀分别取适量样品,剩余上清经过Ni-NTA纯化,取样。用Millipore超滤管进一步纯化浓缩,取样进行SDS-PAGE分析,用BCA法检测蛋白浓度。
1.7 3B重组蛋白的动物免疫
将重组蛋白与等量的弗氏完全佐剂混合进行乳化,取试验动物新西兰大白兔,将混合的液体注射于其背部皮下。2周后进行第1次加强免疫,再经过两周后进行第2次加强免疫。第2次加强免疫后的第10天在耳缘静脉处注射约1 mg的蛋白液,3 d后对试验动物进行心脏采血,将血清分离出来。用重组蛋白G琼脂糖凝胶FF进行纯化,得到抗3B蛋白的多克隆抗体。
1.8 抗体效价的测定
用间接ELISA试验来检测制备的多克隆抗体效价:以重组蛋白包被ELISA板,置于4 ℃环境中包被过夜。一抗为3B蛋白多克隆抗体(2倍倍比稀释),阴性对照为未进行免疫的新西兰大白兔的血清,二抗为1∶8 000稀释的羊抗兔IgG,测OD值并分析结果。
1.9 3B蛋白多克隆抗体反应性检测
用Western blot试验检测其反应性:将蛋白上样缓冲液分别与100 ng和50 ng纯化浓缩后的3B蛋白混合,进行SDS-PAGE;将蛋白条带转印至NC膜上;用含5%脱脂奶粉的TBST溶液作为封闭液,封闭1 h;孵育一抗,用制备的3B蛋白多克隆抗体和兔阴性血清分别作为一抗(1∶500),4 ℃条件下过夜孵育,用TBST溶液洗涤;孵育二抗,用羊抗兔IgG作为二抗(1∶8 000),室温下孵育1 h,用TBST溶液洗涤;在化学曝光仪上进行曝光并纪录结果。
1.10 3B蛋白多克隆抗体应用于3B蛋白细胞定位的检测
用间接免疫荧光试验(IFA)检测多克隆抗体是否能检测到过表达后3B蛋白的亚细胞定位:将细胞爬片放置于24孔板中,将HeLa细胞均匀铺入其中,在培养箱中培养,待密度达70%~80%时,部分细胞转染本实验室保存的pXJ-3B质粒,其他细胞转染空载体pXJ41作为阴性对照。24 h后,加入PBS溶液洗涤,用4%多聚甲醛固定,用PBS溶液洗涤;加入0.2% TritonX-100通透;加入制备的3B蛋白多克隆抗体(1∶100)至载玻片,在37 ℃环境下孵育45 min,用PBS溶液洗涤;加入的羊抗兔IgG(1∶600)二抗,在37 ℃环境下孵育45 min,用PBS溶液洗涤;将含有60%甘油、0.1%叠氮钠的PBS溶液滴入的长载玻片上,将载玻片置于上面,用指甲油封边,置荧光显微镜下观察。
1.11 3B蛋白多克隆抗体应用于细胞表达的3B蛋白的检测
用Western blot试验检测3B多克隆抗体是否能检测到过表达的3B蛋白:将HEK-293T细胞铺入6孔板中,置于培养箱中培养,当密度达70%~80%时,部分细胞转染本实验室保存的pXJ-3B质粒,其他细胞转染空载体pXJ41作为阴性对照,24 h后收集样品;孵育一抗,用制备的多克隆抗体作为一抗,4 ℃环境下孵育过夜,用TBST溶液洗涤;孵育二抗,用羊抗兔IgG作为二抗,室温下孵育1 h,用TBST溶液洗涤;在化学曝光仪上对NC膜进行曝光,并记录结果。
2 结果与分析
2.1 FMDV 3B基因PCR扩增结果
以pXJ-3B质粒为PCR模板,使用特异性引物F-pET28a-3B-BamHⅠ和R-pET28a-3B-XhoⅠ进行PCR扩增,电泳结果如图1所示,在231 bp处出现了特异性条带,符合目的基因大小。
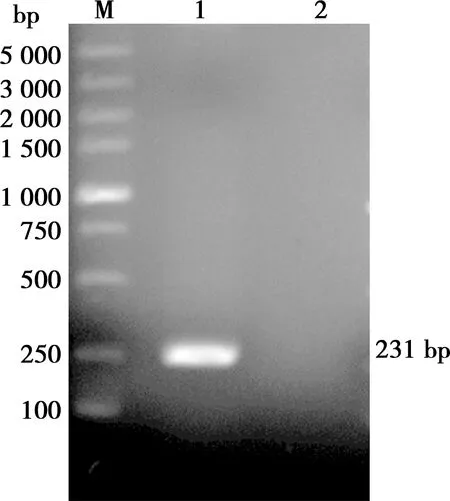
M. DL5000;1. 3B基因;2. 阴性对照
2.2 重组质粒pET28a-3B的鉴定
用BamHⅠ及XhoⅠ2种酶对重组质粒pET28a-3B进行双酶切鉴定。如图2所示, 获得了大小约5 369 bp(pET28a)和231 bp(3B基因)的2条特异性条带,表明3B基因已成功连接到pET28a原核表达载体中。将该重组质粒送生物公司测序,测序结果显示连接至pET28a原核表达载体中的序列与口蹄疫病毒参考毒株(GenBank 登录号:AJ539138.1)的核苷酸序列一致。以上结果表明,重组质粒pET28a-3B构建成功。
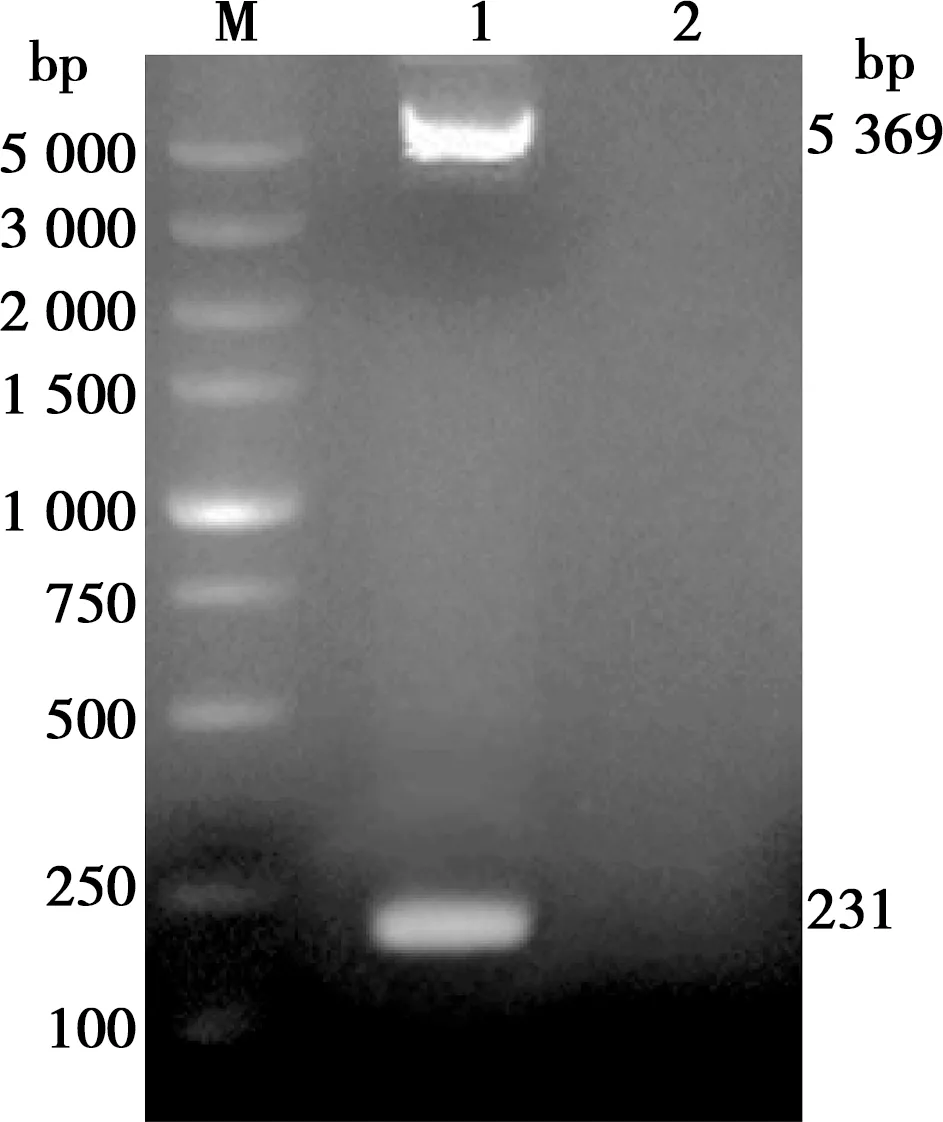
M. DL5000;1. BamHⅠ/XhoⅠ酶切结果
2.3 3B重组蛋白的诱导表达及纯化
将重组质粒pET28a-3B转化到BL21感受态细胞中诱导表达,收集诱导后的菌液、超声破碎后的上清、沉淀及Ni-NTA琼脂糖亲和层析纯化后得到的样品进行SDS-PAGE并用考马斯亮蓝试剂染色。诱导表达后的菌液在未超声破碎前各种蛋白较少,超声破碎后的上清及沉淀蛋白明显增多,但杂蛋白较多(图3A);经过Ni-NTA琼脂糖亲和层析纯化得到的蛋白中除了3B蛋白之外的杂蛋白较少(图3B),3B蛋白理论的预期大小约10 kDa,但纯度有待提高。
2.4 3B重组蛋白的超滤浓缩
将蛋白样品进行了Millipore超滤管浓缩纯化,如图4所示,纯化后的蛋白可用于下一步的试验。
2.5 重组蛋白浓度测定结果
BCA法测蛋白浓度结果约为1.84 mg/mL(表1),可用于下一步试验。
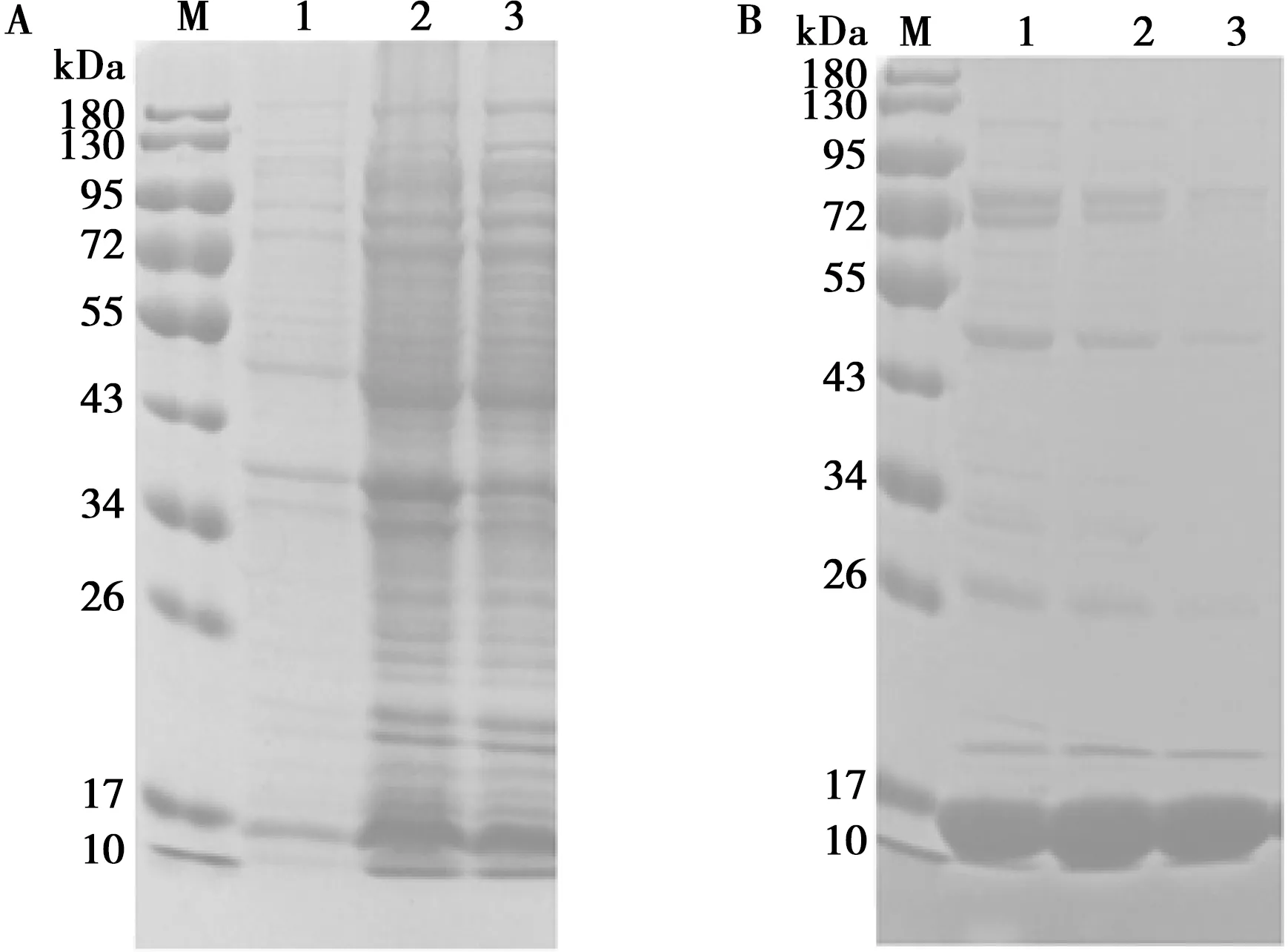
A. 重组蛋白的诱导表达鉴定分析:M.蛋白分子量标准;1. 诱导后的菌液;2. 超声破碎后的上清;3. 超声破碎后的沉淀
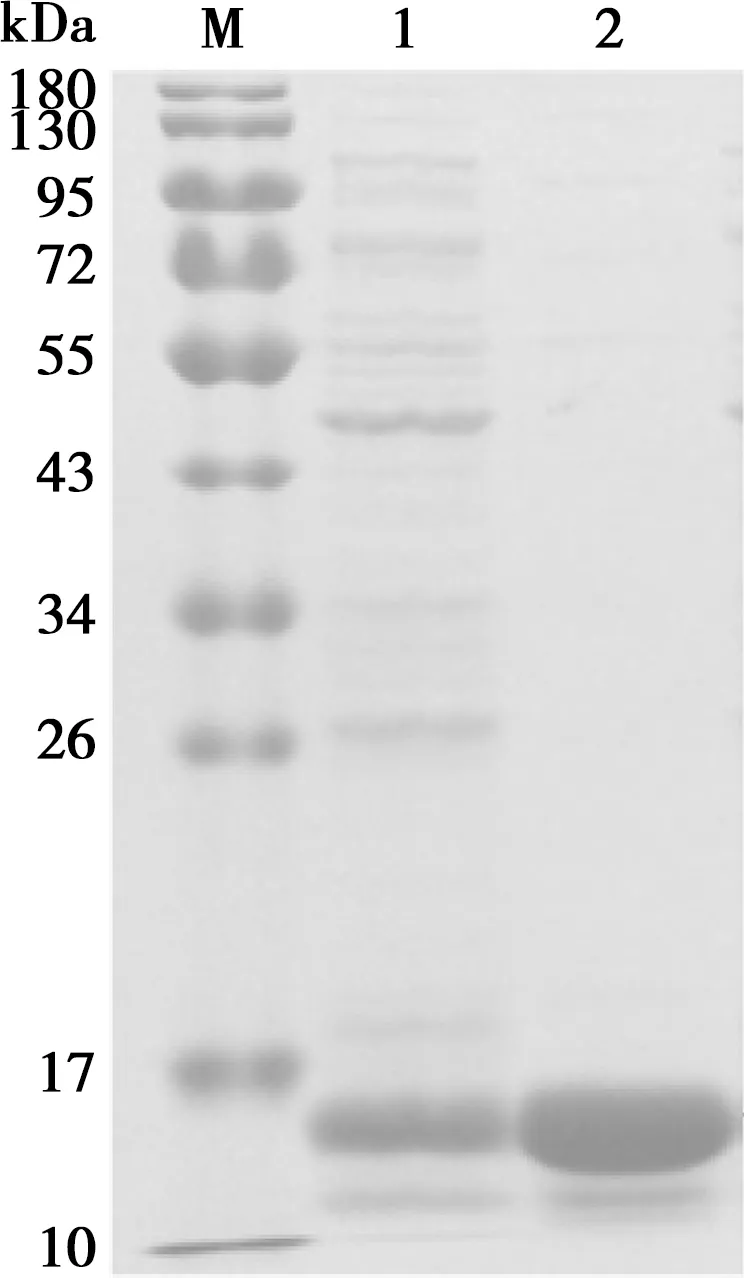
M. 蛋白分子量标准;1. 超滤浓缩前的3B重组蛋白;2. 超滤浓缩后的3B重组蛋白

表1 蛋白标准品和待测3B蛋白的吸光度及浓度
2.6 3B蛋白多克隆抗体效价及反应性测定
2.6.1 3B蛋白多克隆抗体效价测定
将纯化浓缩后的3B蛋白免疫新西兰大白兔,经过多次免疫,最终心脏采血并将血清分离。经过重组蛋白G琼脂糖凝胶FF纯化制备出了兔源的抗3B蛋白多克隆抗体。用间接ELISA方法检测抗体的效价达1∶512 000。
2.6.2 3B蛋白多克隆抗体反应性测定
将纯化的3B重组蛋白经SDS-PAGE后转膜,进行Western blot检测。如图5所示,纯化后的3B蛋白可被多克隆抗体检测到,而不能被兔阴性血清检测到,说明了本研究制备的3B蛋白多克隆抗体可以与3B蛋白发生特异性反应。
2.7 3B蛋白多克隆抗体的应用性检测
2.7.1 3B蛋白多克隆抗体检测过表达的3B蛋白在细胞中的定位
在IFA试验中,用制备的3B多克隆抗体检测了转染pXJ-3B质粒和pXJ41空载体质粒的HeLa细胞。如图6所示,转染了pXJ-3B的Hela细胞中,可以检测到过表达后定位于细胞核周围和细胞质中的3B蛋白。同时,转染了pXJ41空载体的Hela细胞中没有检测到特异性的红色荧光。说明制备的多克隆抗体可应用于该蛋白的亚细胞定位研究。

M. 蛋白分子量标准;1. 100 ng 3B蛋白(一抗为制备的3B多克隆抗体);2. 50 ng 3B蛋白(一抗为制备的3B多克隆抗体);3. 100 ng 3B蛋白(一抗为兔阴性血清);4. 空白对照
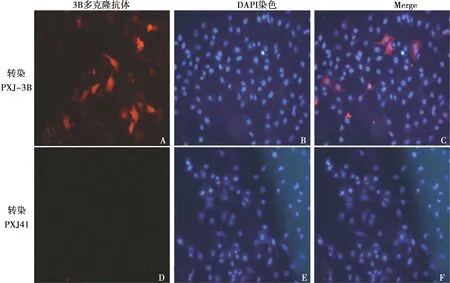
A. 转染pXJ-3B细胞的3B多克隆抗体染色;B. 转染 pXJ-3B细胞的DAPI染色;C. A与B叠加图D. 转染pXJ41空载体细胞的3B多克隆抗体染色;E.转染pXJ41空载体细胞的DAPI染色;F. D与E叠加图
2.7.2 3B多克隆抗体检测3B蛋白在细胞中的表达情况
Western blot试验中,用制备的多克隆抗体作为一抗检测分别转染了pXJ-3B与空载体pXJ41的HEK-293T细胞样品。如图7所示,转染了pXJ-3B质粒的样品在10 kDa处检测到了特异性条带,符合3B蛋白10 kDa的预期大小;而转染了空载体pXJ41的样品未检测到该条带,说明制备的3B蛋白多克隆抗体能够用于检测细胞中过表达的3B蛋白。
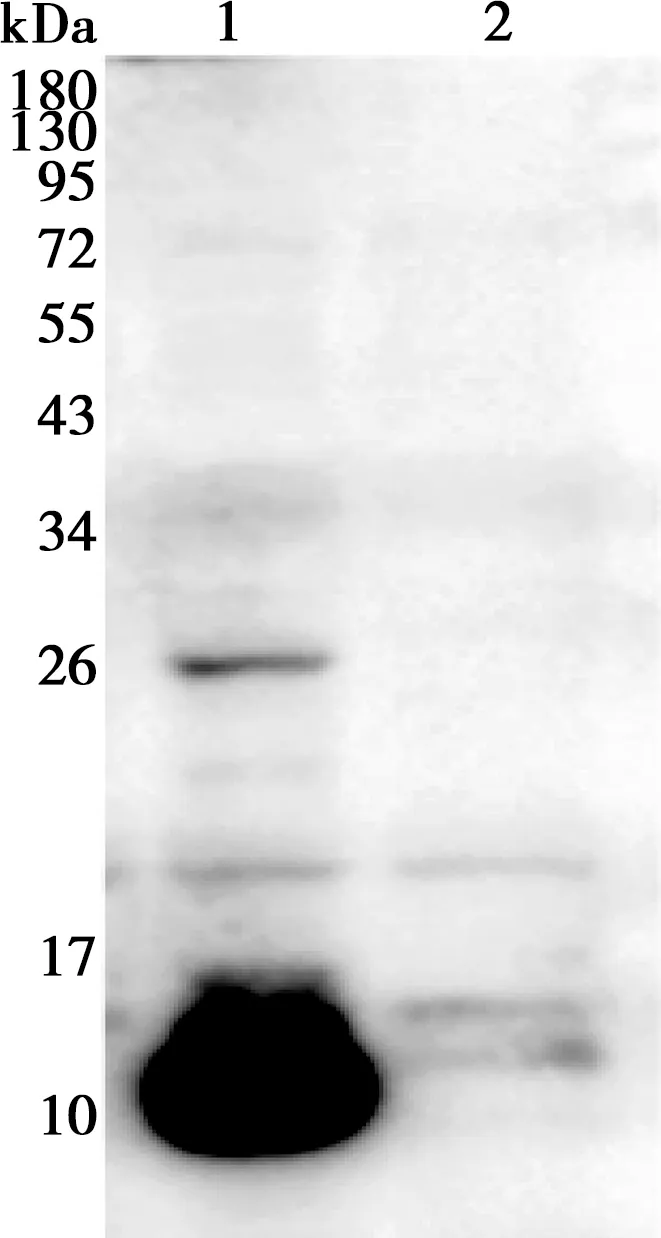
1. 转染pXJ-3B质粒;2. 转染pXJ41空载体
3 讨论
虽然口蹄疫病毒的致死率并不高,但它可以在患病家畜体内长期存活,使得健康家畜患病风险增加,是严重传染原。口蹄疫已严重影响了国际贸易中动物及家畜产品的进出口,并给畜牧业带来了巨大的经济损失[8]。目前,用于制备针对各种病毒的多克隆抗体免疫抗原的主要是活病毒以及该病毒的重组蛋白,其中利用重组蛋白不仅避免了病毒在免疫过程中引起散播的危险,还可以相对地提高针对目的蛋白的多克隆抗体的特异性[9],因此本研究选择了重组蛋白作为免疫原免疫动物制备多克隆抗体。
从作为免疫原进行疫苗、抗体等的应用研究角度来说,非结构蛋白比结构蛋白更有优势,因为其变异性更小[10-11],因此本研究选择了口蹄疫病毒非结构蛋白之一的3B蛋白作为免疫抗原。3B蛋白在病毒RNA复制合成时有重要作用。研究表明,感染了口蹄疫病毒的家畜体内会生成抗3B蛋白的抗体,可见3B蛋白具有免疫原性[12]。本研究用制备的纯度较高且浓度合格的3B蛋白注射试验动物,获得了抗3B蛋白的多克隆抗体。
本研究采用原核表达系统表达3B重组蛋白,将表达的重组蛋白进行纯化,得到的3B蛋白成分纯度较高,将该3B蛋白作为免疫原免疫新西兰大白兔,最终制备的多克隆抗体经间接ELISA测定显示其效价高达1∶512 000。用制备的多克隆抗体进行了Western blot试验,结果显示该多克隆抗体可以检测到3B重组蛋白,表明其反应性良好。将该多克隆抗体对真核表达系统过表达的3B蛋白进行了应用性检测,IFA结果显示,3B蛋白多克隆抗体可以检测到过表达后定位于真核细胞细胞核周围和细胞质中的3B蛋白;Western blot结果显示该多克隆抗体可以检测到在真核细胞中过表达的3B蛋白。以上结果说明3B蛋白多克隆抗体制备成功,为口蹄疫病毒3B蛋白的生物学功能研究和病原感染机制及致病机理的研究提供了重要的工具支持。
