超声辅助提取红豆多糖及其生物活性研究
2021-03-10邵佩庄虎谢超陈胜
邵 佩 庄 虎 谢 超 陈 胜
(1. 武汉黄鹤楼香精香料有限公司,湖北 武汉 430040;2. 湖北中烟工业有限责任公司,湖北 武汉 430040)
红豆(VignaangularisW.),属豆科豇豆属,又名红小豆、小豆、赤小豆、赤豆,在中国陕西、江苏、广西等地方分布较广[1]。红豆药用价值高,具有良好的健脾止泻、解毒消肿、预防肝硬化等功效[2]。其食用价值也极高,含有丰富的蛋白质、碳水化合物,还含有多酚、多糖、黄酮等多种生物活性成分[3]。

试验拟以红豆为原料,采用超声辅助提取法,以料液比、超声温度、超声时间为考察因素,采用响应面法优化提取工艺,经脱蛋白、醇沉、透析工艺处理后,评价红豆多糖的抗氧化及抑菌活性,以期提高红豆多糖提取率,为红豆的进一步开发利用提供参考依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与仪器
红豆:湖北恩施生产;
透析袋:西安优博生物科技有限公司;
葡萄糖:标准品,美国Sigma公司;
乙醇、磷酸二氢钠、磷酸氢二钠、铁氰化钾、冰乙酸、三氯化铁、30%双氧水、硫酸亚铁、水杨酸、过硫酸钾等试剂:分析纯,国药集团化学试剂有限公司;
2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS):标准品,上海源叶生物科技有限公司;
胰蛋白胨大豆琼脂(TSA)、胰蛋白胨大豆肉汤(TSB)培养基:青岛海博生物技术有限公司;
金黄色葡萄球菌(6538)、大肠杆菌(25922):美国标准生物品收藏中心;
沙门氏菌、枯草芽孢杆菌:由实验室保藏。
1.1.2 主要仪器设备
高速粉碎机:DFY-300型,温岭市林大机械有限公司;
电子分析天平:AL204型,梅特勒—托利多仪器上海有限公司;
超声波清洗机:KQ2200DE型,昆山市超声仪器有限公司;
旋转蒸发器:RE-52AA型,上海亚荣生化仪器厂;
紫外—可见分光光度计:UV-1750型,日本岛津公司;
手提式压力蒸汽灭菌锅:TX-24LDJ型,江阴滨江医疗设备有限公司;
超净工作台:VD-1320型,北京东联哈尔仪器制造有限公司;
生化培养箱:SHP-250型,上海精宏实验设备有限公司。
1.2 方法
1.2.1 原料预处理 红豆样品粉碎打粉后过60目筛,红豆粉用80%乙醇溶液回流4 h以脱色并除去小分子多糖等,抽滤后将滤渣用无水乙醇、丙酮和乙醚分别清洗,粉末置于室温下24 h阴干,得红豆粉末待用[16-17]。
1.2.2 红豆多糖的提取工艺流程
红豆粉末→超声波处理浸提→抽滤除渣→离心(8 000 r/min,10 min)→取上清液→在上清液中加入5%三氯乙酸至提取液不混浊(除蛋白)[18]→离心(8 000 r/min,20 min)→取上清液60 ℃下旋蒸至其体积的1/4左右→加入3倍体积的95%乙醇静置24~48 h→抽滤→滤渣离心(8 000 r/min,20 min)后取沉淀→用无水乙醇洗涤并收集沉淀→将沉淀溶于蒸馏水透析48 h→冷冻干燥→得红豆粗多糖
1.2.3 红豆多糖含量的测定 采用苯酚—硫酸分光光度法[16]。以葡萄糖浓度(mg/mL)为横坐标,吸光度为纵坐标,绘制标准曲线y=5.286x-0.017,R2=0.999 2。
取2 mL稀释提取液,加入体积分数5%苯酚溶液1 mL 和浓H2SO45 mL,充分混匀,室温静置30 min,于490 nm处测定吸光度,并使用标准曲线计算红豆多糖含量[19]。按式(1)计算多糖提取率。
(1)
式中:
Y——多糖提取率,%;
V——多糖溶液的体积,mL;
c——葡萄糖的质量浓度,mg/mL;
n——稀释倍数;
m——红豆粉的质量,g。
1.2.4 红豆多糖提取单因素试验 准确称取5 g红豆粉末,用蒸馏水作溶剂,在100 W下进行超声提取,测定红豆多糖提取率。
(1) 料液比:固定超声温度40 ℃,超声时间90 min,考察料液比[m红豆∶V水分别为1∶8,1∶16,1∶24,1∶32,1∶40 (g/mL)]对红豆多糖提取率的影响。
(2) 超声温度:固定料液比(m红豆∶V水)1∶24 (g/mL),超声时间90 min,考察超声温度(20,30,40,50,60 ℃)对红豆多糖提取率的影响。
(3) 超声时间:固定料液比(m红豆∶V水)1∶24 (g/mL),超声温度40 ℃,考察超声时间(30,60,90,120,150 min)对红豆多糖提取率的影响。
1.2.5 响应面法优化试验设计 在单因素试验基础上利用响应面法设计超声波辅助提取的试验方法,选取料液比、超声温度、超声时间为影响因素,以红豆多糖提取率作为试验设计的响应值,根据Box-Benhnken试验设计,利用三因素三水平的试验设计优化超声波辅助提取红豆多糖工艺参数。
1.2.6 红豆多糖体外抗氧化活性评价 根据文献[20]进行,测定红豆多糖的总还原能力,以及对·OH和ABTS+·的清除率。
1.2.7 红豆多糖抑菌活性的测定
(1) 菌种活化:取各待测菌株于TSA培养基上37 ℃下倒置培养24 h,用生理盐水洗斜面上的菌,充分震荡使菌悬液的浓度为108CFU/mL,备用[21]。
(2) 抑菌活力的测定:采用文献[21]中牛津杯法测定红豆多糖对金黄色葡萄球菌、大肠杆菌、沙门氏菌和枯草芽孢杆菌的抑菌活性。将熔化并冷却的TSA培养基倒入平板内约15 mL,待凝固后加入100 μL的108CFU/mL菌悬液采用涂布法涂布均匀,在平板标记处放置牛津杯,并于每个牛津杯中吸入200 μL经0.22 μm过滤器过滤的10 mg/mL多糖溶液(每组3个平行)。于37 ℃培养箱培养24 h后,采用十字交叉法测量抑菌圈直径,以抑菌圈直径作为抑菌活性的测定指标。
(3) 最低抑菌浓度(MIC)的测定:参照李彦坡等[22]的方法并根据实际情况有所调整。将红豆多糖分别制成0.625,1.250,2.500,5.000,10.000,20.000 mg/mL 6个浓度梯度,采用涂布法测定,将1 mL不同浓度多糖溶液与25 mL培养基混匀,待培养基凝固后,加入4种供试菌的菌悬液100 μL,涂布均匀后,倒置培养24 h,每组试验平行测定3次。
1.2.8 数据处理 采用Excel 2010处理数据和统计分析,Origin 8.0进行绘图。试验数据均重复3次,以平均值±标准偏差表示,以P<0.05表示差异显著且具有统计意义。
2 结果与分析
2.1 红豆多糖的提取工艺优化
2.1.1 单因素试验结果 由图1可知,料液比(m红豆∶V水)选择1∶16~1∶32 (g/mL)较合适;超声温度选择40~60 ℃较合适;超声时间选择60~120 min比较合适。

图1 3个因素对红豆多糖提取率的影响
2.1.2 响应面试验方案设计及结果 在单因素试验基础上,利用软件Design-Expert 8.0.6中的Box-Behnken模式对料液比、超声温度、超声时间进行三因素三水平的响应面试验设计(见表1),试验设计方案及结果如表2所示。
2.1.3 回归模型及方差分析 由表2可知,对试验数据进行多元回归拟合[23],得到红豆多糖提取率对料液比、超声温度、超声时间的二次多项回归方程:
Y=9.85+0.52A+0.39B+0.19C-0.45AB-0.06AC-0.17BC-0.81A2-1.40B2-0.65C2。
(2)
2.1.4 因素交互作用分析 由图2可知,料液比和超声温度的交互作用极显著(P<0.01),料液比和超声时间、超声温度和超声时间的交互作用不显著(P>0.05),该结论与方差分析结果一致。

表1 响应面试验因素及水平
2.1.5 最佳工艺条件的确定 利用Design-Expert 8.0.6软件分析得到红豆多糖的最佳提取工艺条件为:料液比(m红豆∶V水)1∶26.33 (g/mL),超声温度50.84 ℃,超声时间93.69 min,此条件下预测的最佳提取率为9.95%。虽然表2中试验号3和6提取率>10%,但考虑到试验样品的随机性,以及预测值与试验号3和6提取率值无显著性差异(P>0.05),故以Design-Expert 8.0.6软件分析得出的最佳提取工艺条件进行验证实验。考虑到实际情况,将工艺条件适当调整为:料液比(m红豆∶V水)1∶26 (g/mL),超声温度51 ℃,超声时间94 min,在该条件下进行3次平行试验,红豆多糖提取率平均值为(9.92±0.04)%,与预测最佳提取率基本一致,说明该模型优化结果可靠。
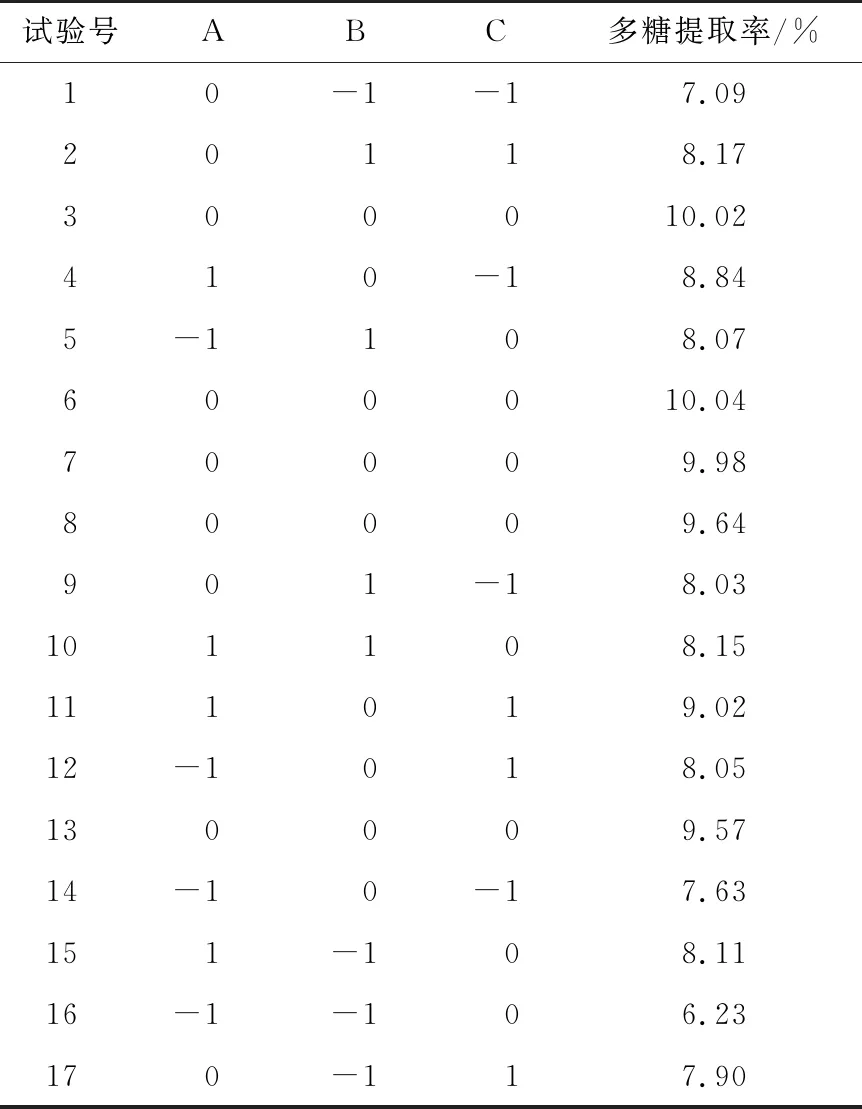
表2 红豆多糖响应面试验方案及结果

表3 回归方程各项的方差分析†
2.2 红豆多糖的抗氧化活性
2.2.1 总还原能力 由图3可知,红豆多糖的总还原能力与多糖浓度之间均呈现一定的量效关系。当多糖质量浓度为1~5 mg/mL时,随着浓度升高,多糖的总还原能力显著增加,与李粉玲等[13]的结论一致。当红豆多糖质量浓度为5 mg/mL时,总还原能力最强,吸光值达(0.486±0.007)。表明红豆多糖有较好的抗氧化能力,但显著弱于维生素C的抗氧化能力(P<0.05)。

图2 响应面及等高线图
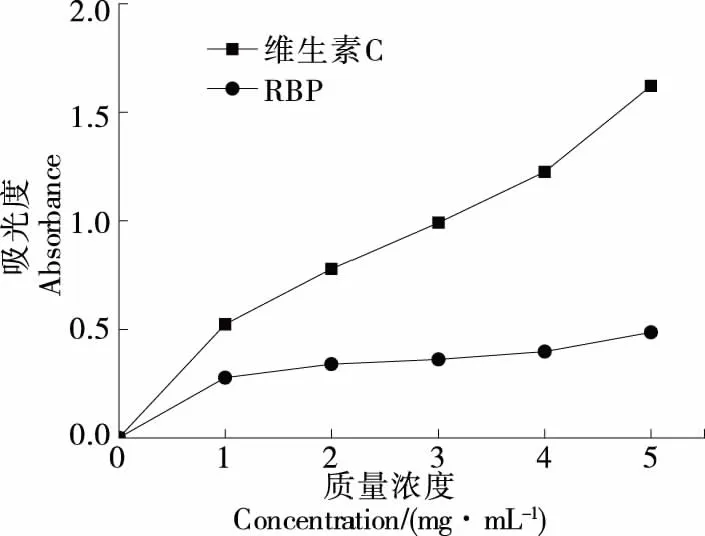
图3 红豆多糖总还原能力
2.2.2 清除·OH能力 由图4可知,当多糖质量浓度为1~5 mg/mL时,随着浓度升高多糖对·OH清除率逐渐增大。当质量浓度为5 mg/mL时,多糖对·OH清除率达(90.25±1.38)%,显著低于同浓度下维生素C对·OH清除率(P<0.05)。试验结果显著高于李粉玲等[13]研究的红豆多糖和钟葵等[26]研究的绿豆多糖在同质量浓度下的·OH清除率,表明红豆多糖对·OH有较强的清除能力。
2.2.3 清除ABTS+·能力 由图5可知,当多糖质量浓度低于1.5 mg/mL时,多糖对ABTS+·清除能力存在量效关系,随着浓度升高,多糖对ABTS+·清除能力增大;当多糖质量浓度为1.5~2.0 mg/mL时,对ABTS+·清除率的增长趋缓。当多糖质量浓度为2.0 mg/mL时,红豆多糖对ABTS+·清除能力达到最大值(96.20±3.25)%,与维生素C的ABTS+·清除能力无显著性差异(P>0.05)。许海燕等[27]研究显示桦菌芝多糖在2.0 mg/mL时对ABTS+·清除率为90%,低于试验结果,表明一定质量浓度下红豆多糖对ABTS+·有较强的清除能力。
2.3 红豆多糖的抑菌活性
2.3.1 抑菌圈直径 由表4可知,红豆多糖对金黄葡萄球菌、大肠杆菌、沙门氏菌、枯草芽孢杆菌具有不同程度的抑制作用,其中,红豆多糖对金黄色葡萄球菌的抑制作用最强,抑菌直径为(9.54±0.22) mm,与许海燕等[27]桦菌芝多糖对金黄色葡萄球菌的抑菌圈直径接近;对沙门氏菌和枯草芽孢杆菌的抑制较弱,抑菌圈直径分别为(8.24±0.06),(8.19±0.17) mm。红豆多糖对4种供试菌的抑制作用强弱顺序为金黄色葡萄球菌>大肠杆菌>沙门氏菌>枯草芽孢杆菌,表明红豆多糖具有良好的抑菌效果。

图4 红豆多糖对·OH清除率的影响

图5 红豆多糖对ABTS+·清除率的影响
2.3.2 最小抑菌浓度 由表5可知,红豆多糖对金黄色葡萄球菌、大肠杆菌、沙门氏菌、枯草芽孢杆菌的MIC值分别为2.500,5.000,10.000,10.000 mg/mL,说明红豆多糖金黄色葡萄球菌的抑菌作用最强,对沙门氏菌和枯草芽孢杆菌的抑菌活性最弱。结果表明红豆多糖的抑菌活性随着浓度增大而增强,且对革兰氏阳性菌的抑制作用强于革兰氏阴性菌。

表4 红豆多糖对4种供试菌的抑菌圈直径†
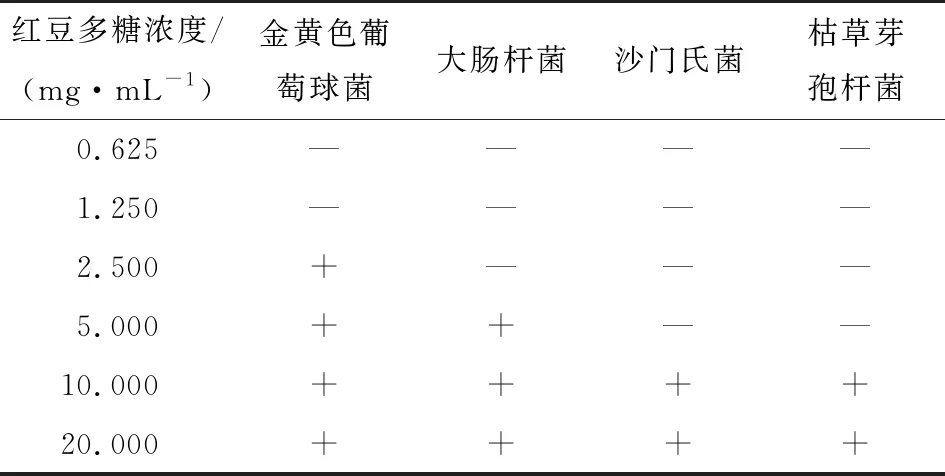
表5 红豆多糖对4种供试菌的MIC†
3 结论
通过单因素和响应面试验确定了红豆多糖的最佳提取工艺条件为:料液比(m红豆∶V水)1∶26 (g/mL),超声温度51 ℃,超声时间94 min,此条件下多糖提取率为(9.92±0.04)%。对红豆多糖的抗氧化及抑菌活性结果显示:① 红豆多糖具有较强的总抗氧化活性,但总还原能力及对羟基自由基、ABTS+自由基清除能力均低于维生素C;② 红豆多糖对金黄色葡萄球菌、大肠杆菌、沙门氏菌和枯草芽孢杆菌均有一定的抑制作用,且对金黄色葡萄球菌的抑菌活性最强。此外,目前关于红豆多糖的相关报道较少,后期研究可以从以下方面入手:① 试验初探了红豆多糖的抗氧化及抑菌活性,后面可对红豆多糖抗氧化活性成分构效关系及抑菌机理展开研究;② 试验提取的红豆多糖为粗多糖,纯度为62%,后续可对红豆多糖进一步分离纯化,提高多糖纯度。
