高效液相色谱法测定婴幼儿营养米粉中维生素A、D3和E含量的不确定度评定
2021-03-10张荣彬戴志勇李梦怡陈振桂任国谱
张荣彬 戴志勇 李梦怡 陈振桂 任国谱
(1. 中南林业科技大学食品科学与工程学院,湖南 长沙 410004;2. 英氏控股集团股份有限公司,湖南 长沙 410005)
维生素A和D是国家标准规定婴幼儿营养米粉中必须添加的维生素,维生素E是可选择添加的维生素。维生素A、D和E分别履行不同的职能,适当的添加维生素有助于婴幼儿的生长发育[1]。维生素A对多种眼科疾病治疗具有积极的作用,可促进眼内色素形成,防止夜盲和视力恶化[2],对机体的生理具有调节功能,促进身体成长发育、保持代谢平衡和增强免疫力[3]。维生素D对部分矿物质元素吸收具有促进作用,并保持体内钙、磷含量足够。同时,在内分泌系统中,维生素D还参与机体调节和无机盐交换[4]。维生素E俗称生物酚,对生殖器官的正常功能具有维持作用[5],可降低衰老速度,增强机体耐力,保护细胞组织和预防疾病。而过量摄入维生素A、D和E也会产生副作用,因此监测和控制维生素含量十分重要。
测量不确定度是表征合理的赋予被测量之值的分散性,是与测量结果相联系的参数[6],不确定度评估在实验室数据比对、方法确认、标准设备校准和数值溯源等方面具有很重要的意义,并且国际上与合格评定相关各方对测量不确定度也十分重视[7-8]。在脂溶性维生素检测方法中,最常用的为光谱法[9]、色谱法[10-11]、化学法和微生物法等,但其存在种种缺点,样品处理复杂、检测时间长、效率低,且不能同时检测和分析多种维生素,随着检测方法的不断发展,高效液相色谱法,提高了分析速度与灵敏度,且可以同时进行多种维生素检测。参照GB 5009.82—2016《食品安全国家标准 食品中维生素A、D、E的测定》、JJF 1059.1—2012《测量不确定度评定与表示》和JJG 196—2006《常用玻璃量器检定规程》标准,对高效液相色谱法测定幼儿营养米粉中维生素A、D3和E含量不确定度进行分析和评定,旨在提高试验结果的准确性,并为婴幼儿营养米粉的产品质量控制及检测提供依据。
1 材料与方法
1.1 材料
婴幼儿营养米粉:湖南英氏营养品股份有限公司检验研发中心质控样品。
1.2 试剂
抗坏血酸、BHT、无水乙醇、石油醚、甲醇、正己烷、无水硫酸钠、氢氧化钾:分析纯,广西西陇科学股份有限公司;
维生素A、D3和E标准品:浓度>98%,上海安普实验科技有限公司。
1.3 仪器与设备
超高效液相色谱仪(含二极管阵列检测器和自动进样器):LC-20AT型,日本岛津公司;
避光恒温水域振荡器:SHA-B型,常州博纳瑞仪器制造有限公司;
旋转蒸发器:RE-52AA型,巩义市予华仪器有限责任公司。
1.4 方法
1.4.1 样品制备 称取5.000 g样品于150 mL锥形瓶,加入30 mL温水和1 g淀粉酶,60 ℃恒温水浴振荡30 min 后加1.0 g抗坏血酸、0.1 g BHT、30 mL无水乙醇、15 mL氢氧化钾溶液,80 ℃回流皂化30 min后冷至室温,皂化液转入250 mL分液漏斗后加50 mL石油醚萃取5 min,将水相转移至另一250 mL分液漏斗,按上述步骤萃取第2次后合并醚层,水洗至中性。醚层经无水硫酸钠滤入250 mL蒸发瓶,15 mL石油醚冲洗分液漏斗及无水硫酸钠2次后一同并入,在旋转蒸发器水浴中减压蒸馏至近干后再氮吹至干,用甲醇定容至10 mL容量瓶,0.22 μm有机系滤膜过滤检测维生素A、E。
取5 mL上述溶液于10 mL容量瓶中水浴氮吹至干后加1 mL正己烷,0.22 μm有机系滤膜过滤后进行半制备,净化待测液。将待测液注入液相色谱仪,根据维生素D3标准溶液保留时间收集维生素D3馏分于2 mL容量瓶,水浴氮气吹干后加1.0 mL甲醇溶解,即维生素D3待测液。
1.4.2 维生素A、D3、E标准液配制
(1) 维生素A、D3和E标准储备液配制:准确称取25.0,2.4,65.9 mg的维生素A、D3和E(α-生育酚)标准品,无水乙醇溶解;维生素A和E用50 mL级容量瓶定容,质量浓度为0.500,0.024 mg/mL;维生素D3用100 mL 容量瓶定容,质量浓度为1.318 mg/mL。
(2) 维生素A、D3中间液:分别吸取维生素A和D3标准储备液2 mL与1 mL,分别在10 mL和100 mL容量瓶中用水定容,中间液质量浓度为100 μg/mL和0.24 μg/mL。
(3) 维生素A、D3、E 标准曲线工作液:吸取维生素A中间液和维生素E标准储备液100,200,400,600,800 μL,取10 mL容量瓶加水定容,维生素A工作液质量浓度1,2,4,6,8 μg/mL,维生素E质量浓度13.18,26.36,52.72,79.08,105.44 μg/mL。
吸取维生素D3中间液100,200,400,600,800 μL,取10 mL容量瓶加水定容,得到质量浓度为0.024,0.048,0.096,0.144,0.192 μg/mL标准曲线工作液。
1.4.3 色谱条件 高效液相色谱法测定婴幼儿营养米粉中维生素A、D3和E的色谱条件见表1。
2 模型建立
2.1 数学模型
要计算不确定性,必须首先完善用于计算测量值的数学模型,以便分析其可能的不确定性来源[12]。只有考虑到影响测量值不确定度的主要因素时,整个计算过程中才能接受所得到的各自的相对不确定度值[13],因此此次试验的维生素A、D3和E模型分别为:
(1)
(2)
(3)

表1 色谱条件
式中:
X——维生素的含量,μg/100 g;
C——标准工作曲线计算得到的维生素浓度,μg/mL;
f——维生素D3浓缩液体积,mL;
V——试样定容体积,mL;
m——试样质量,g;
R——回收率因子。
2.2 不确定度主要来源
参照试验方法并结合试验操作,不确定的来源主要有:① 样品制备过程引入的不确定度UrelYP;② 标准物质引入的不确定度UrelBZ;③ 重复性试验的不确定度UrelCF;④ 回收率引入的相对标准不确定度UrelHS。
3 不确定度分量的评定
3.1 样品制备过程引入的不确定度UrelYP
3.1.1 样品取样引入的不确定度Urelm1依据GB/T 5009.1—2003《食品卫生检验方法 理化部分 总则》,样品混匀后随机取样,均匀且具有代表性,忽略其不确定度。
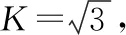
取样量为5.000 g时引入的相对不确定度为:
3.1.3 样品定容引入的不确定度UrelD试样经过处理进行定容,维生素A与E样品定容均采用10 mL容量瓶,维生素D3样品在10 mL容量瓶初步处理后进行半制备,半制备过程中使用1 mL和5 mL移液管,并最终定容在2 mL容量瓶中,结果见表2。
根据表2,样品定容引入的不确定度为:
UrelD-维生素A=UrelD-维生素E=0.001 31。
3.1.4 样品制备引入的相对标准不确定度 样品制备引入的相对标准不确定度公式为:
(4)
综上所述,由式(4)求得:UrelYP-维生素A=0.001 31,UrelYP-维生素D3=0.006 38,UrelYP-维生素E=0.001 31。
3.2 标准物质引入的不确定度UrelBZ
3.2.1 标准储备溶液引入的相对不确定度UrelC
(1) 标准品引入的相对不确定度UrelC1:通过标准证书可知,维生素A、D3、E不确定度分别为1%,1%,2%,均匀分布,K=2,则标准品引入的相对不确定度为:
UrelC1-维生素A=UrelC1-维生素D3=0.005 00;
UrelC1-维生素E=0.010 00。
(2) 标准品称量引入的相对标准不确定度UrelC2:称取维生素A、D3和E标准品,分别为25.0,2.4,65.9 mg,根据3.1.2得知,电子天平US为0.000 057 7 g,根据式(5)求得其相对不确定度分别为:UrelC2-维生素A=0.002 31,UrelC2-维生素D3=0.024 16,UrelC2-维生素E=0.000 88。
(5)
式中:
US——电子天平标准不确定度,g;
m——称取的维生素A、D3和E标准品质量,mg。
(3) 标准储备溶液定容引入的相对标准不确定度UrelC3:维生素A与E标准品均采用50 mL容量瓶,维生素D3标准品需用100 mL容量瓶。样品制备引入的相对标准不确定度公式为:
(6)
根据表3数据并结合式(6),则标准储备溶液定容引入的相对标准不确定度为:
UrelC3-维生素A=UrelC3-维生素E=0.000 832;
UrelC3-维生素D3=0.000 833。
(4) 标准储备溶液的配制引入的相对标准不确定度:样品制备引入的相对标准不确定度公式为:
(7)
由式(7)求得:
UrelC-维生素A=0.005 70;
UrelC-维生素D3=0.024 69;
UrelC-维生素E=0.010 07。
3.2.2 标准储备溶液稀释引入的相对标准不确定度UrelX
标准储备液进行稀释时,维生素A、D3分别用2 mL 和1 mL移液管,且都需10 mL容量瓶进行定容。根据表4,其稀释引入的不确定度为:
3.2.3 标准工作曲线引入的相对标准不确定度UrelG根据表5数据,计算结果为:


表2 样品定容引入的不确定度†

表3 标准储备溶液定容引入的相对标准不确定度†

表4 稀释引入的不确定度†

表5 标准曲线工作液制备引入的不确定度†
3.2.4 标准曲线引入的相对标准不确定度UrelQ分别配制1,2,4,6,8 μg/mL的维生素A标准溶液,0.024,0.048,0.096,0.144,0.192 μg/mL的维生素D3标准溶液,13.18,26.36,52.72,79.08,105.44 μg/mL的维生素E标准溶液进行测定,每浓度测量两次,采用最小二乘法拟合标准溶液的质量浓度与峰面积曲线,数据见表6。
Sy为回归方程的标准偏差公式:
(8)
不确定度的计算公式:
(9)

表6 校准曲线拟合数据
标准工作液曲线引入的相对标准不确定度:
(10)
式中:
Ai——标准工作曲线斜率;
B——标准工作曲线截距;
n——标准工作液的测试次数,n=10;
yi——不同浓度对应的峰的峰面积;
P——测试次数,P=2;

根据表6,标准工作液曲线引入的相对标准不确定度为:UrelQ-维生素A=0.010 76,UrelQ-维生素D3=0.014 93,UrelQ-维生素E=0.004 24。
综上所述,则标准物质引入的不确定度为:



3.3 重复性试验的不确定度UrelCF
称取同一批次的婴幼儿米粉,进行6次平行试验,同时进行前处理,在相同的高效液相色谱条件下平行测定定容后试样液中维生素A、D3和E的浓度,呈正态分布,采用极差法,结果见表7。
单次试验测量的标准偏差公式为:
(11)
两次测定婴幼儿营养米中维生素A、D3、E含量的平均值的相对标准不确定度公式为:
(12)
根据表7计算重复性试验的不确定度为:UrelCF-维生素A=0.003 84,UrelCF-维生素D3=0.021 70,UrelCF-维生素E=0.005 15。
3.4 回收率引入的相对标准不确定度UrelHS
准确称取约5.000 g婴幼儿营养米粉固体,加入维生素A、D3和E各3个浓度梯度进行回收率的测定。但由于试样酶解不完全、皂化不完全,石油醚萃取和蒸馏浓缩操作不当、基质的干扰等,导致维生素A、D3和E的损失,则婴幼儿米粉中维生素A、D3和E不能100%的进入测定中。本底样品6次数据见表8。


表7 试验数据及分析结果
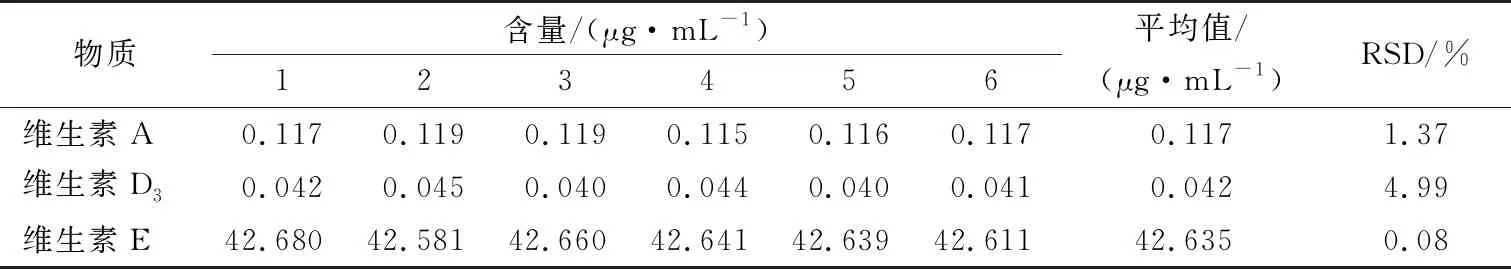
表8 本底样品6次数据

表9 维生素A加标回收率数据
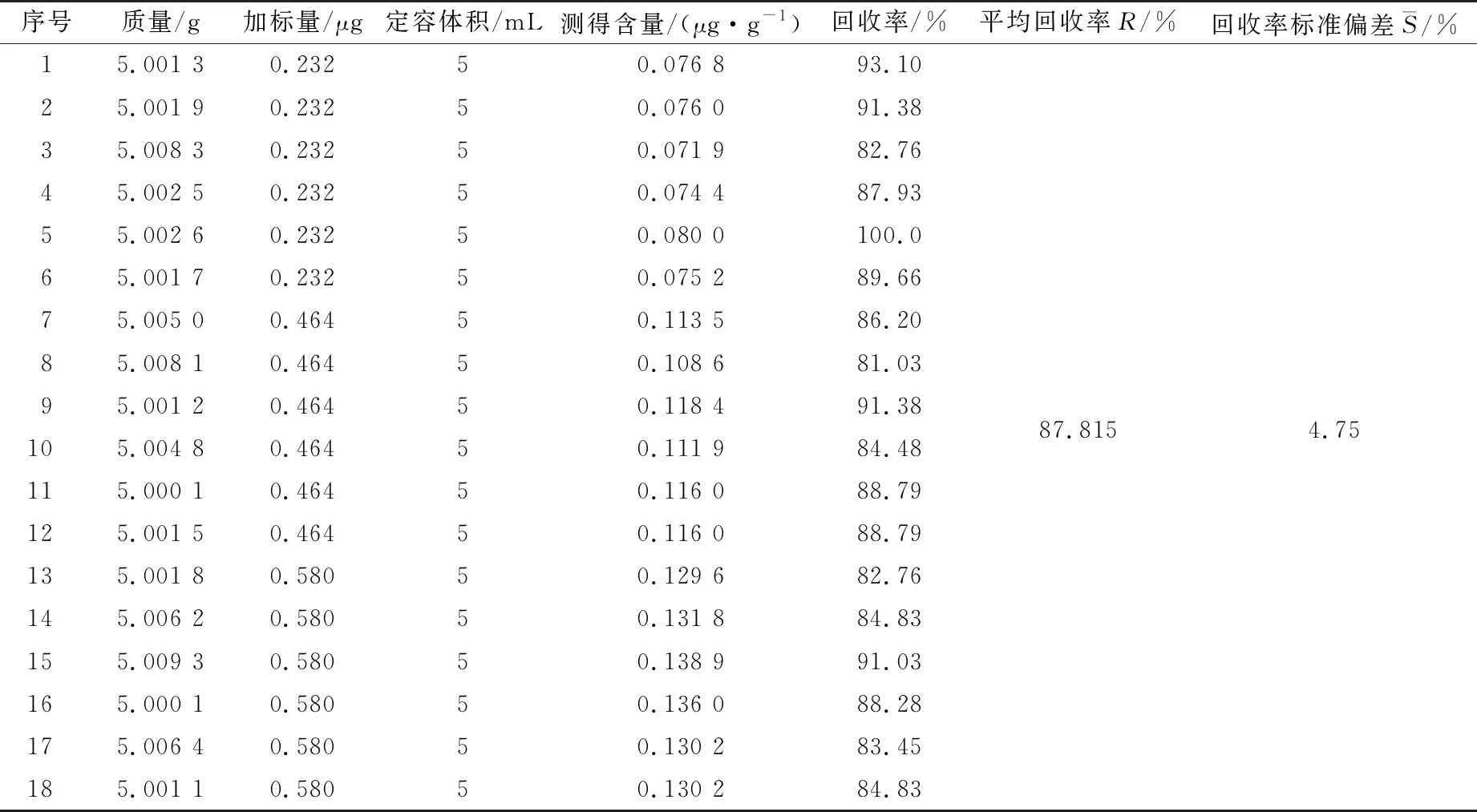
表10 维生素D3加标回收率数据

表11 维生素E加标回收率数据
则:UrelHS-维生素A=0.009 90;UrelHS-维生素A=0.012 70;UrelHS-维生素E=0.007 47。
为了判断是否引进回收率校正因子R,在实际计算时,需要对回收率进行显著性分析[15]。
将数据代入式(13),则T维生素A=6.891 9;T维生素D3=9.552 9;T维生素E=5.791 9,根据t检验临界值分布表,当自由度f=4时,查t临界值分布表[16],t(0.05,4)=2.776 0。根据试验结果,T维生素D3>T维生素A>T维生素E>2.776,因此计算需要引入校正因子。
(13)
3.5 合成标准不确定度
合成标准不确定度计算公式如式(14)所示。
(14)
根据式(14)且结合数据,合成标准标准不确定度计算结果如表12所示。
3.6 扩展不确定度
在置信概率95%时,K=2,则扩展不确定度为:
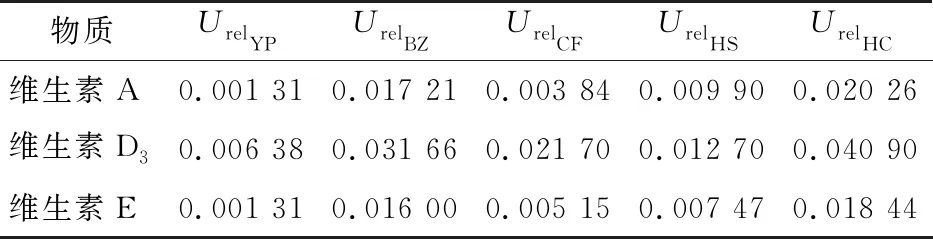
表12 各相对标准不确定度
3.7 测量不确定度报告
高效液相色谱仪同时对婴幼儿营养米粉中维生素A、D3和E含量进行测定,结果为:
X维生素A=(9.250 0±0.188 4) μg/g(K=2);
X维生素D3=(0.114 0±0.009 3) μg/g(K=2);
X维生素E=(0.1815±0.006 7) μg/g(K=2)。
4 结论
采用高效液相色谱法同时对婴幼儿营养米粉中维生素A、D3和E进行测定,当取样量为5.000 g时,样品中维生素A、D3和E扩展不确定度为0.188 4,0.009 3,0.006 7 μg/g,测定含量为(9.250 0±0.188 4),(0.114 0±0.009 3),(0.181 5±0.006 7) μg/g。
结合试验过程及计算结果可知,婴幼儿米粉中维生素A、D3和E的最终结果的不确定度主要是由标准溶液储备液配制、标准工作曲线拟合和回收率引起的。因此,选择最佳试验条件、采用高精密度仪器、定期维护及保养设备、改善试验方法和规范试验操作对提高试验结果的准确性至关重要。
