Mrgprs 家族蛋白在疼痛形成中的作用和特点
2021-03-09王媚媛唐宗湘
朱 婵 王媚媛 唐宗湘
(南京中医药大学,医学院·整合医学院,南京210029)
疼痛是影响人类健康最普遍的问题,由于病因多、形成机制复杂、治疗效果欠佳使许多病人仍忍受着不同程度的折磨。Mrgprs 家族蛋白是一类G 蛋白偶联受体,越来越多的研究表明:本家族蛋白中的成员参与了疼痛的产生和发展,成为了疼痛形成机理研究的新方向和镇痛药物研发的新目标。该文综述了Mrgprs 家族G 蛋白偶联受体的特点,参与疼痛的Mrgprs 家族成员和作用机制,以及该类受体可能成为镇痛药物研发的潜在靶点等内容,以期能给疼痛的基础研究人员和临床工作者提供参考。
一、Mrgprs 家族G 蛋白偶联受体的发现及特点
机体的外周神经系统具有接受外界环境变化刺激并将信息传导到中枢神经系统产生各种感觉的功能。分布在外周神经系统上的各种受体扮演着重要角色,G 蛋白偶联受体是众多受体中的一类,在嗅觉、味觉、痛觉和痒觉等感觉中起重要作用。Mrgprs受体作为最近发现的、主要分布在外周神经系统上的G 蛋白偶联受体家族,其功能越来越受到相关领域研究者的关注。Mrgprs 是一类与Mas 基因相关的G 蛋白偶联受体,人类Mas 基因最初于1986 年从人类表皮癌细胞的DNA 中分离得到,因为其能够诱导NIH3T3 细胞发生恶性转化,因此,被认为是一种原癌基因;随后,Young 等[1]通过分析Mas氨基酸序列的疏水性图,并借助一种可以正确预测多种蛋白质跨膜片段的算法,发现其具有七个疏水性跨膜结构域,提示该蛋白属于G 蛋白偶联受体 (GPCRs);然而,后续的研究却推翻了Mas 基因是原癌基因这一结论。Dong 等[2]通过对比正常小鼠与转录因子神经原素1 (Ngn1) 缺失小鼠的cDNA 文库,发现Ngn1 缺失小鼠不能发育出TrkA+神经元(其中包括伤害性感受神经元),于是推测能够在正常小鼠中表达但无法在Ngn1 缺失小鼠中表达的基因应当与TrkA+伤害感受器有关,并成功筛选出与伤害感受功能调节相关的一个全新的GPCR 家族,因为它们与Mas 基因具有同源性,便将其命名为Mas 相关基因 (Mas-related genes, Mrg);几乎同时,Lembo等[3]发现了一组在人类感觉神经元上特异性表达的孤儿受体,将其命名为感觉神经元特异性G 蛋白偶联受体 (sensory neuron-specific G protein-coupled receptors, SNSR),并推测SNSR 在疼痛感知中起作用;后来证实,SNSR 与Mrg 受体中的亚家族MrgX 是同一类蛋白,只是命名方式不同[3];为了解决命名不同带来的问题,人类基因组机构中基因命名委员会 (HGNC) 统一将其命名为Mas 相关基因G 蛋白偶联受体 (Mrgpr)。
Mrgprs 也被称为感觉神经元特异性受体,属于GPCRs 家族中的一类;在小鼠、大鼠、沙鼠、红尾猴、猕猴和人类中均发现了该受体的表达。Mrgprs家族由50 多个成员组成,根据其基因序列相似性,将Mrgprs 家族成员分为9 个亚类,用大写字母表示,分别为MrgprA-H 与MrgprX,每个亚家族中的不同成员用数字表示;其中MrgprA、B、C 和H 为啮齿类动物所特有,MrgprX 只存在于灵长类动物(猕猴、恒河猴)和人类;而MrgprD、E、F、G 均为只含一个成员的单基因亚家族,在啮齿类和灵长类均存在,且有明确的同源关系[2,4]。Mrgprs 家族中除少数成员在肥大细胞等非神经细胞被发现外,绝大多数只在痛觉密切相关的三叉神经和背根神经节的伤害性小直径神经元中表达;由于这些感觉神经元的外周端神经末梢广泛分布于皮肤表皮浅层,中枢端轴突延伸至脊髓背角浅层,因此,Mrgprs 这种高度特异性表达的组织结构,意味着这些受体分子参与了伤害性感觉信息的产生和传递。
目前发现与疼痛相关的Mrgprs 家族蛋白,主要包括小鼠:MrgprC11 和MrgprB2;大鼠:MrgprC;人:MrgprX1、MrgprX2 以及在小鼠、大鼠和人中均表达的MrgprD 等(见表1),本文将对参与疼痛的Mrgprs家族成员的特点和研究进展进行综述。
二、Mrgprs 受体与疼痛
1. MrgprC/MrgprC11/MrgprX1 受体主要参与抑制炎症和神经病理性疼痛
MrgprC 亚家族在大鼠和小鼠中均只包含一个编码基因(大鼠为MrgprC,小鼠为MrgprC11),MrgprC 和MrgprC11 受体可与多个配体结合,包括:γ2-促黑激素 (γ2-MSH)、牛肾上腺髓质8-22 肽 (BAM8-22)、强啡肽-14 和神经肽FF (NPFF) 等;该类受体的广泛结合谱特性表明:MrgprC 可通过不同信号途径发挥生理效应[5]。BAM8-22 能激活大鼠和小鼠初级感觉神经元中的MrgprC/MrgprC11 受体;然而,NPFF 激活大鼠MrgprC 的功效远弱于小鼠的MrgprC11;强啡肽-14 并不激活大鼠MrgprC[6~8];因此,BAM8-22 被认为是MrgprC/MrgprC11 的特异性配体,并广泛用于研究MrgprC/MrgprC11 在大鼠或小鼠中的生理功能。
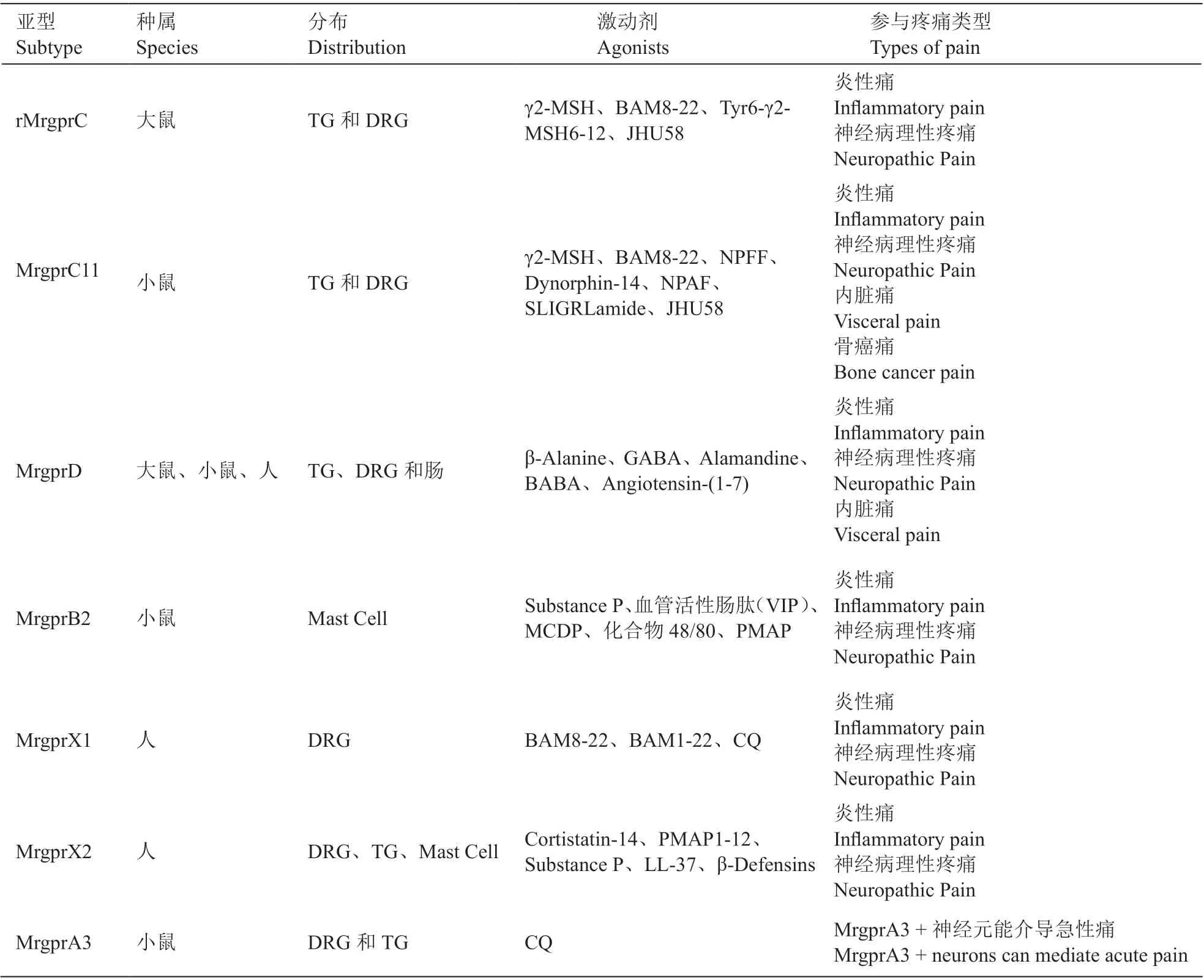
表1 人、小鼠和大鼠中Mrgprs 受体参与疼痛比较
MrgprC 参与了炎性疼痛:鞘内给予MrgprC 的特异性激动剂BAM8-22 并不影响正常大鼠的热痛觉反应[9];siRNA 技术沉默大鼠MrgprC 基因的表达,也不改变其伤害性感受阈值,然而,缺失MrgprC 受体的大鼠在完全弗氏佐剂 (CFA) 诱导的炎性痛模型中,其热痛觉过敏显著减轻;外周炎症可上调背根神经节 (dorsal root ganglion, DRG)中的MrgprC 受体的表达[10];上述研究表明:MrgprC 受体在生理状态下不参与痛觉信息的传递,但在诱导炎症性疼痛中起促进作用;但在鞘内注射MrgprC 受体激动剂BAM8-22 后,可明显抑制由CFA 诱发的痛觉过敏行为,提示MrgprC受体在炎症性疼痛中具有保护作用;并且发现MrgprC 的激活能通过Gq 蛋白依赖的信号通路降低CFA 诱导的DRG 或脊髓背角中CGRP 和nNOS 的表达,抑制兴奋性氨基酸的释放,减轻CFA诱导的热痛觉过敏[11]。此外,MrgprC 激动剂还能够减轻福尔马林诱导的疼痛行为,并抑制脊髓背角c-Fos 表达的增加[12],这些反应的差异表明了该受体功能复杂的特征。
MrgprC 也参与了神经病理性疼痛:周围神经损伤引起的神经病理性疼痛归因于中枢敏化,神经损伤后,炎症介质在局部释放,刺激受损轴突引起初级感觉DRG 神经元敏感性和兴奋性增加,DRG神经元将增强的伤害性信息传递给脊髓背角神经元,导致中枢敏化[13];因此,抑制外周和中枢的敏化将能抑制神经病理性疼痛的发生和发展。He 等[14,15]研究发现鞘内注射BAM8-22 和JHU58(一种新型MrgprC 激动剂)能够抑制SNL 和CCI 神经病理性疼痛模型中大、小鼠的机械痛觉过敏和热痛觉过敏,而这种作用能够被MrgprC siRNA 和MrgprC的选择性拮抗剂所抑制;鞘内注射BAM8-22 还可抑制SNL 诱导的脊髓背角小胶质细胞活化,降低SNL 诱导的DRG 神经元中nNOS 的上调;这些变化可能是因为MrgprC 受体激活后,通过抑制周围神经损伤导致的DRG 神经元nNOS 增加和脊髓背角小胶质细胞的活化所致,结果使疼痛敏感性降低。
MrgprC 还参与了骨癌痛的发生和发展。鞘内注射BAM8-22 激活MrgprC 受体能显著减轻骨癌痛模型鼠的疼痛行为,并上调脊髓背角MrgprC 和Gi 蛋白,下调脊髓p-NR2B、t-nNOS 和p-nNOS,其机制可能是通过Gi-NR2B-nNOS 信号通路参与镇痛[16];Sun 等[17]研究表明MrgprC11 的泛素化参与了小鼠骨癌痛的产生和维持,可能是通过调节小鼠脊髓神经元细胞内钙离子浓度来实现的,鞘内注射BAM8-22 能够增强吗啡的镇痛作用并降低吗啡的慢性耐受,其可能机制是MrgprC11 与阿片受体 (MORs) 形成异源复合物,MrgprC11 的激活促进了MORs 的内吞和再循环,减少了MOR 与β-arrestin-2的偶联,增强了吗啡对cAMP 生成的抑制作用,产生了比单个单价激动剂更强的镇痛效果;MrgprC11激动剂能够增强吗啡的急性镇痛作用,降低吗啡耐受性,MrgprC11 通过与MOR 相互作用正向调节MOR 的功能[18]。此外,MrgprC11 也参与内脏的超敏反应,Van 等[19]和Castro 等[20]发现BAM8-22 能够显著增加小鼠结肠和直肠的扩张,增强结肠和直肠疼痛敏感性,在有害刺激发生时,内脏感觉神经元激活程度明显增加。
人类MrgprX1 是大鼠MrgprC,小鼠MrgprC11的同源受体,也都能被BAM8-22 和γ2-MSH 等激动剂激活。因此,可通过研究MrgprC 受体的功能来推断MrgprX1 的作用;然而,大多数MrgprX1选择性激动剂对MrgprC11 作用较弱或没有作用,且不影响啮齿动物的疼痛行为[21]。在小鼠和大鼠的神经病理性疼痛模型中,MrgprC11 和MrgprC 受体的激动剂Arg-Phe-NH2 和JHU-58 均具有明显的镇痛作用,但并不能激活MrgprX1 受体,说明结构相似的分子在不同物种之间存在着功能的差异,这也容易理解为什么许多对动物模型效果良好的药物对人的疗效较差或没有作用的原因。基于以MrgprX1受体为靶点的药物开发为目标,Li 等[22]构建了细菌人工染色体 (BAC) 转基因MrgprX1 小鼠品系,发现在人源MrgprX1 小鼠中,BAM8-22 可通过Gαi依赖的途径抑制DRG 神经元N 型高电压激活 (high voltage-activate, HVA) 钙电流 (Ica),而且MrgprX1 受体激动剂BAM8-22 和其正变构调节剂PAM (ML-382)主要通过Gαi 依赖的信号通路来抑制DRG 神经元中的N 型HVA 钙电流 (Ica),减弱高阈值纤维向脊髓背角神经元的突触信息传递,起到缓解持续性疼痛的作用。除了参与疼痛抑制,MrgprX1 也被认为是周围神经末梢的痒觉受体之一,Sikand 等[23]将BAM8-22 注射到15 位健康志愿者的前臂,发现每个受试者身上均产生瘙痒感觉,并伴随有灼热感和刺痛感。
2. MrgprD 参与神经病理性疼痛在内的伤害性感觉
MrgprD 最初被认为主要分布在灵长类和啮齿类动物的DRG 和TG 神经元中,最新的研究显示MrgprD 在小鼠主动脉内皮细胞、中性粒细胞、心肌细胞、巨噬细胞、T 淋巴细胞和肠道平滑肌层中均有表达[24~26],其配体包括β-丙氨酸、GABA、Alamandine 等[25,27]。
MrgprD 在DRG 和TG 中表达于IB4+非肽能小直径伤害性感觉神经元上 ,并且MrgprD 阳性感觉神经元的外周端支配表皮颗粒层,这种分布特点提示MrgprD 可能在疼痛的感受和调控中起到一定的作用。Dussor 等[28]采用膜片钳技术对分离的小鼠DEG 中MrgprD+阳性神经元进行检测,发现其具有典型的痛觉感受器特性:长时程动作电位、抗TTX 的Na+电流和mu 阿片类药物抑制的Ca2+电流;并且,MrgprD 阳性神经元几乎只对细胞外ATP 产生反应,其电流类似于P2X3 受体激活后产生的电流,而该类神经元对伤害性激动剂(包括辣椒素、肉桂醛、薄荷醇、pH6.0 或谷氨酸盐)几乎不敏感,这些表达分布和生理特性表明:MrgprD 阳性神经元是位于皮肤内感受伤害刺激的重要单元;Zylka 等[29]已对小鼠MrgprD 阳性DRG 神经元的外周和中枢投射进行了详细研究,发现MrgprD 阳性神经元具有感受伤害性刺激的重要特性,大多数MrgprD 能够与ATP 门控通道腺苷受体P2X3 共表达,而小部分MrgprD(大约9%)表达在TRPV1 阳性神经元;Shinohara 等[27]也通过原位杂交和免疫染色证实了MrgprD 的 mRNA 与P2X3 和TRPV1 在大鼠和猴子的DRG 中共表达的特性,提示MrgprD 可能与这两种受体相互作用,共同调节机体的疼痛;在与正常小鼠的比较研究中,MrgprD 敲除的小鼠对机械性伤害刺激的敏感性下降,但对冷、热伤害性刺激的反应则没有变化[30];为了解释MrgprD 基因敲除小鼠对机械刺激的敏感性降低的原因,Crozier 等[31]采用全细胞膜片钳技术分析了DRG 中MrgprD 阳性神经元的特性,发现其激动剂β-丙氨酸能够抑制KCNQ/M-电流,进而增加MrgprD 神经元的兴奋性,因此,当MrgprD 缺失时,KCNQ/M-电流的抑制效果被解除,神经元的兴奋性下降,对机械刺激的敏感性降低。
近年来,越来越多的研究证实MrgprD 参与了多种类型的疼痛,Wang 等[32]的研究表明MrgprD参与了CCI 诱导的神经病理性疼痛,MrgprD 受体激动剂β-丙氨酸诱导的DRG 神经元反应与TRPA1相关,且MrgprD 与TRPA1 之间的相互作用主要是通过PKA 信号通路完成。此外,单细胞RNA 测序和免疫组化等表明MrgprD 在肠道神经元中也有表达[26,33],基于肠道中的表达特性,推测MrgprD 参与了肠易激综合征相关的内脏痛觉过敏反应[34]。
3. MrgprB2/MrgprX2 参与神经源性炎症和疼痛
MrgprX2 最初被发现在人DRG 小直径伤害性感觉神经元中具有高水平表达,推测其在伤害性感受中起关键作用,但由于缺少相应的配体,给其功能研究带来困难。为此,Robas 等[35]建立了一个1200 个内源性GPCR 配体库,包括药物样小分子、肽和生物活性脂类,并通过筛选发现cortistatin-14为MrgprX2 的高亲和力配体,这意味着cortistatin-14 可能通过MrgprX2 在痛觉传递中起作用,由于缺乏合适的动物模型,该假设尚未得到证实;随后,MrgprX2 被发现除在肥大细胞中存在高水平表达外[36],还在下丘脑、垂体、甲状腺、肺、胃肠胰管、睾丸和卵巢中均有不同程度的表达[37];最新研究表明,MrgprX2 还可在人的嗜酸性细胞和嗜碱性粒细胞中表达并介导其脱颗粒[38]。
肥大细胞作为免疫反应过程中的关键效应细胞之一,是连接神经系统和免疫系统的重要环节,由于肥大细胞能够非常接近神经末梢,相对其他先天性免疫细胞具有明显的空间优势,能够最先对感觉神经激活做出反应。而肥大细胞-神经细胞之间相互作用的失调被认为是神经源性炎症和疼痛发病机制的一个主要因素。当肥大细胞被激活时,释放出广泛的促炎性细胞因子和趋化因子可作用于感觉神经末梢上的特定受体,引起神经末梢释放P 物质(SP)和血管活性肠肽(VIP)等神经肽,这些神经肽又激活肥大细胞上的受体,诱导肥大细胞进一步脱颗粒释放大量的促炎因子和趋化因子,引起神经源性炎症。除了这种肥大细胞与感觉神经的局部相互作用外,痛觉信号也可通过神经末梢Ca2+介导的轴突电位放大,引起末梢纤维的兴奋,产生的神经信号能沿轴突顺行到达中枢神经系统;神经源性的SP 和VIP等肽类物质可通过MrgprX2 受体激活肥大细胞,这表明MrgprX2 有助于神经源性炎症和疼痛的发展[37,38]。
为了研究MrgprX2 在肥大细胞中的功能,Mc-Neil 等[39]分析了小鼠的同源序列,通过在原代肥大细胞中对Mrgprs 基因进行了严格的RT-PCR 筛查,推测小鼠中的MrgprB2 与人类MrgprX2 为同源基因,然后,将MrgprB2异源性表达在HEK293细胞上,发现MrgprX2 激动剂PAMP 和化合物48/80 同样能激活表达MrgprB2 的HEK293 细胞,因此,小鼠的MrgprB2 与人类的MrgprX2 被确定为同源性受体。最近,Green 等[40]的研究证实在术后痛模型和CFA诱导的炎性痛模型中,MrgprB2-/-小鼠的炎症和痛觉过敏反应较正常小鼠均显著减轻,MrgprB2-/-小鼠在损伤部位的先天免疫细胞募集明显减少,并提出了肥大细胞与神经细胞之间相互作用的假设:组织损伤后释放的SP 通过MrgprB2 激活肥大细胞,引起细胞因子和趋化因子的释放以及免疫细胞的募集,进而参与炎症和疼痛。
近年来,随着对MrgprB2/MrgprX2 研究的深入,发现MrgprB2/MrgprX2 的功能越来越重要,该受体不仅广泛参与机体非IgE 介导的超敏反应、神经源性炎症、疼痛和抽搐等反应,而且能促进皮肤和肠道对有害刺激或病原体入侵的固有免疫反应[39,41~43],因此,该受体很可能成为将来抗炎和镇痛药物研发的潜在靶标。
4. MrgprA3 阳性神经元具有感受疼痛在内的多模感觉编码特性
MrgprA3 是Mrgprs 家族中最早被确认的一种痒觉受体,其能被氯喹激活,诱导小鼠的抓挠行为[44],该受体的发现解释了抗疟疾药物氯喹引起过敏的原因,回答了氯喹产生过敏不良反应的这一长期困惑学界的问题。之后,Han 等[45]通过分子遗传技术,结合成像、电生理和行为学等方法手段,进一步证明MrgprA3 阳性神经元是一类痒觉密切相关神经元,这也是第一次确定在外周神经系统DRG 神经元上存在一类负责痒觉感受的神经元;该类神经元上除了表达MrgprA3 受体以外,还表达与热痛相关的TRPV1 受体,但通过辣椒素诱导该类神经元的TRPV1 受体激活,不是产生痛觉而是产生瘙痒的感觉,且MrgprA3 阳性神经元可被组胺、BAM8-22、氯喹和牛肝菌素等致痒剂激活,如果缺少MrgprA3 阳性神经元的小鼠,其瘙痒行为显著减少,而疼痛行为不受干扰。然而,近期研究则发现,将氯喹和BAM8-22 注射到小鼠后肢,30~45 分钟后,其热痛敏和机械性痛觉敏感性显著增加,TRPA1 通道拮抗剂HC-030031 预处理能显著降低这种痛觉过敏的程度,并缩短氯喹和BAM8-22 引起的疼痛过敏时间[46]。上述两项研究表明,外周神经系统中的MrgprA3 阳性神经元,除了主要扮演感受痒的刺激外,还可能参与除辣椒素以外的其他伤害刺激引起的疼痛。Sharif 等[47]采用光遗传、化学遗传和药理学方法选择性刺激MrgprA3 阳性C 类神经纤维,并观察引起的行为反应,结果发现:激活代谢型Gq相关的DREADD 受体和MrgprA3 受体诱发动物的痒觉行为,而激活离子型相关的ChR2 和P2X3通道则触发疼痛行为,它们分别通过干预脊髓背角内胃泌素受体 (GRPR) 和阿片受体影响动物的瘙痒和疼痛行为;即MrgprA3 阳性神经元传入到脊髓的GRPR 和阿片受体信号通路分别参与瘙痒和疼痛感觉的形成,然而,阻断MrgprA3 阳性神经元上的TRP 通道能缓解瘙痒但不改变疼痛行为;因此,提出MrgprA3 神经元是外周神经系统中一类具有多模感觉编码的神经元,该类神经元上不同受体激活后产生的信号通过各自的传导通路形成痒觉和痛觉。
除上述疼痛相关的Mrgprs 外,MrgprE 还可能参与了神经病理性疼痛的发展,MrgprE 基因敲除小鼠对毒性化学刺激或急性热刺激表现出正常的疼痛反应,但在慢性压迫损伤 (CCI) 后,其机械性痛觉过敏行为显著减轻[48],由于缺乏相应的特异性配体,其确切的分子机制仍不清楚。此外,其他Mrgprs 成员是否参与调节疼痛?目前的数据虽然还不是非常清楚,但可能性非常高。
三、展望
Mrgprs 家族蛋白是一类G 蛋白偶联受体,主要表达在外周神经系统组织中。研究已经表明,Mrgprs 家族蛋白中的一些成员参与了疼痛和瘙痒的产生 (MrgprA3, MrgprB2, MrgprC, MrgprD, MrgprC11 以及人类相关的MrgprX1 和MrgprX2),但大部分成员的功能目前仍不清楚。因此,分析这些蛋白的功能不仅对阐明该家族蛋白的生理作用具有重要意义,而且能拓展我们在疼痛和其他感觉形成领域方面的知识。机体在辨识外周刺激引起反应的过程中,相同刺激引起不同反应和不同刺激引起相同反应的机制仍不清楚,如疼痛和瘙痒是完全不同的两种不愉快的感觉,且可以在同区域皮肤的感受野触发,暗示着皮肤可能已经具备了能够区分这两种感觉的结构和分子,或表达在外周神经末梢上的感受分子在不同刺激下产生兴奋后的神经编码差异决定不同的感觉类型,但这些分子或结构的类型和功能还知道得不多。Mrgprs 家族蛋白作为表达在外周神经系统的功能分子,参与了外周神经系统中DRG神经元对外界刺激引起的神经信息的编码。因此,研究者可以利用Mrgprs 分子标记的工具和各种转基因动物来研究躯体不同感觉(如疼痛和瘙痒)的形成特点,能够加深对疼痛形成机理的认识。
镇痛药物的使用非常广泛,吗啡作为WHO 首推的镇痛药,由于具有成瘾和剂量依赖等不良反应,其临床应用受到限制。目前临床上大约30%药物都以GPCR 受体作为药物靶标或通过调节其相应的信号通路发挥药物作用,这些受体包括阿片受体、环氧合酶等,且它们大多在中枢神经系统、外周神经系统和其他组织中广泛表达,表现出各种不良反应。Mrgprs 作为一类G 蛋白偶联受体,可以作为药物筛选的潜在靶点,同时,Mrgprs 主要表达在外周神经系统并参与疼痛产生和发展,以Mrgprs 受体为靶标开发的药物主要作用于外周,产生的不良反应也较少,因此,可望成为新型镇痛药物开发的理想靶标。
近年来,越来越多的研究者正在从事该家族受体的功能研究和以该家族受体为靶标的药物研发。期望在明确其功能的同时,以 Mrgprs 为靶标的镇痛药物(具有较强的镇痛效果、无或少不良反应)在不久的将来相继问世,造福人类。
