种族差异性药物桥接境外临床研究数据辅助新药审评工作的启示
——以盐酸胍法辛在日本上市为例
2021-03-08陈卫霖吴明如葛卫红中国药科大学南京鼓楼医院南京210008中国药科大学基础医学与临床药学学院南京211198
陈卫霖,吴明如*,葛卫红(1.中国药科大学南京鼓楼医院,南京 210008;2.中国药科大学基础医学与临床药学学院,南京 211198)
2017年中央国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》与2018年国家药品监督管理局组织制定并发布的《接受药品境外临床试验数据的技术指导原则》中指出药品注册申请人应考虑中国药品注册管理要求,在对完整临床试验数据包分析的基础上,对关键临床试验数据进行评价,以确证研究药物的有效性,并且根据人用药物注册技术要求国际协调理事会(ICH)关于接受国外临床试验数据的种族影响因素(E5)要求,需要分析中国亚组与总体人群的一致性,以支持境外临床试验结果外推至中国[1-3]。虽然相关政策文件对接收境外临床试验数据已经有指导性的描述,但是不难看出国家对于境外数据的接受还是非常谨慎的,对于这部分内容尚未有更细化的规定,医药企业在引入境外临床试验数据时有一定的困扰。
在接受境外临床试验数据的问题上,人种差异是最大的门槛。如何考虑种族敏感性,分析和引入药物境外临床试验数据将是未来一段时间内要讨论的热点话题,目前国内尚缺乏这方面的研究报道。本文通过分析日本如何桥接盐酸胍法辛缓释片在美国的临床试验数据,为该药及同类进口药物在中国注册申请时如何考虑种族敏感性,桥接已有境外临床数据,辅助新药审评审批提供参考建议。
1 盐酸胍法辛缓释片在中国、美国、日本的上市信息概述
2017年,卫计委等三部门制定并下发《第二批鼓励研发申报儿童药品清单》,盐酸胍法辛缓释片系该目录品种[4]。该药已在美国、欧盟以及日本等地区上市,作为指南一线推荐用于单药或作为哌醋甲酯等兴奋剂的辅助治疗药物治疗注意缺陷多动障碍(attention deficit hyperactivity disorder,ADHD)[5-6]。盐酸胍法辛尚未国内上市,且上市之路进展较缓慢。根据国家药品监督管理局药品审评中心(CDE)药物临床试验登记与信息公示平台数据显示,截至2020年4月31日,盐酸胍法辛国内临床试验登记信息只有两条,均来自四川百利药业,分别为“胍法辛在健康受试者中的药物代谢动力学研究”和“胍法辛治疗儿童及青少年ADHD 疗效研究”,首次公示时间2017年11月27日,试验尚在进行中。
本研究数据分别从美国食品药品监督管理局(FDA)官网、日本药品医疗器械管理局(PMDA)官网获取盐酸胍法辛缓释片在美国、日本公开的临床试验数据包整理所得[7-9]。2009年,美国Shire 公司开发上市了商品名为INTUNIV®的盐酸胍法辛缓释片,规格有1 mg、2 mg、3 mg、4 mg 四种,适应证为治疗ADHD。2017年,日本盐野义有限公司在日本上市该药,规格为1 mg、3 mg 两种,适应证与INTUNIV®相同。两国在药物规格与用法用量方面存在差异,如表1所示。

表1 盐酸胍法辛缓释片在美国和日本上市信息对比[7-9]Tab 1 Registration of guanfacine HCL sustained-release tablets in the United States and Japan[7-9]
2 盐酸胍法辛缓释片在美国受试者中的部分数据分析
如表2及表3所示,美国公布的该药编号为301、304 两项关于高加索人与其他人种的亚组分析的研究数据显示,部分剂量组与安慰剂相比,该药物在高加索人与其他人种中的疗效可能存在差异。两项研究以ADHD 评分量表(ADHDRS-IV)作为ADHD 临床评估指标。301研究显示:在高加索人中,盐酸胍法辛缓释片4 mg 剂量组与安慰剂组相比,疗效显著提高(P<0.0001);但在其他人种中,4 mg 剂量组与安慰剂组相比,疗效并未提高,差异无统计学意义(P=0.55)。304 研究显示:在高加索人中,盐酸胍法辛缓释片3 mg 剂量组与安慰剂组相比,疗效显著提高(P=0.019),但是在其他人种中,3 mg 剂量组与安慰剂组相比,疗效并未提高,差异无统计学意义(P=0.053)。在其他人群中,1 mg 剂量组与安慰剂相比,疗效显著提高(P=0.008),而高加索人1 mg 剂量组与安慰剂组相比,其疗效并未显著提高,差异无统计学意义(P=0.114)。
分析FDA 公布的盐酸胍法辛在美国完成的临床试验数据可知,该药疗效在不同人种之间存在差异,所以,日本相关企业在进口该药品时是无法直接全部引用其在美国的临床试验数据来进行药物的注册申请,需要增加桥接研究来完成数据的衔接过程。
3 盐酸胍法辛在日本的上市策略
3.1 在日本国内完成1 期成人药代动力学研究
分析该药在日本的临床研究数据包可知,1 期研究中,日本在本国重新开展了“健康成人药代动力学研究”和“健康成人的生物等效性研究”两项研究,其他1 期临床试验的数据皆直接引用境外数据,如表4所示。
在日本开展的 “健康成人药代动力学研究”部分数据如表5所示,美国健康成人口服盐酸胍法辛的药代动力学参数如表6所示,以2 mg 剂量组为例,日本受试者峰浓度Cmax=2.7 ng·mL-1、达峰时间tmax=5 h,美国受试者Cmax=1.59 ng·mL-1、tmax=6 h,日本受试者的吸收速度快于美国受试者;日本受试者血药浓度-时间曲线下面积(AUC)=46.08 ng·h·mL-1,美国受试者AUC=55.0 ng·h·mL-1,日本受试者吸收程度略低于美国受试者;日本受试者的清除速度常数CL/F=45.6 L·h-1,美国受试者的CL/F是40.44 L·h-1,在
日本受试者的代谢速率略快于美国受试者。综上所述,2 mg 盐酸胍法辛的给药方案在日本和美国受试者之间存在明显的药代动力学差异,因此该药临床用法用量需要根据日本人群情况进行重新调整。
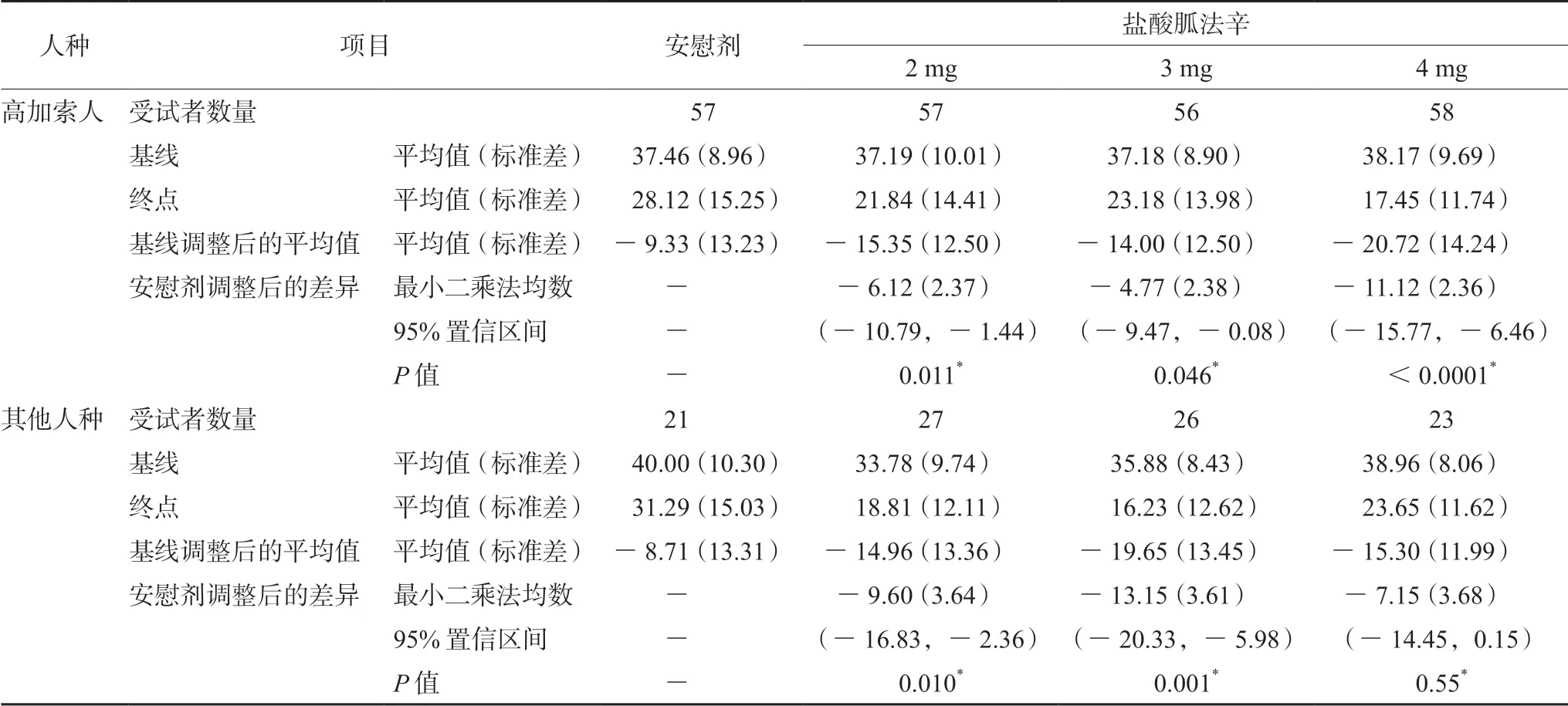
表2 研究301 中按随机剂量和种族分组划分的ADHD-RS-IV 总分[8]Tab 2 ADHD-RS-IV total score by randomized dose and race subgroups in study 301[8]
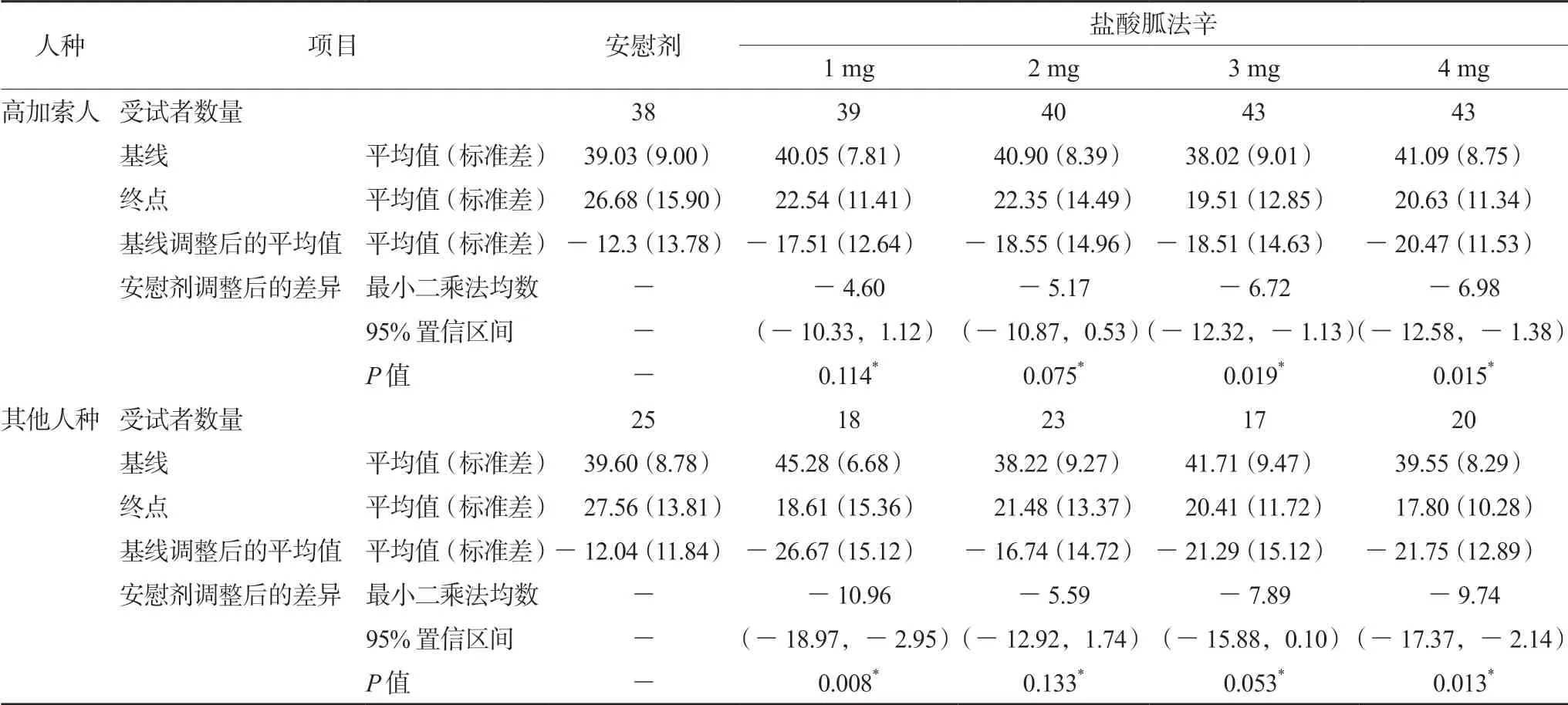
表3 研究304 中按随机剂量和种族分组划分的ADHD-RS-IV 总分[8]Tab 3 ADHD-RS-IV total score by randomized dose and race subgroups in study 304[8]
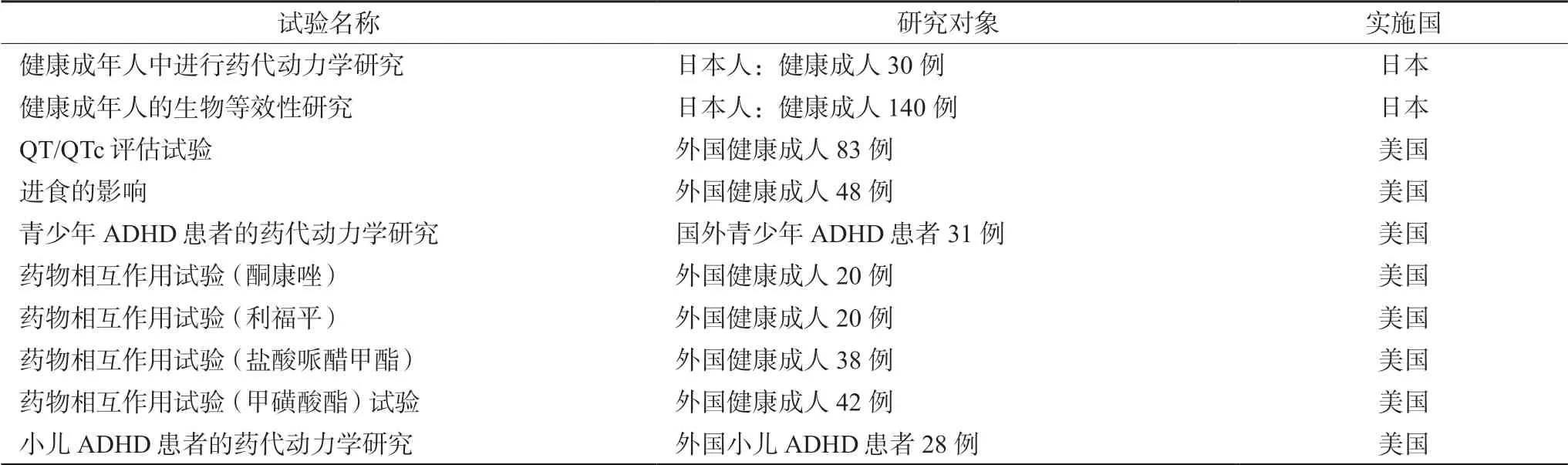
表4 日本盐酸胍法辛缓释片上市儿童ADHD 临床试验概要(1 期)[9]Tab 4 Clinical trial summary of guanfacine hydrochloride sustained-release tablets in children with ADHD in Japan (phase 1)[9]
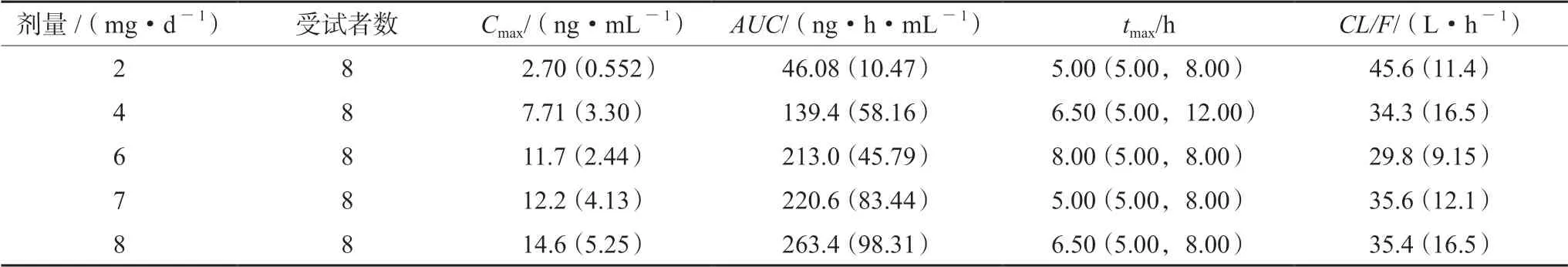
表5 日本健康成人口服盐酸胍法辛药物代谢动力学参数[9]Tab 5 Pharmacokinetic parameter of oral guanfacine hydrochloride in healthy adults in Japan[9]
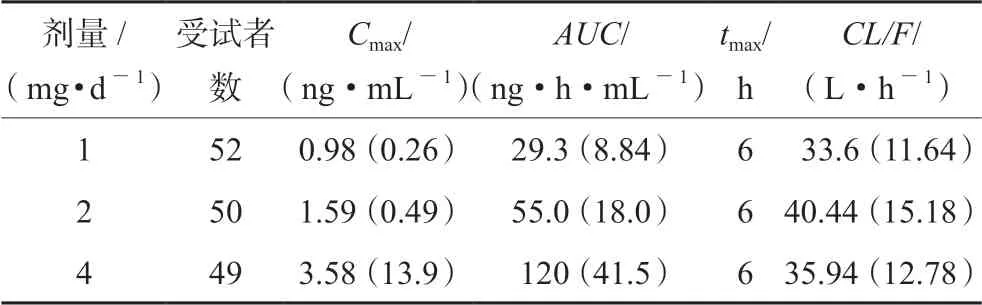
表6 美国健康成人口服盐酸胍法辛的药代动力学参数[8]Tab 6 Pharmacokinetic parameter of oral guanfacine hydrochloride in healthy adults in American [8]
3.2 日本国内完成2/3 期临床试验无缝研究
数据对比发现该药物日本受试者药动学特征与美国受试者药动学特征存在差异,无法直接使用该药物在美国申报上市的2 期与3 期临床试验数据,需要完成适当的桥接试验来进行桥接。为了进一步节省研发时间与成本,日本企业创造性的进行2/3 期临床研究,这部分研究属于无缝临床研究,是适应性临床设计。这样的设计方法可以降低安慰剂/劣效组对受试者的伤害,并节省由于临床试验分期之间重新启动的时间。如表7所示,在2 期研究中,日本企业首先直接桥接了美国“ADHD 儿童的2 期研究”和“在患有ADHD 儿童中使用中枢兴奋剂进行的2 期研究”,然后采用2/3 期无缝设计,通过一个10 周的短期的安慰剂对照的多臂试验,分别比较不同剂量组(0.04、0.08、0.12 mg·kg-1)相对于安慰剂组的优越性,并评估安全性和药代动力学,找到合适安全有效的剂量后直接进行了51 周的长期用药的安全性和有效性评估,其余3 期研究项目均引用美国3 期临床研究,如表8所示。

表7 日本盐酸胍法辛缓释片儿童ADHD 临床试验概要 (2 期、2/3 期研究)[9]Tab 7 Clinical trial summary-2 of Japanese guanfacine hydrochloride sustained-release tablets in children with ADHD (phase 2 and phase 2/3)[9]
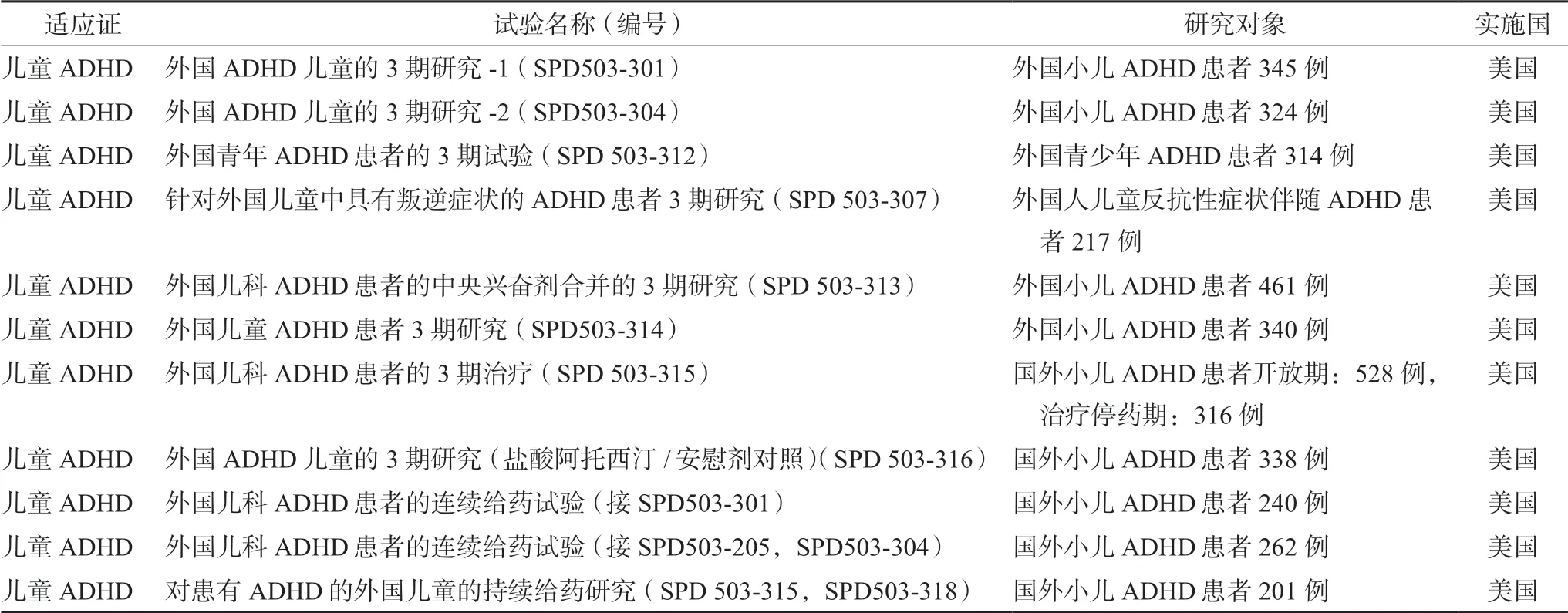
表8 日本盐酸胍发辛缓释片上市时引用美国的3 期研究数据包[9]Tab 8 Data package of American phase 3 study cited during the marketing guanfacine hydrochloride sustained-release tablets in Japan [9]
3.3 在日本国内完成成人临床试验扩大药物应用范围
如表9所示,日本企业研发盐酸胍法辛缓释片除了桥接美国在儿童适应证方面的研究之外,还通过增加成人1 期、3 期临床试验,拓展了盐酸胍法辛缓释片在成人应用的适应证,通过临床研究拓展了盐酸胍法辛缓释片的临床价值。

表9 日本盐酸胍法辛缓释片成人ADHD 临床试验概要(1 期、3 期研究)[9]Tab 9 Clinical trial summary of guanfacine hydrochloride sustained-release tablets in Japanese adults with ADHD (phase 1 and phase 3 studies)[9]
4 盐酸胍法辛缓释片日本上市案例对中国注册部门接受境外数据作为审评证据的启示
4.1 引入境外临床试验数据辅助药品审评的一般原则
在考虑引入境外临床试验数据时,人种差异是最大的门槛,ICH E5 中指出:如果在一个地区获得的临床试验数据符合新地区的证据要求,考虑到两个地区间可能存在内在或外在的种族差异时,可以通过增加一个桥接研究使现有临床数据能够外推至新地区人群[10-11]。在日本,进口药品注册申请时,若国外已有临床资料满足审查要求,制药企业可以提交不含有临床试验资料的新药申请[12],若无法满足审查要求时,日本需要在种族敏感性指导下开展桥接研究来接受境外的临床试验数据,在桥接研究数据符合审查要求后可将国外的临床研究数据外推至日本。在韩国,外国临床数据可以被完全或部分接受,3 期临床试验不强制要求进行桥接试验,当申请文件中资料不足时才会被要求进行附加的桥接研究[13]。我国药审部门在考虑接受境外临床试验数据时,除了追求提高资源利用率与审评效率,还需重点考虑种族差异性问题,从数据的准确性、全面性、真实性、可溯源性、合法性等方面入手,在严谨分析境外临床研究数据的基础上选择全部接受或部分接受,属于部分接受情况的,企业可增加桥接研究来补充数据。
4.2 对种族差异性药物临床试验数据的分析与审查建议
笔者认为,应该分以下两种情况来对境外临床试验数据进行分析与审查:
第一,原研国并非ICH 成员国(美国、欧盟、日本),考虑到ICH E5 未被非成员国的药监部门认可实施,其对药物临床研究的要求与我国相差较大,这类药物在我国注册申请时应该按照药监部门要求重新在我国境内开展药物临床试验。
第二,原研国是ICH 成员国的,应该分以下三步来完成分析与审查:① 从境外完成的临床药物试验中是否可以获得境外中国受试者的药物代谢动力学(pharmacokinetics,PK)、药物效应动力学(pharmacodynamics,PD)与安全性信息,若无境外中国受试者参与或者样本量不足以满足审查需求的,可以考虑在中国境内增加桥接研究来明确药物在中国人群中的PK、PD 特征与安全性;② 若境外的临床试验可以获得符合审查要求的境外中国受试者信息,进一步分析境外中国受试者的PK 与PD 特征是否具有相关性、是否与总体人群保持一致,若出现了显著差异,则说明该药物可能存在种族差异,这种情况下境外的临床研究数据是不能被全部接受的,可通过在中国境内增加桥接研究来部分接受境外的临床试验数据;③ 若境外中国受试者的PK、PD 特征与总体人群保持一致,提示该药物的境外临床试验数据可以证明其纳入研究的给药方案PK、PD 特征以及安全性在中国人群与总体人群中保持一致,可以考虑全部接受境外临床研究数据,若药物具有非线性的PK 特征、窄治疗窗等特征,即使境外中国受试者数据可以证明其与总体人群具有一致性,也要谨慎对待,仍然要在中国境内开展桥接研究。
4.3 设计桥接研究的考量点
当境外的临床试验数据无法满足审查要求时,可考虑增加桥接研究来部分引入境外的临床试验数据,桥接研究主要目的是回答药物种族敏感性问题,所以桥接研究的设计与执行都应该在种族敏感性指导下开展。桥接研究可分为1 期PK 比较研究及2/3 期有效性研究。1 期 PK 比较研究需要在中国境内采取与境外临床研究相同的给药方案,分别在单次给药与多次给药条件下开展研究,将研究结果与境外临床研究数据结果进行对比,若结果提示中国受试者的PK 特征与总体人群具有一致性,则在同样的给药方案下开展2/3 期的临床确证试验,完成后方可在中国进行药品评审工作。若1 期PK 比较研究显示中国人群与总体人群存在差异,则需要根据研究结果重新调整给药方案,然后开展调整后的给药方案在中国人群中的2/3 期临床确证试验。
