缺氧诱导因子-1α和血管内皮生长因子与非小细胞肺癌中临床病理特征和预后关系的研究
2021-03-08路璐潘峰赵成孙志钢张楠
路璐 潘峰 赵成 孙志钢 张楠
目前,肺癌的发病率和死亡率在全球范围内居于首位,也是肿瘤相关性死亡的主要原因。其中非小细胞肺癌(NSCLC)约占所有肺癌的80%以上[1]。由于当前肿瘤TNM分期系统[2]缺乏足够的预测价值,我们可以结合一些生物标志物来预测患者的生存率。缺氧诱导因子-1α (HIF-1α)是HIF-1基因家族的成员之一,在缺氧条件下高表达,在常氧条件下降解[3]。HIF-1α可直接调控血管内皮生长因子(VEGF)[4]和一氧化氮合酶(NOS)[5]等基因。VEGF在血管生成中发挥核心作用,促进内皮细胞增殖、迁移和侵袭,且在不同肿瘤中都有过表达[6],并可以靶向识别肿瘤细胞并促进肿瘤的生长和转移[7-8]。本研究旨在探讨HIF-1α和VEGF的表达与NSCLC患者的临床病理特征及预后的关系,并进一步验证二者表达调控的上下游关系。
资料和方法
一、一般资料
本研究共纳入2009年1月至2012年12月在山东第一医科大学附属中心医院胸肺外科进行肺癌切除手术的79例患者。纳入标准为:1)接受根治性手术并经病理证实为鳞癌或腺癌;2)诊断为I-IIIa期非小细胞肺癌;3)无明显手术禁忌症。大细胞癌和腺鳞癌因样本太少被排除在外。表1显示了患者的临床病理特征。本研究由山东第一医科大学附属中心医院伦理委员会审核批准。
二、免疫组织化学法
所有非小细胞肺癌标本均取自79例患者,以邻近非肿瘤肺组织作为对照组织。组织标本固定在10%中性福尔马林缓冲液中做常规处理。将石蜡包埋组织标本切成4 μm厚的切片,用链霉亲和素-过氧化物酶(SP)法[9]检测组织标本中HIF-1α和VEGF的表达。简言之,标本切片与兔抗人HIF-1α单克隆抗体(浓度1 ∶100,购自武汉博士德生物工程有限公司。抗体编号:PB0245)或兔抗人VEGF单克隆抗体(浓度1 ∶100,购自武汉博士德生物工程有限公司。抗体编号:BA0407)在4°C培养过夜,根据厂家说明用山羊抗兔IgG抗体(浓度1 ∶100,购自武汉博士德生物工程有限公司。抗体编号:BA1003)制备二抗。用半定量免疫反应评分系统(IRS)测量HIF-1α和VEGF的表达水平[9-10]。将标本分为阴性表达(IRS0~2)和阳性表达(IRS3~6)。
三、细胞培养
人非小细胞肺癌细胞系A549和H1299从美国组织培养物保藏中心(ATCC)和中科院上海细胞生物学研究所获得。细胞在含10%胎牛血清的DMEM培养基中,置于37℃,5% CO2培养箱中培养。在细胞融合至约80%时,除去培养液,PBS液漂洗3次。细胞分为3组,1组细胞加入含500 μmol/L CoCl2的DMEM 2 mL,2组加入含500 μmol/LCoCl2和200 μg/mL HIF-1α抑制剂LW6(美国Millipore公司)的DMEM混合液2 mL,3组加入含500 μmol/L CoCl2和200 μg/mL抗VEGF药物贝伐单抗(Avastin)(购自美国Roche公司)的DMEM混合液2 mL,均置于37℃,5% CO2培养箱中培养24 h。
四、Western blotting
将细胞置于冰上,加RIPA裂解液(加蛋白酶抑制剂)裂解提取蛋白,BCA法测定浓度,95℃加热5 min。垂直电泳槽内每孔内加入约20 μL蛋白,聚丙烯酰胺凝胶电泳分离蛋白样品,转膜至PVDF膜,5%脱脂奶粉封闭1 h,一抗4℃孵育过夜,TBST洗3次,每次10 min,二抗室温孵育1 h,洗膜后加ECL显影,Image J软件扫描灰度值,GAPDH为内参对照。
五、统计分析
使用SPSS 13.0分析所有统计数据。计数资料的组间比较采用χ2检验或Fisher精确概率法。HIF-1α和VEGF表达的相关性采用Spearman 等级相关分析。采用Kaplan-Meier绘制生存曲线。采用对数秩检验比较存活率,Cox多因素回归分析判定预后的独立危险因素。P<0.05被认为差异有统计学意义。
结 果
一、HIF-1α和VEGF的免疫组化表达情况及二者与临床病理特征的关系
HIF-1α阳性表达主要位于胞浆和胞核中(图1)。HIF-1α阳性表达率为65.8%(52/79)。表1显示,HIF-1α的表达与肿瘤分化程度(高41.7%vs中64.0%vs低88.2%;P<0.05)、病理淋巴结(pN(-)46.4%vspN(+) 74.5%;P<0.05)和pTNM分期(pI 47.4%vspII 62.8%vspIIIa 94.1%;P<0.05)显著相关。
VEGF阳性表达主要位于胞浆中(图2)。VEGF阳性表达率为64.6% (51/79)。表1显示VEGF表达与pT (T135.7%vsT269.1%vsT3 80.0%;P<0.05)、病理淋巴结(pN(-)42.9%vspN(+)76.5%;P<0.01)和pTNM分期(pI 36.8%vspII 67.4%vspIIIa 88.2%;P<0.05)显著相关。
Spearman 等级相关分析显示HIF-1α表达与VEGF表达呈正相关(P<0.01)。49.4% (39/79)的病例呈HIF-1α和VEGF双阳性表达。且与pT (T121.4%vsT250.9%vsT380.0%;P<0.05)、病理淋巴结(pN(-)17.9%vspN(+)66.7%;P<0.01)和pTNM分期(pI 15.8%vspII 48.8%vspIIIa 88.2%;P<0.01)显著相关(表1)。
二、影响5年生存率的因素分析
本组79例非小细胞肺癌患者的5年生存率为40.5%。应用对数秩检验进行单因素分析显示,分化程度(P<0.05)、pN(P<0.01)、pTNM分期(P<0.01)、HIF-1α表达(P<0.01)、VEGF表达(P<0.01)以及HIF-1α和VEGF双重表达(P<0.01)与5年生存率显著相关(图3,表2)。COX多因素回归分析显示,分化程度、pN以及HIF-1α和VEGF双重表达是影响5年生存率的独立因素(表3)。
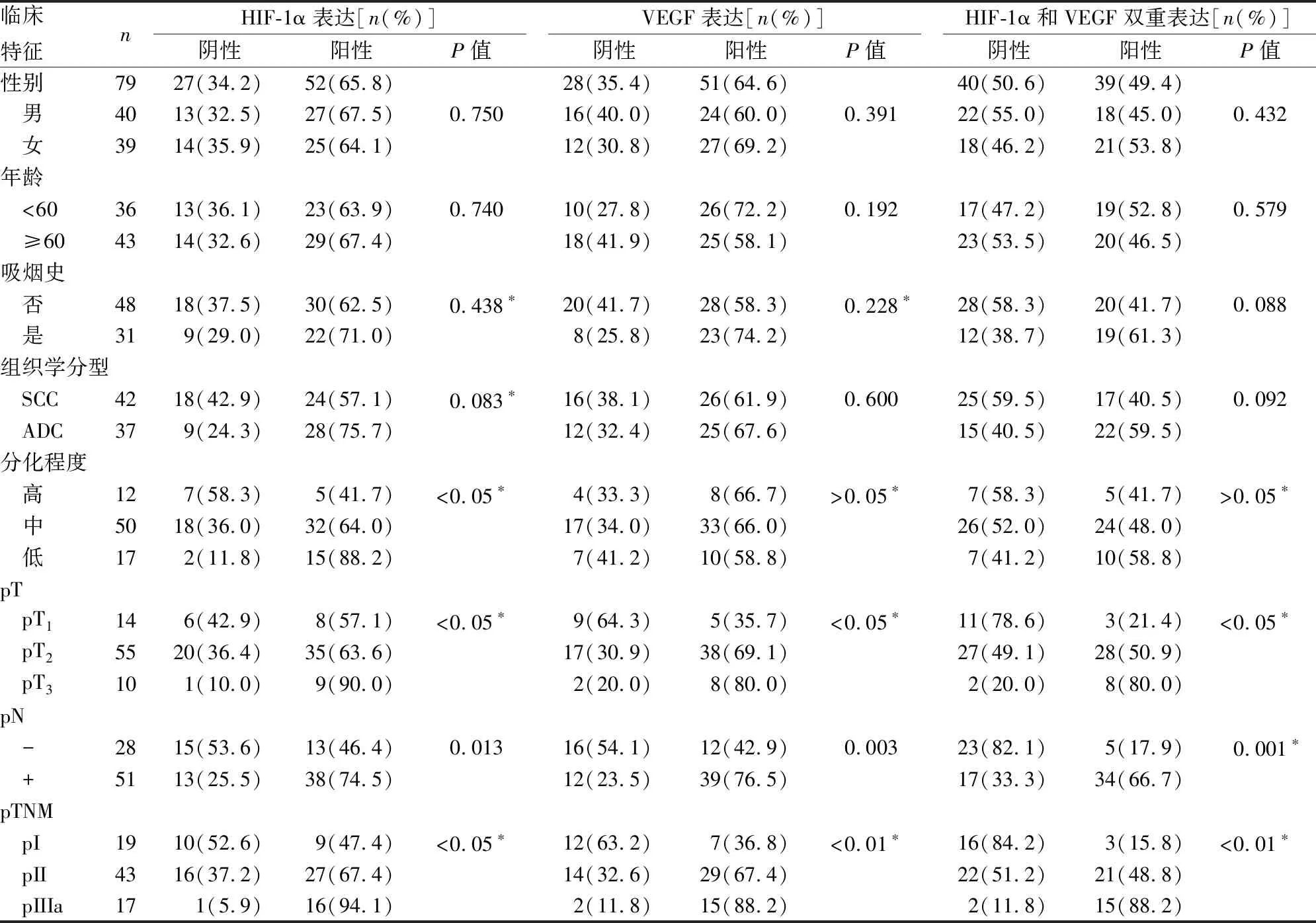
表1 HIF-1α和VEGF表达与非小细胞肺癌临床病理特征的关系
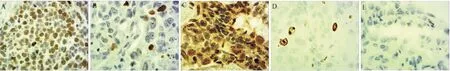
图1 肺癌组织切片免疫组织化学染色,显示缺氧诱导因子-1α(原始放大倍数×400)
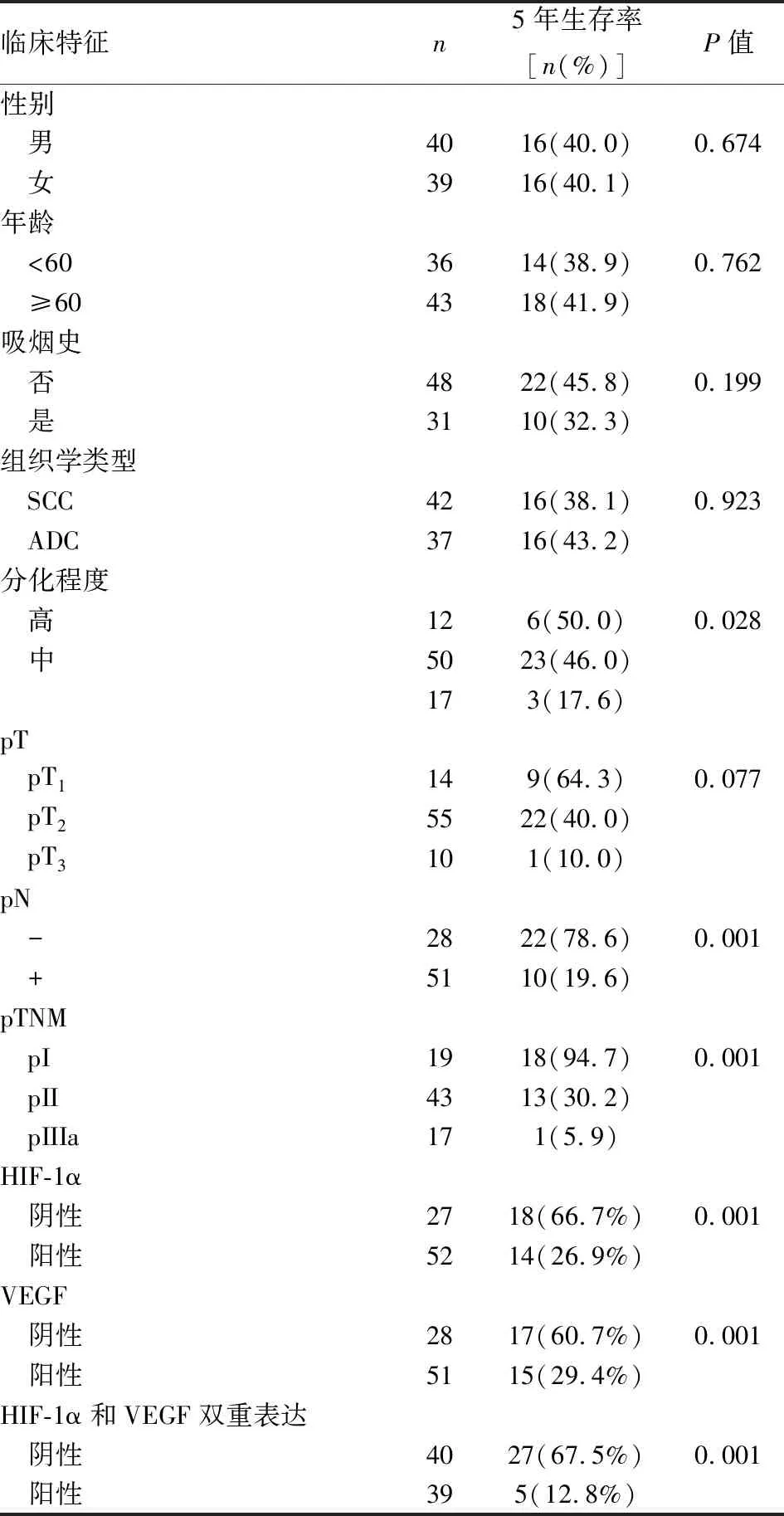
表2 影响非小细胞肺癌患者5年生存率的单因素分析
三、LW6和Avastin对HIF-1α和VEGF表达的影响
在非小细胞肺癌细胞系A549和H1299中,用氯化钴(CoCl2)处理细胞,诱导化学缺氧环境(1组),用HIF-1α抑制剂LW6同时处理细胞(2组),用VEGF抑制剂Avastin 同时处理细胞(3组),可以看到:CoCl2诱导化学缺氧诱导HIF-1α的表达,而LW6处理(2组)可以显著抑制HIF-1α的表达 (P<0.01),同时VEGF的表达与1组相比也显著下降。但Avastin 处理组(3组)与1组(缺氧组)相比无显著性差异(P>0.05),表明LW6作为HIF-1α抑制剂,除了可以抑制HIF-1α的表达,也能抑制VEGF的表达。而Avastin作为VEGF的抑制剂,也下调VEGF的蛋白水平,但对HIF-1α的表达也没有明显的影响(图4)。
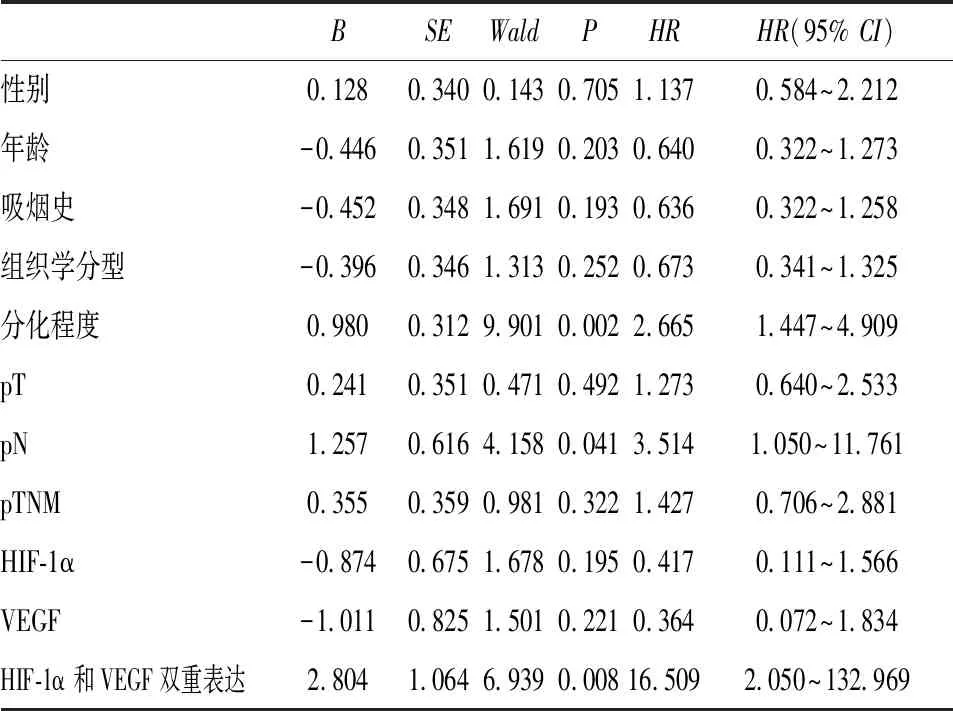
表3 非小细胞肺癌患者5年生存率的Cox回归多因素分析

图2 肺癌组织切片免疫组化染色显示VEGF(原始放大倍数×400)
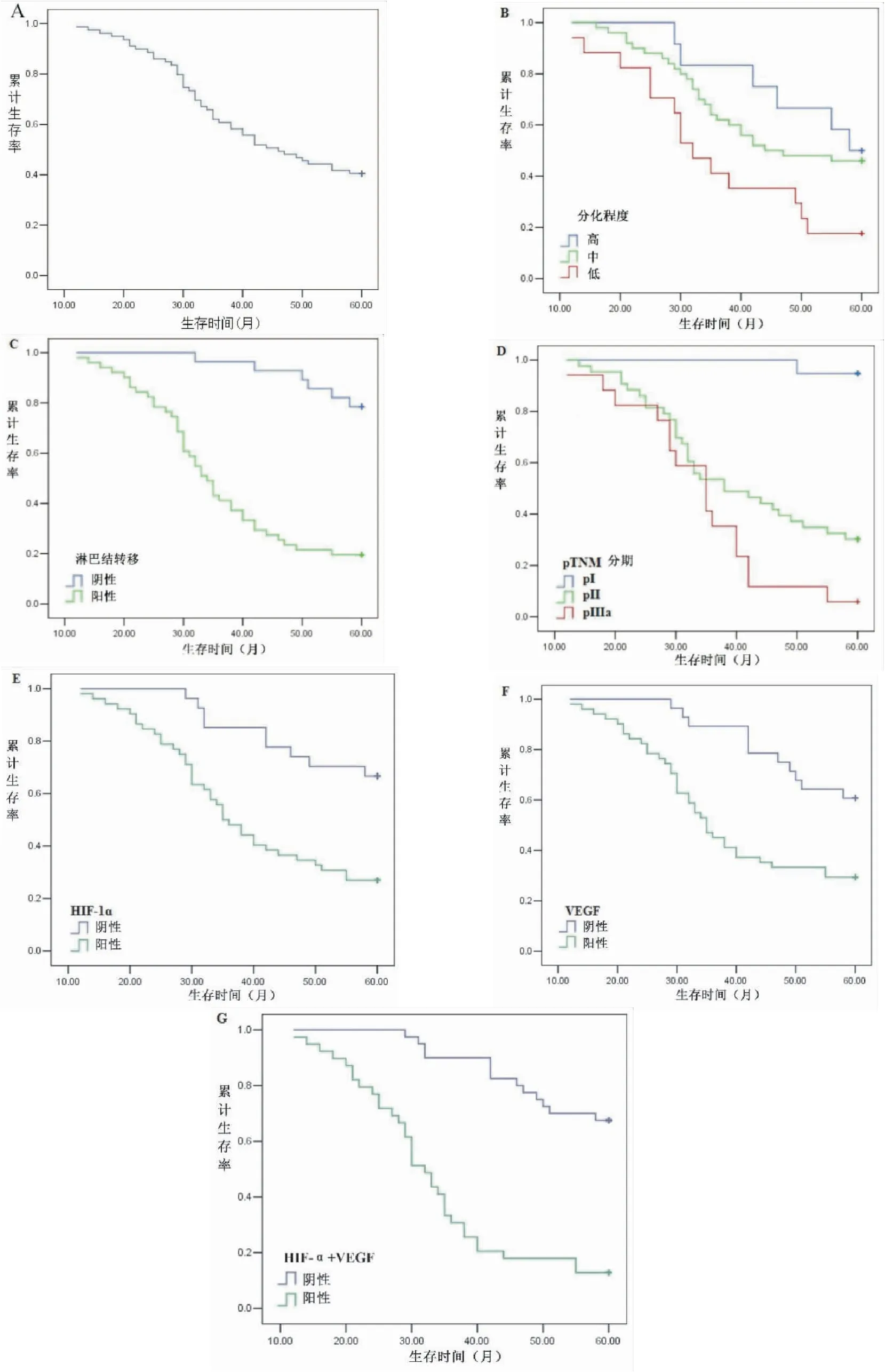
图3 A:Kaplan-Meier分析术后总生存率;B:根据分化程度用 Kaplan-Meier分析术后患者的总生存率;C:根据pN(-) 和 pN(+)用 Kaplan-Meier分析术后患者的总生存率;D:根据TNM分期用 Kaplan-Meier分析术后患者的总生存率;E:根据HIF-1α表达用 Kaplan-Meier分析术后患者的总生存率;F:根据VEGF表达用 Kaplan-Meier分析术后患者的总生存率;G:根据HIF-1α和VEGF双重表达用 Kaplan-Meier分析术后患者的总生存率

图4 Western blot检测显示HIF-1α和VEGF的表达
讨 论
自1999年发现了HIF-1α在肿瘤组织中高表达后[11],越来越多的研究报道了HIF-1α的表达与肿瘤的临床病理特征和预后的关系。免疫组织化学对HIF-1α表达的评估在多种类型的癌症中得到了广泛的应用[12-13]。在以前的研究中,免疫组织化学显示,40%到80%的癌症患者的细胞核和细胞质中都有HIF-1α蛋白的表达[14]。然而,不同的研究表明,不同临床特征的肺癌组织中HIF-1α的表达趋势不同。肺癌患者HIF-1α的表达和预后存有争议[15]。Yang[16]等人通过meta分析总结了17项试验,发现肺癌患者HIF-1α的高表达与肿瘤分期、淋巴结转移、组织学、分化和低生存率有关。在目前的研究中,65.8%的非小细胞肺癌组织HIF-1α表达与肿瘤分化程度(高41.7% vs中64.0% vs低88.2%;P<0.05)、病理淋巴结(pN(-)46.4%vspN(+)74.5%;P<0.05)和pTNM分期(pI 47.4%vspII 62.8%vspIIIa 94.1%;P<0.05)有关。本研究结果显示非小细胞肺癌患者的5年生存率为40.5%,HIF-1α阳性表达组的5年生存率明显低于HIF-1α阴性表达组(P<0.01)。我们的研究结果符合先前提出的结论,表明HIF-1α在非小细胞肺癌中起着重要的临床病理作用。
研究表明,HIF-1α可以调控至少60个下游靶基因,包括VEGF[17]。作为最有效的血管生成因子之一,VEGF可介导内皮细胞增殖,增强血管通透性[18]。许多研究报道VEGF在非小细胞肺癌中高表达,这已成为肺癌治疗的重要靶点[6,19]。本研究采用免疫组织化学方法观察了VEGF在非小细胞肺癌组织中的表达,结果显示64.6%的非小细胞肺癌组织中有VEGF的表达。VEGF在肿瘤组织中的表达与pT (T135.7%vsT269.1%vsT380.0%;P<0.05)、病理淋巴结(pN(-)42.9%vspN(+)76.5%;P<0.01)和pTNM分期(pI 36.8%vspII 67.4%vspIIIa 88.2%;P<0.05)显著相关。VEGF阳性表达组的5年生存率明显低于VEGF阴性表达组(P<0.01)。我们的结果表明VEGF的表达促进了非小细胞肺癌的侵袭和转移。
以往的报道大多是单独研究HIF-1α或VEGF的表达,很少将它们结合起来研究[20-21]。Karetsi[22]等人采用免疫组织化学方法检测55例肺癌组织中HIF-1α和VEGF的表达。他们发现仅在肺腺癌中,T分期与HIF-1α和VEGF的表达呈显著正相关。并且HIF-1α和VEGF的表达与总生存期之间没有明显的相关性。有研究发现,VEGFR2是VEGF的特异性受体,两者结合后通过一系列生物调控诱发血管内皮细胞增值,促进肿瘤血管生长。在肿瘤血管生成过程中,HIF-α/VEGF/VEGFR2通路在肿瘤血管生成中起重要作用[23]。如上所述,VEGF是HIF-α的靶基因,上调HIF-α的表达可促进肿瘤新生血管的增殖。在本研究中,癌组织中HIF-1α的表达与VEGF的表达呈正相关(P<0.01)。49.4%的病例HIF-1α和VEGF呈双阳性表达,与pT、病理淋巴结和pTNM分期显著相关。瘤体较大组的HIF-1α和VEGF双阳性表达明显高于瘤体较小组(T121.4%vsT250.9%vsT380.0%;P<0.05)。有淋巴结转移组(66.7%)的HIF-1α和VEGF双阳性表达明显高于无淋巴结转移组(17.9%;P<0.01)。另外,局部晚期组的HIF-1α和VEGF双阳性表达明显高于早期组(pI 15.8%vspII 48.8%vspIIIa 88.2%;P<0.01)。在对数秩检验的单因素分析显示,HIF-1α和VEGF双阳性表达组的5年生存率显著低于阴性表达组(P<0.01)。为排除混合因素对统计分析的影响,采用多因素分析确定预后因素,结果显示分化程度、pN以及HIF-1α和VEGF双重表达是影响5年生存率的独立因素,是预后不良的相关独立因素。我们的数据表明,在非小细胞肺癌患者中,HIF-1α和VEGF的双阳性表达与转移潜能和低生存率有关。
我们进一步研究了HIF-1α抑制剂LW6和抗VEGF药物Avastin对非小细胞肺癌细胞A549和H1299中HIF-1α和VEGF的影响,我们结果表明LW6可以抑制HIF-1α的表达,Avastin对HIF-1α的表达没有明显的影响;LW6和Avastin均可以抑制VEGF的表达。结果进一步证明了在非小细胞肺癌中,VEGF的表达受到来自HIF-1α的调控,针对HIF-1α的抑制剂或其他干预手段可以同时抑制VEGF的表达及活性。
综上所述,联合检测HIF-1α和VEGF可更准确地预测非小细胞肺癌患者的预后。而开发针对HIF-1α干预手段可能成为治疗非小细胞肺癌患者的更有意义的研究方向,因为其可以同时抑制VEGF引起的血管形成,当然这还需要进一步的基础和临床研究。
