治疗人类免疫缺陷病毒Ⅰ型多重耐药性新药福替沙韦缓释片(fostemsavir extended-release tablets)
——
2021-03-08陈本川
陈本川
(湖北省医药工业研究院有限公司,武汉 430061)

1 非临床药理毒理学
1.1致畸、致突变 分别对大鼠和转基因小鼠进行为期2年及26周的FTR致癌性研究,雄鼠喂饲的剂量是人用最大推荐临床日剂量(maximum recommended human dose,MRHD)的5倍,雌鼠是MRHD的16倍。与对照组比较,FTR肿瘤发生率差异无统计学意义。FTR无基因毒性,体外沙门菌和大肠埃希菌反向突变Ames试验、人淋巴细胞染色体畸变试验和大鼠骨髓微核试验均为阴性[4,6]。
1.2对生殖能力的影响 雌雄大鼠分别喂饲FTR10倍及186倍MRHD,对生殖力无不良影响;给雄大鼠喂饲FTR>80倍MRHD时,观察到大鼠前列腺和精囊质量减轻,精子密度及活动能力下降,异常精子增多。在动物生殖研究中,孕大鼠和孕兔在器官形成期喂饲FTR,不引起临床相关的TMR接触量对妊娠动物发育的不利影响。雌大鼠于妊娠第6 ~ 15天和雌兔于妊娠第7 ~ 19天,分别喂饲FTR 50,200和600 mg·kg-1·d-1和FTR 25,50和100 mg·kg-1·d-1,孕大鼠和孕兔最大剂量组代谢物TMR的接触量分别相当于MRHD的180倍和30倍,未观察到胎仔发育异常。孕兔观察到与母体毒性相关的胚胎死亡增加,其TMR的接触量是60倍MRHD。另一项研究中,孕大鼠喂饲的剂量,其TMR接触量是200倍MRHD,胎仔出现上颚、睁眼、口鼻缩短、微裂、口和颚错位,舌头突出,以及胎仔体质量下降。对大鼠出生前和产后发育的研究,从妊娠第6天到哺乳第20天,喂饲FTR 10,50或300 mg·kg-1·d-1,在无其他不利的胎仔或新生幼崽影响的情况下,接触量约为MRHD的130倍,观察到母体的TMR接触量使新生幼崽出生后7~14 d存活率降低;母体TMR接触量约为MRHD的35倍,未观察到胎仔或新生幼崽有不良影响。在妊娠大鼠的分布研究,与FTR相关的物质,如TMR和(或)TMR代谢物能穿过胎盘,在胎仔组织中也可检测到[4,6]。
2 临床药理毒理学

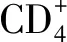
2.2.1在细胞培养内的抗HIV-1活性 TMR对3株HIV-1B亚型化学趋化因子CCR5嗜性受体实验株有抗病毒活性,50%有效浓度(EC50)在0.4~1.7 nmol·L-1之间;对2株化学趋化因子CXCR45嗜性受体实验株的抗病毒敏感性范围较宽,EC50分别为0.7和2.2 nmol·L-1;另外3株EC50分别为14.8,16.2 nmol·L-1和>2 000 nmol·L-1;TMR对HIV-1 B亚型的临床分离株化学趋化因子CCR5-嗜性受体病毒株、CXCR4-嗜性受体病毒株和双重或混合嗜性受体病毒株的中位EC50分别为3.7 nmol·L-1(n=9),范围0.3~345 nmol·L-1、40.9 nmol·L-1(n=4),范围(0.6~>2 000)和0.8 nmol·L-1(n=2),范围0.3~1.3 nmol·L-1。显示TMR对不同趋化因子嗜性受体病毒株的EC50有较宽的范围。从FTR临床试验研究所获得的1 337株样品进行分析,包括HIV-1B亚型881株、C亚型156株、A亚型43株、A1亚型17株、F1亚型48株、BF1亚型29株、BF亚型19株、CRF01_AE亚型5株和其他亚型139株,TMR对抑制不同亚型病毒株敏感性活性有很大差异,EC50从0.018~>5 000 nmol·L-1。主要B亚型分离株,740/881株(84.0%)的EC50<10 nmol·L-1,53株(6.0%)的EC50>100 nmol·L-1。检测所有亚型分离株,有79株(9.0%)的EC50>100 nmol·L-1,BF、F1和BF1亚型分离株的EC50>100 nmol·L-1有较高的比例,为21%~38%。AE亚型全部5株分离株,EC50>100 nmol·L-1。从另外一组非B亚型的HIV-1临床分离株,所有HIV-1亚型(AE;3/3)、O组(2/2)和HIV-2(1/1)分离株,及一些HIV-1D亚型(1/4)和G亚型(1/3)的分离株,TMR的 EC50值均大于测试浓度的上限(>1 800 nmol·L-1)[4,6]。
2.2.2有效组分替米沙韦对HIV-1AE亚型病毒株的活性降低 从外周血单核细胞(PBMC)检测试验和美国Monogram公司开发的测定病毒表型的PhenoSense®入胞检测试验得到14株AE或E亚型分离株,TMR对其抗病毒活性的敏感性固有地低下。AE亚型病毒基因分型鉴定显示其gp120中S375H和M475I位点有氨基酸取代多态性,这与TMR固有的敏感性降低密切相关。HIV基因AE亚型是东南亚地区流行的主要HIV亚型,在世界其他地区并未较高频率出现。临床试验随机分组时,有2例受试者为AE亚型HIV-1。第1例,基线gp120有S375H和M475I氨基酸取代,EC50>4 747倍,经FTR缓释片治疗至第8天,无应答。第2例,EC50有298倍变化,gp120基线有S375N取代。在功能性单药治疗期间接受安慰药治疗。这2病例接受多替拉韦(dolutegravir,DTG)片与FTR缓释片联用(OBT)治疗96周,病毒复制受到抑制[4,6]。


2.2.5HIV-1基因型治疗第8天的应答率 评估gp120耐药相关多态性在第8天对FTR缓释片功能性单药治疗的应答影响,审核47例受试者在筛查时基线HIV-1 RNA >0.4 log10或<400拷贝·mL-1,gp120 RAPs关键位置S375、M426、M434或M475与这些部位无取代的受试者比较,HIV-1 RNA总体下降较低,HIV-1 RNA下降>0.5 log10的受试者较少,而gp120 RAPs的存在并不妨碍某些携带S375M,M426L和M475V氨基酸取代受试者在第8天达到>0.5 log10拷贝·mL-1的应答率。对于超过一个位点的gp120耐药相关多态性受试者,其应答率和病毒载量下降中位数无差异。FTR缓释片对囊膜gp120氨基酸多态性功能性单药治疗第8天应答率的影响,可评价的病例数,A组(n=151),HIV-1 RNA载量下降>0.5 log10;B组(n=151),从基线至第8天病毒载量Log10下降中位数。总病例数分别为107/151例(70.9%)和1.05 log10。无定位点gp120的RAP为70/83例(84.3%)和1.11log10。定位点的gp120 RAP为S375I/M/N/T、M426L、M434I或M475I/V为37/68例(54.4%)和0.66 log10;S375M为1/5例(20.0%)和0.32 log10;M426L为6/17例(35.3%)和0.19 log10;M434I为3/6例(50.0%)和0.66 log10;M475V为0/1例(0%)和0%;1个位点的gp120 RAP为38/62例(61.3%)和1.03 log10;2或3个位点的gp120 RAPs为18/26例(69.2%)和1.09 log10[4,6]。
2.2.6HIV-1基因表型治疗第8天应答率 FTR对受试者在筛查时所获得的病毒分离株,对TMR敏感性倍数变化值较大,范围在0.06~6.651。在处理后的分析,评估筛选FTRT表型对第8天>0.5log10下降的应答影响,大多数受试者,83/151例(55.0%)筛查TMR的EC50倍增变化归一化为<2倍的参考病毒。对表型<2的FTR应答率为66/83例(79.5%)。>2~200的FTR表型倍增应答率适度降低至29/42例 (69.0%)。>200表型倍增改变导致对FTR的应答率下降,5/17例(29.4%)。5例受试者,尽管使FTR的易感性降低>200倍,并进行gp120 RAPs筛选,在第8天,HIV-1 RNA的log10下降>1.0。对背景药物缺乏耐药性或较高的FTR浓度不能解释这5例受试者的>1 log10的应答率。将治疗HIV-1基因表型受试者(n=151)于第8天经处理后应答率下降>0.5 log10,倍增变化率的结果列举如下:无应答9例(7.0%)、0~2倍66/83例(79.5%)、>2~10倍17/25例(68.0%)、10~200倍,范围(11~104)倍,12/17例(70.6%)和>200倍,范围(234~6651)倍,5/17例(29.4%)[4,6]。
2.2.7临床试验受试者的耐药性 临床试验随机分组,经96周治疗,69/272例(25.4%)病毒学失败,其中包括51/203例(25.1%)接受盲性FTR缓释片单药功能性治疗及18/69例(26.1%)在为期8 d的双盲试验期间,接受安慰药盲性治疗。受试者在4个关键位点(S375,M426,M434和M475)具有gp120基因型替代。在氨基酸375,426,434或475位点有取代的病毒学失败受试者,可评价的分离株(n=26),TMR EC50中位倍增数为1 755倍,而上述位点未被取代的病毒学失败受试者的分离株(n=27),EC50中位倍增数为3.6倍。在随机分组试验中,多替拉韦(DTG)片与FTR缓释片联用组(OBT),有21/69例(30.4%)病毒学失败,至少有一种药物对HIV-1基因型或基因表型耐药,OBT联用组有31/64例(48.4%)病毒学失败,基线后数据表明,至少有一种药物突发性产生耐药性。在非随机分组中,病毒学失败率较高,为50/99例(50.5%),尽管在随机和非随机分组时,gp120 RAPs筛查的病毒学失败比例相似,但随机分组受试者出现在gp120耐药相关替代的病毒学失败比例比非随机受试者更高。TMR在随机分组受试者病毒学失败后,从375,426,434或475位点分离到氨基酸取代的受试者耐药株(n=33),中位EC50倍增变化为4 216倍,无耐药取代的病毒学失败的分离株(n=12)中位EC50倍增变化为767倍,与非随机组一致,ARV药治疗选择较少数受试者,病毒学失败为45/50例(90.0%),联用OBT组至少有一种药物对HIV-1基因型或表型耐药,筛查时,有27/49例(55.1%)病毒学失败受试者的基线后的数据表明,非随机分组时,OBT组至少一种药物显示耐药性。对临床试验受试者出现耐药性进行汇总分析。临床试验受试者出现耐药性列举如下:A组为随机分组的病例数(n=272),B组为非随机分组的病例数(n=99),治疗病毒性失败分别为69例(25.4%)和50例(50.5%);筛查是带有gp120 氨基酸多态性(RAPs)为42/68例(61.8%)和26/48例(54.2%)。病毒学失败的基线后数据为53例和45例;突现gp120 RAS为27例(50.9%)和33例(73.3%);S375N取代为18例(34.0%)和21例(46.7%);M426L/I取代为17例(32.1%)和23例(51.1%);M434I/L取代为5例(9.4%)和5例(11.1%);M475I/L/V取代为8例(15.1%)和5例(11.1%)[4,6]。

2.2.9心脏电生理学 服FTR缓释片临床治疗剂量,QT间期延长无任何临床意义。服4倍推荐剂量时,QTcF间期均值延长11.2 ms,90%置信区间上限增加13.3 ms,QTcF增加与TMR的浓度相关[4,6]。
2.3药动学 FTR是活性组分TMR的前药。口服FTR缓释片后,血浆一般检测不到FTR。而TMR的吸收迅速。在>600~1 800 mg剂量范围内,口服给药后,TMR血浆药物浓度峰值(Cmax)和血浆药物浓度-时间曲线下面积(AUCtau)与剂量略大于呈正相关。健康受试者与HIV-1感染者服FTR缓释片后,药动学参数相似[4,6]。
2.3.1吸收 单次口服FTR缓释片600 mg,其后单次静脉滴注13C-TMR 100 μg,绝对生物利用度为26.9%。口服给药,达到血浆药物浓度峰值(Cmax)的时间(tmax)为2.0 h。进食标准餐时服药,约1 768.1 J(1.0 J=0.24 cal),36%来自脂肪,47%来自碳水化合物,17%来自蛋白质。与空腹时服药比较,AUC几何均值比为1.10,90%CI=(0.95,1.26);进食高脂餐时服药,约4 117.3 J,60%来自脂肪,28%来自碳水化合物,12%来自蛋白质。与空腹时服药比较,AUC几何均值比为1.81,90%CI=(1.54,2.12)[4,6]。
2.3.2分布 主要与人血清白蛋白结合,结合率为88.4 %。血与血浆的比值为0.74,静脉注射给药,在稳态时分布容积(Vss)为29.5 L[4,6]。
2.3.3消除 主要消除途径是通过代谢,清除率CL为17.9 L·h-1,表观清除率(CL/F)为66.4 L·h-1,半衰期(t1/2)为11 h[4,6]。
2.3.4代谢 口服FTR缓释片后主要代谢途径有36.1%通过水解酶或酯解酶断裂TMR的酯基键,21.2%被CYP3A4酶氧化,<1%被尿苷二磷酸葡萄糖醛酸转移酶(uridine diphosphate glucuronosyl transferases,UGT)代谢。体外试验研究显示,TMR生物转化成循环中2个无活性的主要代谢物,BMS-646915是水解代谢物,而N-脱烷基代谢物BMS-930644是氧化的代谢物[4,6]。
2.3.5排泄 根据剂量的质量平衡研究的原理:单剂量口服用14C的FTR口服溶液300 mg,含100 μCi(居里),相当于3.7兆贝可(MBq)的总放射性活度,从尿排泄总放射性与变异系数(coefficient of variation,CV)为51 (<2) %的原形药,从粪便排泄总放射性与CV为33(1.1) %的原形药[4,6]。
2.3.6多次服药后TMR药动学 受试者系经历过大量治疗的成人HIV-1感染者,口服FTR缓释片600 mg,每天2次,联用其他ARV药,是否进餐时服药均可。Cmax与CV为1 770 (39.9) ng·mL-1,AUCtau与CV为12 900 (46.4) ng·h·mL-1。Ctrough或C12h与CV为478 (81.5) ng·mL-1[4,6]。
2.3.7特殊人群药动学 年龄、性别和种族对TMR的药动学无临床意义差别。尚不清楚与乙肝病毒和(或)丙肝病毒共感染对TMR药动学的影响。TMR尚未在儿科受试者进行药动学研究,所有数据仅限于适用对≥65岁受试者。从FTR缓释片对<73岁感染HIV-1受试者的群体药动学研究表明,年龄对TMR药动学的影响无临床意义。轻度至重度肾损伤患者对TMR总药动学和非结合药动学的影响未观察有临床相关差异。终末期肾病(end-stage renal disease,ESRD)患者和正在进行血液透析者,与ESRD非血液透析患者比较,TMR的药动学无临床意义的差异。4 h血液透析,约除去12.3%服药剂量,但血液透析不容易清除TMR。TMR对轻度至重度肝损伤患者(Child-Pugh为A、B或C级)的总药动学和非结合药动学无临床意义的相关差异[4,6]。
3 临床试验
3.1临床试验概况 研发公司计划开展FTR缓释片治疗HIV-1感染者的临床试验18项,其中一项扩大临床试验未提供详细数据。其余17项在FDA批准上市之际已全部完成,共纳入1 340例受试者,其中Ⅰ期临床14项665例,包括以活性成分TMR开展的8项Ⅰ期临床,纳入331例受试者;Ⅱ期临床2项304例;Ⅲ期临床1项371例。研发公司已全文发表FTR缓释片治疗HIV-1感染者Ⅱb期临床试验和Ⅲ临床试验各一项的详细结果[6-8]。
3.1.2临床实验排除标准 ①患有慢性未经治疗的乙型肝炎病毒(HBV)感染者,若经过长期治疗的HBV患者可入选试验。②HIV-2感染者。③丙氨酸氨基转移酶(ALT)或天冬氨酸氨基转移酶(AST)>7倍正常值上限(ULN)。④碱性磷酸酶> 5倍ULN。⑤胆红素≥1.5 倍ULN,除非受试者目前正在接受阿扎那韦治疗,且主要存在未结合的高胆红素血症[6-8]。
3.1.3临床疗效主要观察指标 从第8天随机分组的队列后第1天起,HIV-1核糖核酸(RNA)均值以10为基数的对数(log10)变化值,时限为第1天和第8天。收集血浆样本进行HIV-1 RNA分析。用协方差分析(analysis of covariance,ANCOVA)法估算HIV-1 RNA log10从第1天至第8天的变化为因变量,治疗药(FTR或安慰药)为自变量,第1天HIV-1 RNA log10为连续协变量。第1天的变化计算方法为第8天的值减去第1天的数值。对意向治疗接触人群(intent-to-treat exposed,ITT-E)进行分析,此人群包括所有接受至少一剂研究治疗药的随机受试者。第8天缺失的HIV-1 RNA值使用2种方法解决。①盲性治疗期间无值受试者的第1天观察结转法(day 1 observation carried forward,D1OCF),即从第1天开始计算零变化或②在第8天分析访问窗口期前,使用盲性治疗期间早期受试者最后一次观察结转值(last observation carried forward,LOCF)进行估算[6-8]。

3.2临床试验一 代号AI438011,临床试验编号NCT01384734,是一项跨国多中心,对经历过大量治疗的HIV-1感染者进行双盲阳性药和安慰药对照的Ⅱb.期临床试验,招募581例受试者进行筛查,有254例符合临床试验标准,按1:1:1:1:1比例随机分为5组,A组(n=52),服FRT 400 mg,bid,加服拉替拉韦(RTG)400 mg,bid,和富马酸替诺福韦二吡呋酯(TEV DP)300 mg,qd、B组(n=50),服FRT800 mg,bid,加服RTG 400 mg,bid和TEV DP300 mg,qd,C组(n=51),服FRT600 mg,qd加服RTG 400 mg,bid和TEV DP300 mg,qd、D组(n=50)服FRT(1 200 mg,qd,加服RTG 400 mg,bid和TEV DP300 mg,qd和E组(n=51),服利托那韦增强阿扎那韦(ATV/r)300/100 mg,qd。各组连续治疗48周[7]。
3.2.1临床疗效评价主要观察指标 第48周病毒学应答率,A组和B组分别有2例和1例因故未参与治疗,可评价的病例数为251例:A组(n=50)、B组(n=49)、C组(n=51)、D组(n=50)和E组(n=51)。第48周后,意向治疗人群达到HIV-1 RNA<50拷贝·mL-1分别为41例(82.0%)、30例(61.2%)、35例(68.6%)、34例(68.0%)和36例(70.6%)[7]。
3.2.2临床疗效评价次要与其他观察指标 可评价病例数为251例:A组(n=50)、B组(n=49)、C组(n=51)、D组(n=50)和E组(n=51)。HIV-1 RNA >50拷贝·mL-1分别为2例(4.0%),9例(18.4%),10例(19.6%),8例(16.0%)和5例(9.8%);缺乏疗效不继续治疗为0%、2例(4.1%)、0%、1例(2.0%)和0%。因其他原因不继续治疗为3例(6.0%)、1例(2.0%)、3例(5.9%)、6例(12.0%)和3例(5.9%);第48周无病毒学数据,因不良反应或死亡不能继续治疗为1例(2.0%)、2例(4.1%)、0%、1例(2.0%)和2例(3.9%);因其他原因无法继续治疗为2例(4.0%)、5例(10.2%)、3例(5.9%)、0%和5例(9.8);在窗口期丢失数据,仍继续参与试验研究为1例(2.0)、0%、0%、0%和0%[7]。
从某种意义上讲,班级群是一个小小的社会团体。一个话题抛出来,大家的讨论比较随性,所以容易产生分歧,甚至言语冲突。很多新闻报道反映,班级群还有不少“戏精”“杠精”“点赞党”。
3.3临床试验二 代号BRIGHTE,临床试验编号为NCT02362503,是一项跨国多中心,对经历过大量治疗的HIV-1感染者进行部分双盲安慰药对照的Ⅲ期临床试验,招募731例患者进行资格评估,经筛查,371例入选临床试验,分成2个队列。队列1(n=272),按3:1随机分为2组,A1组(n=69),A2组(n=203)。前8 d A1组盲法接受安慰药+无效治疗方案,A2组,盲法接受FRT600 mg,bid+无效治疗方案,从第9天起,A1和A2都接受开盲服FRT600 mg,bid,加服优化背景疗法,直至64周。队列2(n=69),为非随机队列,完全无有效的抗逆转录病毒药物药(ARV)可选择,患者有多重耐药性,HIV-1 RNA≥400拷贝·mL-1,从第1天起接受开盲服FRT600 mg,bid,加服优化背景疗法,直至64周[6,8]。

3.3.2临床疗效评价主要观察指标 第48周病毒学应答率,可评价的病例数:A1安慰药组(n=69)、A2FRT服药组(n=203)、随机分组队列1(n=272)和非随机分组队列2(n=99)。HIV-1 RNA<40拷贝·mL-1依次顺序分别为31例(44.9%),95%CI=(34,57) %;115例(56.7%),95%CI=(50,63) %;146例(53.7%),95%CI=(48,60)%和38例(38.4%),95%CI=(29,48) %[6,8]。
3.3.3临床疗效评价次要与其他观察指标 第48周病毒学应答率,可评价的病例数:A1安慰药组(n=69)、A2FRT服药组(n=203)、随机分组队列1(n=272)和非随机分组队列2(n=99)。①病毒学失败(≥40拷贝·mL-1的病例数,分别为33例(47.8%)、71例(35.0%)、104例(38.2%)和52例(52.5%);在48周(295 d和378 d)的窗口期数据不低于阈值为23例(33.3%)、49例(24.1%)、72例(26.5%)和33例(33.3%);缺乏疗效停药为2例(2.9%)、4例(2.0%)、6例(2.2%)和2例(2.0%);不低于阈值,因其他原因停止治疗为2例(2.9%)、7例(3.4%)、9例(3.3%)和3例(3.0%);改变抗逆转录病毒疗法为6例(8.7%)、11例(5.4%)、17例(6.3%)和14例(14.1%)。②无病毒学数据为5例(7.2%)、17例(8.4%)、22例(8.1%)和9例(9.1%);因不良事件或死亡中止试验为5例(7.2%)、10例(4.9%)、15例(5.5%)和8例(8.1%);其他原因终止试验为0%、5例(2.5%)、5例(1.8%)和1例(1.0%);48周窗口期丢失数据,患者仍继续参加试验为0%、2例(1.0%)、2例(0.7%)和0%[6,8]。
4 不良反应
研发公司已公开报道2项临床试验研究结果,其中一项是Ⅱb期临床试验,纳入251例阳性药和安慰药对照进行48周临床试验研究;另一项是Ⅲ期临床试验,纳入371例受试者,分为2个队列,进行64周临床试验。因患者的基线和用药不同,临床试验所产生不良事件各异,只能分开叙述[6-8]。
4.1临床试验一 可评价的病例数,为251例:A组(n=50)、B组(n=49)、C组(n=51)、D组(n=50)和E组(n=51)。严重不良反应(serious adverse reaction,SAR)分别为3例(6.0%)、5例(10.2%)、4例(7.8%)、3例(6.0%)和5例9.8%);不良反应导致停药为1例(2.0%)、2例(4.1%)、0%、2例(4.0%)和2例(3.9%);全组发生2~4级不良事件数为4例(8.0%)、4例(8.2 %)、3例(5.9%)、6例(12.0%)和15例(29.4%);≥2例不良事件:腹痛为0%、0%、0%、1例(2.0%)和2例(3.9%);恶心为0%、0%、0%、0%和2例(3.9%);高胆红素血症为0%、0%、0%、0%和4例(7.8%);黄疸为0%、0%、0%、0%和2例(3.9%);血液胆红素升高为0%、0%、0%、0%和3例(5.9%);头痛为0%、1例(2.0%)、0%、0%和2例(3.9%);≥2例3~4级实验室检测异常:中性粒细胞绝对值升高为1例(2.1%)、1例(2.0%)、2例(3.9%)、1例(2.1%)和1例(2.0%);碱性磷酸酯酶升高为0%、0%、0%、1例(2.1%)和1例(2.0%);ALT升高为0%、0%、0%、2例(4.2%)和0%;AST升高为1例(2.1%)、1例(2.0%)、0%、2例(4.2%)和2例(4.0%);总胆红素升高为0%、0%、0%、0%和29例(58.0%);肌酸激酶升高为0%、1例(2.0%)、1例(2.0%)、2例(4.0%)和2例(4.0%);空腹血糖为0%、1例(2.0%)、2例(3.9%)、0%和0%。尿酸升高为0%、0%、0%、2例(4.0%)和0%[7]。
4.2临床试验二 可评价的病例数,随机分组队列(n=272),非随机分组队列(n=99)和总病例数(n=371),①不良事件依次顺序列举:任何不良事件为247例(90.8%)、96例(97.0%)和343例(92.5%);2~4级不良事件为206例(75.7%)、84例(84.8%)和290例(78.2%);与药物有关的2~4级不良事件为55例(20.2%)、22例(22.2%)和77例(20.8%);3或4级不良事件为70例(25.7%)、47例(47.5%)和117例(31.5%);导致停药的不良事件为14例(5.1%)、13例(13.1%)和27例(7.3%)。严重不良事件为85例(31.3%)、44例(44.4%)和129例(34.8%);美国疾病预防控制中心定为C类AIDS不良事件为24例(8.8%)、14例(14.1%)和38例(10.2%);与药物相关不良事件为7例(2.6%)、3例(3.0%)和10例(2.7%);死亡为11例(4.0%)、14例(14.1%)和25例(6.7%)。最常见的≥10%不良反应事件:腹泻为59例(21.7%)、24例(24.2%)和83例(22.4%);恶心为40例(14.7%)、20例(20.2%)和60例(16.2%);上呼吸道感染为37例(13.6%)、13例(13.1%)和50例(13.5%);头痛为35例(12.9%)、11例(11.1%)和46例(12.5%);咳嗽为33例(12.1%)、10例(10.1%)和43例(11.6%);鼻咽炎为27例(9.9%)、16例(16.2%)和43例(11.6%);发热为24例(8.8%)、17例(17.2%)和41例(11.1%);流行性感冒为28例(10.3%)、13例(13.1%)和38例(10.2%);呕吐为29例(10.7%)、9例(9.1%)和38例(10.2%);支气管炎为28例(10.3%)、6例(6,1%)和34例(9.2%);疲乏为17例(6.3%)、16例(16.2%)和33例(8.9%);背痛为15例(5.5%)、14例(14.1%)和29例(7.8%);虚弱为11例(4.0%)、14例(14.1%)和25例(6.7%)。②3~4级福替沙韦缓释片与OBT联用(n=271),于96周实验室检测≥2.0%异常:ALT>5.0倍ULN为14例(5.2%);AST>5.0倍ULN为11例(4.1%);结合胆红素ULN为19例(7.0%);胆红素ULN为8例(3.0%),胆固醇≥3.0 g·L-1为14例(5.2%);肌酸酐>1.8倍ULN或1.5倍基线值为51例(18.8%);肌酸激酶ULN)为5例(1.8%)血红蛋白<90.0 g·L-1)为16例(5.9%)高血糖(>2.5 g·L-1)为11例(4.1%);脂肪酶(>3.0倍ULN)为14例(5.2%);低密度脂蛋白胆固醇≥1.9 g·L-1为11例(4.1%);中性白细胞≤599细胞·mm3,为11例(4.1%);三酰甘油为>5.0 g·L-1为14例(5.2%);尿酸盐>120 mg·L-1为8例(3.0%)[6,8]。
5 适应证
福替沙韦缓释片与其他抗逆转录病毒药联用,适用于治疗经历丰富且具有多重耐药性的成人HIV-1感染者,因耐药性、不耐受性或从安全性考虑,对目前的抗逆转录病毒治疗方案无效[4,6]。
6 剂量与服法
6.1剂型与规格 福替沙韦只有缓释片一种剂型,每片含福替沙韦600 mg,相当于福替沙韦氨基丁三醇(tromethamine)盐725 mg[4,6]。
6.2推荐剂量与用法 口服福替沙韦缓释片600 mg,每天2次。须整片吞服,不可咀嚼、压碎或掰开药片服用。是否与食品同服均可[4,6]。
7 禁忌证
①此前对福替沙韦或福替沙韦缓释片任何成分过敏者;②不可与强细胞色素P450(CYP)3A诱导药联合用药,可能会出现福替沙韦活性组分血浆浓度显著降低,导致病毒学应答丧失。这些药物包括但不限于:雄激素受体抑制药恩扎卢胺(enzalutamide),抗惊厥药卡马西平(carbamazepine)、苯妥英钠(phenytoin),抗肺结核杆菌药利福平(rifampin),抗肿瘤药米托坦(mitotane),中草药圣约翰草(hypericum perforatum,贯叶连翘)[4,6]。
8 用药注意事项与警示
8.1免疫重建综合征 患者接受联合抗逆转录病毒治疗,曾报道出现免疫重建综合征,包括福替沙韦缓释片在联合抗逆转录病毒治疗的初始阶段,患者的免疫系统可能会有反应。对惰性感染或残余的机会性感染,如鸟分枝杆菌感染、巨细胞病毒、肺囊虫肺炎或结核病产生炎症反应,可能需要进一步评估和治疗。自身免疫性疾病,如格雷夫斯氏病(Graves' disease)、多发性肌炎、格林-巴利综合征(Guillain-Barré syndrome)和自身免疫性肝炎等在免疫重建的环境中,报道发生过;然而发病时间变化较大,可在开始治疗后数月发生[4,6]。
8.2QTc间期延长超过推荐剂量 口服福替沙韦缓释片2 400 mg,每天2次,相当于日推荐剂量的4倍,已证实可显著延长心电图的QTc间期。在与已知有尖端扭转型室速失常风险的药物联用时,有QTc间期延长病史的患者,或有相关既往心脏病史的患者,应慎用福替沙韦缓释片。老年患者更可能容易受到药物诱导QT间期延长[4,6]。
8.3HIV-1患者合并感染乙型肝炎或丙型肝炎有促使肝转氨酶升高的风险 建议对乙肝和(或)丙型肝炎患者进行肝化学监测,确定是否有共感染。HBV和(或)HCV合并感染者与HIV单一感染者比较,肝转氨酶更容易升高,转氨酶升高与HBV再激活相一致,尤其是取消抗肝炎治疗的情况下,在启动或维护HIV-1治疗时,应谨慎监测HBV感染者,并同时进行有效的治疗[4,6]。
8.4药物相互作用促使发生不良反应或丧失病毒学应答的风险 福替沙韦缓释片与某些其他药物联用,可能导致已知的或潜在的重大药物相互作用,其中一些药物可能使替米沙韦接触量减少,导致福替沙韦缓释片的治疗效果丧失和可能产生的耐药性[4,6]。
8.5妊娠妇女用药 孕妇在妊娠期服用福替沙韦缓释片尚无足够的数据可供评价与药物相关的先天缺陷和流产风险。在动物生殖研究中,孕大鼠和孕兔在器官形成期喂饲福替沙韦不引起临床相关的替米沙韦接触量对妊娠动物发育的不利影响[4,6]。
8.6哺乳期妇女用药 美国疾病预防控制中心建议感染HIV-1的母亲不要用母乳喂养婴儿,以降低婴儿感染HIV-1的风险。尚不清楚FTR是否存在于母乳中,是否影响母乳分泌,或对母乳喂养的婴儿有影响。给哺乳期大鼠喂饲FTR时,在大鼠乳汁中存在FTR相关的药物。在一项分布研究中,单剂FTR喂饲给产后7~9 d的哺乳期大鼠,与FTR相关的药物,即TMV和(或)TMV的代谢物从鼠乳汁排出。在对大鼠产前和产后的发育研究,TMV存在于母乳中,其浓度与母鼠产后11 d在血浆测定的浓度相似。此外,哺乳期接触与后代存活率降低相关,而母体的TMV接触与临床无关[4,6]
8.7儿科用药 FTR缓释片的安全性和有效性尚未在儿科患者中得到证实,目前不在适应证范围[4,6]。
8.8老年患者用药 FTR缓释片的临床试验尚未包括足够数量的≥65岁受试者,以确定老年患者的反应是否与较年轻的受试者不同。一般而言,对于肝、肾、心功能减退频率较高的老年患者,应慎用FTR缓释片,伴发疾病或服用其他药物治疗,老年患者对药物诱发的QT间期延长可能更敏感[4,6]。
8.9肾损伤患者用药 肾功能损伤或正在血液透析的患者无需调整FTR缓释片剂量[4,6]。
8.10肝损伤患者用药 轻度至重度肝损伤(Child-Pugh A级、B级或C级)患者,无需调整FTR缓释片的剂量[4,6]。
9 知识产权状态与国内外研究进展
FDA给予福替沙韦缓释片排他性保护期至2025年7月2日期满。研发公司申请3份美国专利:US7745625、US8168615和US8461333保护品种专利,均已授权,专利期至2025年2月25日期满,相应的中国专利CN1953985和CN101941990也已授权,专利期至2025年3月3日期满。笔者尚未查阅到研发公司向国家药品监督管理局提出申请进口注册证的信息及国内制药企业仿制该产品的动态。
