鼻敏片对寒证变应性鼻炎豚鼠辅助性T细胞17/调节性T细胞平衡的影响Δ
2021-03-07莫华秀朱镇华邓晗薇李凡成
莫华秀,朱镇华,邓晗薇,宾 骥,李凡成
(1.湖南中医药大学第一中医临床学院,湖南 长沙 410208; 2.湖南中医药大学第一附属医院耳鼻喉头颈外科,湖南 长沙 410007)
变应性鼻炎(allergic rhinitis,AR)是易感机体接触致敏原后产生的由免疫球蛋白E(IgE)介导的,以突然和反复发作的打喷嚏、鼻塞、鼻流清涕和鼻痒等为主要症状的鼻部黏膜慢性炎症反应[1]。AR的特点是治疗周期长、发作反复、难以治愈等,临床上易出现鼻部及眼部的伴随症状。近年来,流行病学调查结果发现,全球AR患病率逐年升高,约为10%~40%[2-3]。根据美国2015年AR临床指南的相关索引[4],避免接触过敏原、药物治疗、手术治疗及特异性免疫治疗是临床上较为常见的治疗手段,其中应用广泛的一线治疗药物是鼻用糖皮质激素和第2代鼻用或口服抗组胺药,虽然其起效较快,但从长期的治疗结果看,其不仅存在易复发、远期效果难以保证等缺点[5],还使得机体的敏感性降低,从而可能引发不良反应[6-7]。中医对AR的治疗是基于患者的整体,纠正机体阴阳失衡的疾病状态,从而提高机体的免疫功能。中医学认为,该病多因肺脾肾的虚损,风寒之邪乘虚入侵所致,故用鼻敏片治以温肺祛风、补肾健脾、摄津止涕,长期临床应用的疗效显著。本研究旨在以寒证AR豚鼠模型为研究对象,通过检测豚鼠血清中IgE、白细胞介素(IL)17和IL-10的含量,鼻黏膜中辅助性T细胞17(Th17)/调节性T细胞(Treg)、特异性转录因子维甲酸相关孤儿受体γt(RORγt)和叉状头/翅膀状螺旋转录因子(Foxp3)蛋白的表达水平,探讨Th17/Treg细胞的免疫机制,为临床上应用鼻敏片治疗AR提供理论依据。
1 材料与方法
1.1 材料
1.1.1 药品与试剂:鸡卵清蛋白(索莱宝生物公司,货号:1031H052);氢氧化铝[Al(OH)3](Thermo Fisher公司,货号:PF201964);豚鼠IgE、IL-10和IL-17酶联免疫吸附试剂盒(上海晶天生物公司,货号:20190729);兔抗豚鼠Foxp3蛋白多克隆抗体(bioss公司,货号:BS-10211R);兔抗豚鼠RORG蛋白多克隆抗体(bioss公司,货号:BS-6217R);氯雷他定片(上海拜耳医药有限公司,批准文号为国药准字H10970410,批号为JS08187);鼻敏片由湖南中医药大学第一附属医院中药房提供。
1.1.2 实验动物:普通级雄性英国种豚鼠40只,体重250~350 g[湖南中医药大学动物实验中心提供,动物批号:SCXK(湘)2014-0010];正常饲料饮食外给予包菜或胡萝卜。
1.2 方法
1.2.1 造模及给药:将40只豚鼠随机分为4组,即模型组、氯雷他定片组、鼻敏片组和空白组。适应性饲养7 d后,前3组以复方凉药+卵清蛋白(OVA)致敏法复制寒证AR模型,空白组正常饲养。参照陈小野等[8]改良后的复方寒凉药制备寒证模型,采用黄柏-知母-生石膏-龙胆草(质量比为1.5∶2∶1∶1.2)煎制成200%(浓度)的水煎剂灌胃(10 ml/kg),1只1次4 ml,1日3次,于第17日起改为1日4次灌胃给药,用药28 d。参照AR动物模型(草案)制备豚鼠模型[9],按卵清蛋白30 mg+[Al(OH)3]3 g+0.9%氯化钠溶液100 ml配制混悬液,每只豚鼠隔日腹腔注射1 ml,共行7次基础致敏。配制2%卵清蛋白(卵清蛋白)0.9%氯化钠溶液,用移液枪进行双侧滴鼻激发,1个鼻孔1次50 μl,1日1次,共行7次滴鼻激发。造模成功后,隔日给予卵清蛋白(卵清蛋白)1 g/L滴鼻以维持模型。造模后,按体表面积法计算给药剂量,氯雷他定片组豚鼠的给药剂量为0.903 mg/kg,鼻敏片(组方:黄芪20 g,白术10 g,防风6 g,麻黄5 g,当归10 g,细辛3 g,巴戟天10 g,淫羊藿10 g,蝉蜕6 g,五味子6 g,白芍10 g,甘草6 g,白蒺藜10 g)组豚鼠的给药剂量为10.117 g/kg,其余两组豚鼠给予0.9%氯化钠溶液4 ml,均灌胃给药,治疗15 d,每日分2次给药。
1.2.2 血清、鼻黏膜的采集及检测方法:用10%水合氯醛溶液(0.1 ml/20 g)麻醉后心脏采血,以3 000 r/min(离心半径为13.5 cm)离心15 min后取血清,并用酶联免疫吸附试验测定其血清IgE、IL-10及IL-17的含量。取一侧鼻黏膜于4%多聚甲醛溶液固定后,经石蜡包埋切片,行苏木素-伊红(HE)染色,光镜下观察其病理组织形态。另取一侧完整鼻中隔及黏膜放入Eppendorf管,并移入-80 ℃低温冰箱保存待行Western blot法测定鼻黏膜中RORγt、Foxp3蛋白的表达。
1.2.3 豚鼠行为学评价:依据《实用中医证候动物模型学》《中医虚证诊断标准》等对寒证模型复制是否成功进行评价[8,10]。寒证动物模型表现为畏寒,活动减弱,摄食、饮水量降低,耳廓、爪趾颜色淡(白),舌唇淡(白)等症状。参照相关文献[11],对其鼻部症状进行叠加量化法评分,其行为学总分>5分表示造模成功。
1.3 统计学方法

2 结果
2.1 四组豚鼠治疗前后鼻部症状评分比较
治疗前后症状评分结果显示,治疗前,与空白组比较,模型组、氯雷他定片组及鼻敏片组豚鼠鼻部症状评分均显著升高,差异有极显著统计学意义(P<0.01);治疗15 d后,与模型组比较,氯雷他定片组、鼻敏片组豚鼠鼻部症状评分显著降低,差异有极显著统计学意义(P<0.01);组间比较,氯雷他定片组、鼻敏片组豚鼠鼻部症状评分的差异无统计学意义(P>0.05),见表1。

表1 四组豚鼠治疗前后鼻部症状评分比较分)
2.2 四组豚鼠治疗后血清IgE、IL-10及IL-17水平比较
酶联免疫吸附试验结果显示,治疗后,与空白组比较,模型组豚鼠血清IgE、IL-17含量明显升高,血清中IL-10含量明显降低,差异有极显著统计学意义(P<0.01);与模型组比较,氯雷他定片组、鼻敏片组豚鼠血清IgE含量明显降低,差异有统计学意义(P<0.05),血清IL-10的表达水平明显升高,而血清中IL-17的表达水平明显降低,差异均有极显著统计学意义(P<0.01);组间比较,氯雷他定片组、鼻敏片组豚鼠IgE、IL-10及IL-17水平的差异均无统计学意义(P>0.05),见表2。

表2 四组豚鼠治疗后血清IgE、IL-10及IL-17水平比较
2.3 四组豚鼠治疗后鼻黏膜Foxp3和RORγt的相对表达量比较
以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为内参,其表达相对值用各条带的灰度值与GAPDH比值表示。结果显示,治疗后,与空白组比较,模型组豚鼠鼻黏膜Foxp3蛋白表达明显降低,模型组豚鼠RORγt表达明显升高,差异有极显著统计学意义(P<0.01);与模型组比较,氯雷他定片组、鼻敏片组豚鼠鼻黏膜Foxp3表达明显升高,差异有统计学意义(P<0.05),而RORγt表达明显降低,差异有极显著统计学意义(P<0.01)。组间比较,氯雷他定片组、鼻敏片组豚鼠Foxp3、RORγt表达量的差异无统计学意义(P>0.05),见表3、图1。
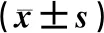
表3 四组豚鼠治疗后鼻黏膜Foxp3和RORγt的相对表达量比较

图1 Western Blot检测豚鼠黏膜RORγt与Foxp3的表达
2.4 四组豚鼠鼻黏膜组织病理检查结果
光镜下豚鼠鼻黏膜病理检查结果显示,模型组豚鼠鼻黏膜上皮结构紊乱,黏膜水肿,组织间隙出血或伴血管扩张充血,间质中大量炎症细胞浸润明显;空白组豚鼠鼻黏膜上皮组织结构完整,未见挤压变形的炎症细胞等;治疗后,与模型组比较,氯雷他定片组、鼻敏片组豚鼠鼻黏膜炎症反应明显减轻,见图2。

A.模型组;B.氯雷他定片组(治疗后);C.鼻敏片组(治疗后);D.空白组A.model group; B.claritin group(after treatment); C.Bimin tablets group(after treatment); D.blank group
3 讨论
中医学认为,AR属“鼽嚏”“鼻鼽”范畴。《脏象》曰:“肺开窍于鼻,肺属金、肾属水、金水同源。”《医法圆通·鼻流清涕·卷一》曰:“鼻流清涕一证,有从外感而致者,有从内伤而致者,从外感而致者,感受外来之客邪,客于肺经,闭其清道,肺气不得下降,清涕是出……从内伤而得者,由心肺之阳不足,不能统摄津液,而清涕出,肾络通于肺,肾阳衰而阴寒内生,不能收束津液,而清涕亦出。”[12]认为本病是由肺脾肾三脏功能的虚损,风寒之邪气乘虚侵入而致的本虚标实证,肺气虚则卫表不固,腠理疏松,风寒之邪气乘虚侵入累及于鼻,邪气客于肌表,而使阳气壅滞于内无法泄越,故见喷嚏外出而为嚏;且寒邪之气壅肺,使其失于清肃,鼻窍不通故为鼽[13]。根据其病因病机特点,结合现代药理学成果,得到经验方鼻敏片,以益气固表、祛风散邪的玉屏风散配合温肺肾阳、祛散风寒的麻黄附子细辛汤,并加健脾摄津止涕的药物化裁而成,可标本同治。现代药理研究结果发现,麻黄中的槲皮素有消炎、抗过敏及抗病毒等作用,且可抑制免疫反应[14];细辛挥发油的消炎、抗真菌及抗过敏等特性,可减轻AR的临床症状[15];黄芪多糖可促进抗体生成以调节免疫[16];白术多糖能活化T淋巴细胞以调节其免疫[17];防风多糖在抑制黏膜的炎症反应方面收效显著,可调节免疫应答[18]。
既往研究结果表明,AR属IgE介导的Ⅰ型变态反应,其发病机制研究主要集中在Th1/Th2细胞失衡方面,认为其发病是因Th1/Th2细胞失衡而使Th2细胞的表达增多,从而表现出以嗜酸粒细胞浸润为主的炎症反应[19]。近年来,研究者发现其发病还与Th17、Treg的免疫失衡密切相关,进一步为AR的治疗机制研究提供了新的思路[20]。研究结果表明,Th17、Treg在CD4+T细胞的基础上进行分化,且在功能表现上相互制约,从而维持机体免疫状态的稳态[21-22]。其中,RORγt是Th17细胞独特的转录因子,Foxp3是Treg细胞的特异性转录因子,其表达可在一定程度上反映Th17、Treg细胞的功能变化和状态[23-24]。Th17细胞可分泌IL-17、IL-6、粒细胞集落刺激因子、趋化因子CXCL1、趋化因子CXCL5及基质金属蛋白酶等,使中性粒细胞、巨噬细胞不断聚集,进而导致炎症细胞发生浸润、组织遭受严重破坏,从而参与机体免疫的系统调控[25-26]。Treg细胞通过分泌IL-10、转化生长因子β等抑制炎症的因子,使得Th2细胞的活性降低,IgE的合成减少,并使嗜酸性粒细胞及细胞因子的募集、活化功能减弱,从而使其变态反应性炎症症状得到缓解[27]。
本研究结果显示,鼻敏片对于鼻部炎症所致黏膜水肿有着较为明显的疗效,且可降低血清中IgE的含量,减轻豚鼠喷嚏、流涕及抓鼻的鼻部症状,从而达到治疗AR豚鼠的目的。鼻敏片可显著升高血清IL-10水平,降低血清中IL-17的表达,从而纠正Th17/Treg细胞的失衡,缓解免疫炎症反应,其可能通过增强Foxp3蛋白的表达,抑制RORγt蛋白的表达,从而调节Th17/Treg细胞的失衡。
