急性肺损伤大鼠模型制备及不同时段肺损伤比较
2021-03-06张毅程晨苏景超张新芳刘心月项水英王彩云李尹林先刚刘自兵
张毅程晨苏景超张新芳刘心月项水英王彩云李尹林先刚刘自兵∗
(1. 安徽中医药大学研究生院,合肥 230038; 2. 安徽中医药大学中西医结合学院,合肥 230038;3. 安徽中医药大学针灸推拿学院针灸经络研究所,合肥 230038; 4. 针灸基础与技术安徽省重点实验室,合肥 230038)
急性肺损伤(acute lung injury,ALI)是由于肺内外致病因素造成弥漫性炎性肺泡浸润、出血、肺水肿和透明膜形成,患者血氧结合能力降低为主的危急症候,严重者发展为急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)[1-2]。在过去的二十年里,已经开发了几种治疗策略,并取得了显著的进展;然而,死亡率仍然很高,超过三分之一的患者死亡,一些幸存者由于长期低氧而出现脑损伤等并发症[3-4]。研究发现强烈的炎症反应和肺泡毛细血管膜通透性增加在急性肺损伤的病理生理机制中起重要作用[5]。制备稳定的动物模型对观察ALl 病理改变和探究潜在药物作用机制和防治并发症等具有重要意义。目前关于ALI 模型制备途径主要分为原发诱导和继发诱导两种。原发诱导通过向气管内滴注脂多糖(lipopolysaccharide,LPS)[6]、盐酸[7]、活的(或热杀死)细菌和病毒[8]等物质直接诱导肺部损伤,而继发诱导则是由其他疾病诱发ALI 包括烧伤[9]、腹腔注射LPS[10]、盲肠结扎穿刺等[11]。脂多糖刺激已被广泛认为是通过致炎建立与临床相关的ALI 动物模型的有效策略[12-13]。LPS诱导的ALI 动物模型肺部炎性细胞聚集、肺泡毛细血管通透性增加导致弥漫性肺水肿、肺出血等症[14-15]。本研究通过气管滴注LPS 法直接对大鼠肺造成损伤[16-17],建立急性肺损伤动物模型,探究肺损伤程度在不同时间段是否存在差异。
1 材料与方法
1.1 材料
1.1.1 实验动物
32只8周龄成年SPF 级雄性SD 大鼠,体重(230 ± 20)g,由安徽医科大学动物实验中心提供【SCXK(皖)2019-0002】,饲养于安徽医科大学动物实验中心【SYXK(皖)2019-005】,使用许可证号经安徽科技厅审批。饲养环境:昼夜各半循环照明,湿度恒定,室温(23 ± 2)℃,大鼠分笼饲养,自由饮水、摄食。实验过程中对动物的处置符合2006年9月科技部颁布的《关于善待实验动物的指导性意见》,所有操作均符合实验动物伦理学要求(伦理审查号:AHUM-rats-2020009)。
1.1.2 主要试剂与仪器
脂多糖(L2880,美国Sigma 公司);肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)、白介素-1β(interleukin 1β,IL-1β)、白介素-8(IL-8)ELISA 试剂盒(武汉基因美科技有限公司);丙二醛(MDA)试剂盒(南京建成生物工程研究院);超氧化物歧化酶(SOD)试剂盒(南京建成生物工程研究院)。
手术器械(上海医疗器械股份有限公司);小动物呼吸功能检测仪(北京贝兰博科技公司);Ani-Res2005 动物肺功能分析软件(北京贝兰博科技公司);电子天平(上海菁海仪器有限公司);电热恒温鼓风干燥箱(上海三发科学仪器有限公司);Image J生物医学图像分析软件(美国国立卫生研究院)。
1.2 方法
1.2.1 动物分组
32 只大鼠适应性饲养1周后,随机分为正常组和模型组,正常组8 只大鼠,模型组24 只大鼠,模型组依据LPS 滴注时长不同分为3 个亚组:3 h 组、6 h组和12 h 组,每组8 只,造模过程中大鼠死亡,采用差额补充的方法以保证每组的实验动物例数。
1.2.2 模型制备
8 只正常组大鼠不进行任何处理。24 只模型组大鼠采用脂多糖(LPS)气管滴注法[16-17]建立ALI大鼠模型,用3%戊巴比妥钠(1 mL/kg)腹腔注射麻醉后固定于解剖台上,沿颈正中线手术暴露气管,采用气管插管的方式向大鼠气管内滴注LPS(2 mg/kg),气管滴注后将大鼠直立,垂直旋转大鼠,使药物能在大鼠肺部均匀布散,以制备急性肺损伤模型,按组别于3、6、12 h 末检测肺功能和取材。
1.2.3 观察大鼠一般状况
气管滴注LPS 后,将大鼠放回饲养笼,给予充足的饲料和水,观察所有大鼠饮食、活动、呼吸频率等一般状况。
1.2.4 肺功能检测
大鼠于3、6、12 h 各时间点检测完肺功能,大鼠称重后3%戊巴比妥钠(1 mL/kg)腹腔注射麻醉,行气管切开后插管,保持气道畅通。大鼠仰卧位放于体描箱中,通过导管连接呼吸机和信号调理器,使用肺功能检测软件,检测大鼠用力肺活量(forced vital capacity,FVC)、第0.1 秒用力呼气量(forced expiratory volume in 0.1 s,FEV 0.1)、第0.1 秒用力呼气量与用力肺活量比值(FEV 0.1/FVC)、第0.3秒用力呼气量(forced expiratory volume in 0.3 s,FEV 0.3)、第0.3 秒用力呼气量与用力肺活量比值(FEV0.3/FVC)。
1.2.5 ELISA 法检测各组大鼠BALF 中细胞因子TNF-α、IL-1β、IL-8 含量
收集支气管肺泡灌洗液,将大鼠开胸,结扎左总支气管,用注射器插入气管插管上端,取8 mL 生理盐水分3 次注入右肺,反复冲洗并回收3 遍灌洗液,将收集的BALF 离心取上清液,采用双抗体夹心酶联免疫分析法检测各指标含量,操作步骤严格按照试剂盒说明书加样,用酶标仪测定OD 值,计算实际样品的浓度。
1.2.6 观察肺大体改变
大鼠在抽取支气管肺泡灌洗液后,解剖胸腔立即进行肺组织取材,观察大鼠肺组织大体改变。
1.2.7 确定肺湿干重(W/D)比
大鼠处死后取左肺,将左肺置于滤纸上去除多余水分并称湿重(W),标记组别后将肺组织连同滤纸一同放入60℃恒温干燥箱内干燥,48 h 后干燥完毕,将滤纸与左肺一同取出称干重(D),计算肺湿干重比值,评估肺水肿。
1.2.8 试剂盒检测MDA、SOD 含量
取100 mg 肺组织捣碎匀浆,在4℃条件下3500 r/min,离心10 min,取上清并保存于-80℃备用。操作步骤严格按照试剂盒说明书操作,用酶标仪测定OD 值,计算实际样品浓度。
1.2.9 HE 染色法观察肺组织病理学变化
取右肺上叶,4%多聚甲醛溶液固定,常规石蜡包埋,切片(5 μm),二甲苯脱蜡脱水,苏木精染色,封片后,10 × 40 倍镜下拍照,用Image J 软件观察分析大鼠肺组织病理变化。
1.3 统计学分析
所有数据均在SPSS 23.0 统计学软件上进行统计学分析,以平均值± 标准差(±s)表示,多组间比较采用单因素方差分析,两组间比较采用LSD 检验。以P<0.05 为差异具有统计学意义。
2 结果
2.1 大鼠的死亡率/存活率
24 只模型组大鼠采用气管内滴注LPS 法建模,从造模后到取材前3 h 组、6 h 组和12 h 组大鼠均存活,存活率为100%。
2.2 大鼠的一般状况
大鼠气管滴注LPS 后,3 h 组与正常组相比,精神处于淡漠状态,未见摄食及饮水,蜷卧笼角,活动减少,鼻腔处粘液分泌物增多,部分大鼠鼻腔分泌粘液为血性粘液,大鼠的呼吸频率加快,胸廓起伏加深,可闻及哮鸣音。6 h 组与3 h 组比较,大鼠少量饮水,活动次数增加,鼻腔粘液分泌物减少,呼吸频率较3 h 组平稳。12 h 组大鼠精神状况趋于平稳,摄食及饮水次数增多,鼻腔处未见明显粘液分泌,呼吸平稳,未见明显哮鸣音。
2.3 大鼠肺大体观察
LPS 气管灌注3、6、12 h 后,与正常组相比,3 h组左右肺门处可见肺组织肝样变,该肝样变区域由肺门处往肺周边蔓延,具有明显的分界,左右肺叶上散布出血点,出血部位颜色鲜红;6 h 组表现为右肺上叶处肝样变出血,区域占比为右肺面积10% ~20%;12 h 组右肺上叶处和右肺中叶处有大片肝样变出血,区域占比为右肺面积的50% ~60%,出血部位颜色呈深褐色,表明肺出血较6 h 组加剧(见图1)。
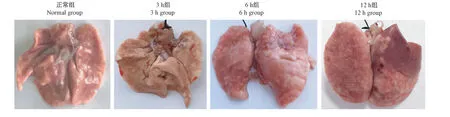
图1 不同损伤时间节点观察图Figure 1 Observation of nodes with different damage time
2.4 肺功能
各组大鼠FVC 差异不显著(P>0.05),与正常组相比,3 h 组FEV 0.1、FEV 0.1/FVC、FEV 0.3、FEV 0.3/FVC 均下降明显(P<0.05,P<0.01);6 h组FEV 0.3、FEV 0.3/FVC 明显降低(P<0.05),FEV 0.1 和FEV 0.1/FVC 数值降低,但不具备统计学差异(P>0.05);12 h 组FEV 0.1、FEV 0.3、FEV 0.1/FVC、FEV 0.3/FVC 下降明显(P<0.05,P<0.01)。3 h 组与6 h 组比较,FEV 0.1、FEV 0.1/FVC 差异显著(P<0.05)(图2)。

图2 大鼠肺功能指标比较(±s,n=8)Note. Compared with the normal group, ∗P<0.05, ∗∗P<0.01. Compared with 3 h group, #P<0.05. (The same in the following figures)Figure 2 Comparison of pulmonary function indexes in rats(±s,n=8)
2.5 左肺湿干重比值
3 h 组与正常组比较,大鼠左肺湿/干重比值明显增加(P<0.01),6 h 组与正常组比较,差异具有显著性(P<0.05),12 h 组与正常组比较,差异具有显著性(P<0.01)。3 h 组与6 h 组比较,3 h 组湿干重比值更显著(P<0.05)(图3)。
2.6 支气管肺泡灌洗液中促炎因子含量
3 h 组与正常组比较,BALF 中IL-1β、IL-8、TNFα 含量明显升高(P<0.01),6 h 组与正常组比较,BALF 中IL-1β、IL-8、TNF-α 含量显著升高(P<0.05,P<0.01),12 h 组与正常组比较,BALF 中IL-1β、IL-8、TNF-α 含量上升明显(P<0.01),3 h 组与6 h 组、12 h 组比较,IL-1β、IL-8、TNF-α 升高显著(P<0.01),6 h 组与12 h 组比较,IL-8、TNF-α 含量具备明显差异(P<0.01)(图4)。

图3 大鼠左肺湿/干重比值比较(±s,n=8)Figure 3 Comparison of wet/dry weight ratio of left lung in rats(±s,n=8)
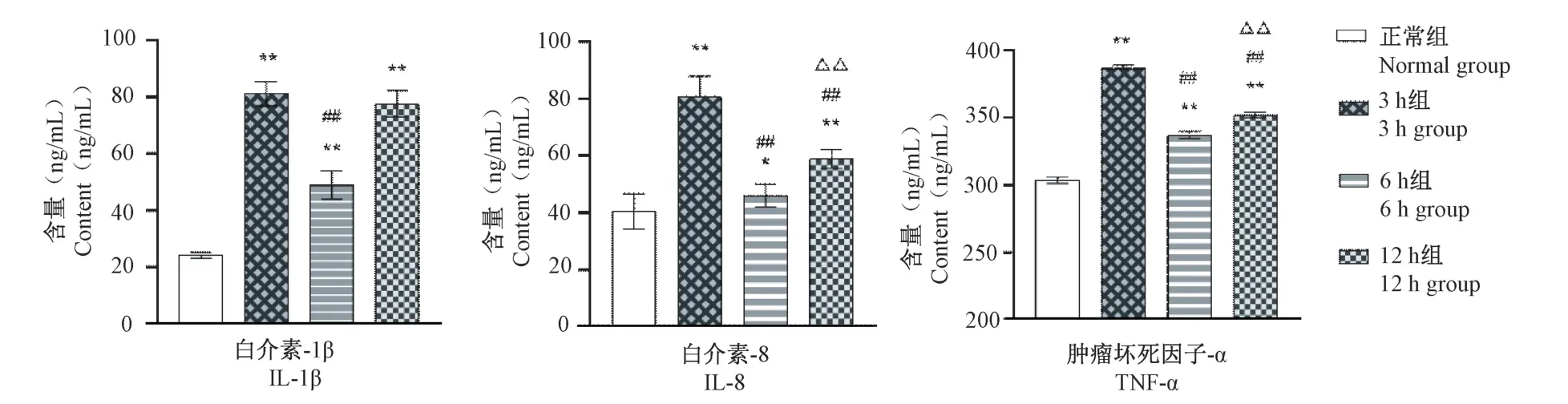
图4 BALF 中IL-1β、IL-8、TNF-α 比较(±s,n=8)Note. Compared with 3 h group, ##P<0.01. Compared with 6 h group, △P<0.05, △△P<0.01. (The same in the following figures)Figure 4 Comparison of IL-1 β,IL-8 and TNF-α in BALF(±s,n=8)
2.7 肺组织中MDA、SOD 含量
3 h 组与正常组比较,MDA 含量显著升高(P<0.01),SOD 含量显著降低(P<0.01),6 h 组与正常组比较,MDA 含量明显升高(P<0.05),SOD 明显降低(P<0.01),12 h 组与正常组比较,MDA 含量显著升高,SOD 显著降低(P<0.01)。模型组组间比较,3 h 组与6 h 组比较,MDA 含量和SOD 含量具备差异(P<0.05,P<0.01),3 h 组与12 h 组比较,差异不显著(P>0.05),6 h 组与12 h 组比较,6 h组MDA 含量和SOD 含量具备显著差异(P<0.05,P<0.01)(图5)。

图5 肺组织中MDA 和SOD 比较(±s,n=8)Figure 5 Comparison of MDA and SOD in lung tissue(±s,n=8)
2.8 HE 染色
正常组大鼠HE 染色显示肺泡完整且大小均匀,无明显炎性细胞浸润。3 h 组、6 h 组和12 h 组均可见不同程度的急性肺部炎症。3 h 组主要表现为肺泡隔增厚,肺泡壁塌陷,肺实质内有炎性细胞浸润,间质水肿、红细胞渗出;6 h 组可见肺泡壁增厚,炎性细胞浸润,红细胞渗出;12 h 组肺泡壁增厚,肺泡壁塌陷,炎性细胞浸润明显。三组比较,3 h组肺部损伤最典型(图6)。
3 讨论
急性肺损伤是一种常见疾病,临床表现为肺水肿、肺出血、患者呼吸功能下降为主要特征的肺部炎性疾病。引起ALI 的病因有很多,包括休克[18]、脓毒症[19]、肺挫伤[20]、肺炎[21]、输血[22]、急性胰腺炎[23]等直接因素,以及呼吸机诱导[24]、机械伤害[25]等间接因素均可导致ALI。从分子机制上分析,主要是蛋白酶和抗蛋白酶失衡、氧化应激造成细胞凋亡,整个疾病过程中多种促炎细胞因子的过度释放,迁移因子和炎性介质过表达,造成级联式的免疫应激反应[26],诱发细胞因子风暴,疾病发展迅速,严重者出现呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)[27]。关于ALI 发病机制的研究几十年来从未间断,但其中细胞分子机制仍有待我们进一步挖掘,制备稳定可靠的ALI 动物模型是探究ALI 发病机制的重要保证。

图6 肺组织不同时间段病理学变化(HE 染色,× 400)Figure 6 Pathological changes in different time periods(HE staining, × 400)
目前制备ALI 模型应用最广泛的是气管滴注法,分为暴露法和非暴露法。LPS 作为内毒素主要成分,是造成ALI 重要起病因子[28]。本实验造模方法基于参考文献结合课题组前期研究基础上改良[17,29],采用暴露式气管滴注LPS 法制备ALI 大鼠模型,施术者延颈部正中线切开暴露气管后,可以直接观察到注射针头插入气管内,有效的保证LPS通过气管进入肺腔,同时能更好的控制药量,保证造模的成功率,研究发现暴露气管滴注法要优于非暴露式气管滴注法[30]。
参照2011年美国胸科学会评定动物急性肺损伤官方报告[31]制定模型评价标准,在LPS 诱导的ALI 大鼠模型制备成功后对各组模型进行评判。大鼠在气管滴注LPS 后出现肺功能明显下降,肺湿干重比值增加,表明肺水肿形成,病理切片显示肺组织呈现肺损伤的特征,包括肺泡间隔增厚、肺泡壁塌陷、炎性细胞浸润、肺间质水肿和出血。BALF 中炎性因子检测IL-1β、IL-8、TNF-α 含量上升显著,提示大鼠肺内炎症反应剧烈,肺组织中MDA 的上升和SOD 的下降,表明肺部的氧化和抗氧化机制的失衡,以上指标趋势均符合2011年美国胸科学会评定动物急性肺损伤官方报告[31]对ALI 动物评价标准,表明本次实验复制ALI 大鼠模型成功,且结果表明3 h 组造模效果要优于6 h 组、12 h 组。
从组织学的角度来看,肺是一个非常复杂的器官。肺上皮由两种主要细胞类型组成,肺泡Ⅰ型(alveolar type I,ATI)细胞和肺泡Ⅱ型(alveolar type II,ATII)细胞,又称I 型和II 型肺泡细胞。ATI 与ATII 细胞共同构成肺外周部完整的上皮衬里,在肺内稳态中发挥重要作用[32]。肺泡上皮是保护肺部免受外界环境伤害的机械屏障,它积极参与肺部的免疫反应,有助于维持肺泡表面液体平衡[33]。急性肺损伤病理学表现为肺泡上皮细胞损伤、大量中性粒细胞在肺中聚集以及弥漫性的肺水肿。在LPS的诱导下,肺上皮细胞损伤、凋亡,释放大量的促炎因子和趋化因子,从外周血液中招募大量的中性粒细胞进入肺中,中性粒细胞进一步释放炎性介质和趋化因子,造成炎症级联式反应,引起细胞因子风暴产生[34]。另外肺泡上皮屏障被破坏,使得血管内大量富含蛋白质的液体进入肺泡,造成弥漫性肺水肿。实验结果表明,气管内灌注LPS 诱导肺泡上皮细胞损伤,中性粒细胞浸润,弥漫性肺水肿,成功建立ALI 大鼠模型。
肺泡巨噬细胞(alveolar macrophages,AM)是支气管肺泡内主要的常驻免疫细胞,它与肺泡上皮细胞一起,对到达下呼吸道的有毒物质和病原体产生即时反应,有助于维持肺内环境稳态[35]。AM 在接受不同刺激物诱导后,可经典活化为M1 型肺泡巨噬细胞和M2 型肺泡巨噬细胞。M1 主要分泌细胞因子TNF-α、IL-1β、IL-6 等促炎;M2 主要分泌细胞因子IL-10,TGF-β 等发挥抗炎作用[36]。LPS 属于经典的巨噬细胞激活剂[37]。AM 对LPS 的反应和随后细胞因子的释放依赖于Toll 样受体4(toll-like receptor 4,TLR4)[38]。通常AM 中TLR4 的表达量很低,但在LPS 暴露后TLR4 的表达迅速增强[39]。LPS 与TLR4 受体结合,导致促炎通路NF-κB(nuclear factor-kappa B)活化,产生多种炎症介质TNF-α、IL-6,最终导致细胞损伤和急性肺损伤的临床表现[40]。此外,气管内注射LPS 可诱导坏死性AM 释放IL-1α,继而激活内皮细胞,增加血管通透性,造成肺间质水肿[41]。实验中,暴露式气管灌注LPS 法主要表现为肺间质水肿,也从侧面佐证了这一点。
本研究表明,通过暴露式气管滴注LPS 法成功复制ALI 大鼠模型,同时针对3 h 这一时段,暴露式气管滴注LPS 法能更好的反映急性肺损伤这一疾病的病理特性。
