意大利蜜蜂DHPR基因的生物信息学分析
2021-03-06
(安徽省农业科学院蚕桑研究所,合肥 230061)
蜜蜂作为一种社会性昆虫,具有重要的经济价值和生态价值,在诸如神经生物学和社会生物学等研究领域具有很高的模型价值[1]。我国饲养的西方蜜蜂品种中,主要是以意大利蜜蜂为主[2]。四氢生物蝶呤(Tetrahydrobiopterin,BH4)是芳香族氨基酸羟化酶的必需辅酶[3,4],也是一氧化氮合酶的辅因子,能作为自由基清除剂参与氧化应激作用[5-8],BH4的合成不足会引发多种神经性疾病[9-11]。现阶段,BH4合成代谢网络在双翅目模式生物黑腹果蝇和鳞翅目模式生物家蚕中都有较多的研究[12-15],但是在以蜜蜂为代表的膜翅目昆虫中鲜有研究。研究蜜蜂的BH4合成途径对于意蜂乃至膜翅目的生理意义重大,特别是对于昆虫体内的氧化平衡以及神经系统方面的影响。
二氢蝶呤还原酶(dihydropteridine reductase,DHPR)是一种催化醌型二氢生物蝶呤(Quinone dihydrobiopterin,q-BH2)还原成四氢生物蝶呤的还原酶[16]。此反应需要NADH的参与,利用DHPR将还原型的NADH烟酰胺环上的氢离子直接转移到q-BH2上,NADH也可由还原型辅酶NADPH替代[15]。果蝇DHPR氨基酸序列与包括人和小鼠的其他物种高度同源,也具有与人类DHPR相同的 NAD(P)H结合域以及组成q-BH2结合位点相关的大多数氨基酸[12]。家蚕BmDHPR氨基酸序列与其他物种来源的DHPR 蛋白具有高度同源性,且BmDHPR与果蝇亲缘关系较近[13,15]。最新有研究发现果蝇DHPR缺失的突变体表现出大脑TH神经元减少缺陷,还显示出线粒体的异常膨大与聚集现象[14],表明DHPR对于线粒体稳态的重要性[14]。
生物信息学方法在功能基因的测序、识别、功能预测、结构分析等方面都发挥着重要作用。自意大利蜜蜂基因组全序列测序完成后,越来越多的生物信息学方法应用到意蜂各类基因的研究工作中。鉴于DHPR对于BH4和线粒体的重要性,本文采用生物信息学方法,对意蜂二氢蝶呤还原酶的预测基因进行一系列的预测分析,并构建系统进化树,旨在为后续深入研究意蜂二氢蝶呤还原酶的功能提供理论依据。
1 材料与方法
1.1 序列来源
NCBI数据库(http://www.ncbi.nlm.nih.gov/)的意大利蜜蜂二氢蝶呤还原酶预测基因(GenBank序列号为XM_392684.7);蜜蜂BeeBase数据库的意大利蜜蜂二氢蝶呤还原酶预测基因(基因序列号:GB50513)。
1.2 方法
使用ORF Finder对编码意蜂二氢蝶呤还原酶的氨基酸组分进行分析;ExPASy-Compute pI/Mw tool网站预测蛋白的分子量与等电点;采用Psipred在线网站进行蛋白质二级结构预测;通过SWISS-MODEL网站比对与意蜂DHPR相似性较高的模板对意蜂DHPR进行同源建模,构建蛋白质三级结构;使用软件MEGA 6.0构建系统进化树。
2 结果与分析
2.1 意大利蜜蜂DHPR的预测基因信息
利用NCBI数据库检索到意大利蜜蜂DHPR的预测基因,基因编号为LOC409160,再结合蜜蜂BeeBase数据库中对于该预测基因的分析,分析结果显示:意蜂DHPR预测基因全长2264bp,开放阅读框大小为714bp,含有4个外显子和3个内含子(图1)。DNAMAN软件预测该基因编码237个氨基酸(不包括TAA)(图2)。
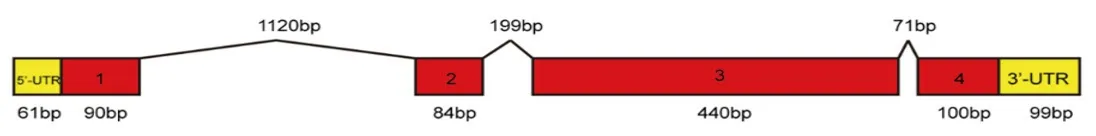
图1 意蜂DHPR预测基因的结构图

图2 意蜂DHPR的核苷酸序列及推导的氨基酸序列
2.2 意大利蜜蜂DHPR蛋白的理化性质分析
使用ProtParam分析意大利蜜蜂DHPR的蛋白组分和理化性质(表1)。意蜂DHPR编码蛋白的氨基酸组成中,不含Pyl和Sec,Ala含量最高,达到11.4%;含有20个酸性氨基酸(Asp+Glu),24个碱性氨基酸(Arg+Lys);氨基酸序列的不稳定系数为29.55,说明此蛋白是稳定的;预测蛋白分子量约为25.67kDa,理论等电点(pI)为8.90,原子组成为C1150H1814N310O336S10,脂肪族氨基酸指数为89.41,亲水性指数为-0.077,表明其为亲水性蛋白。
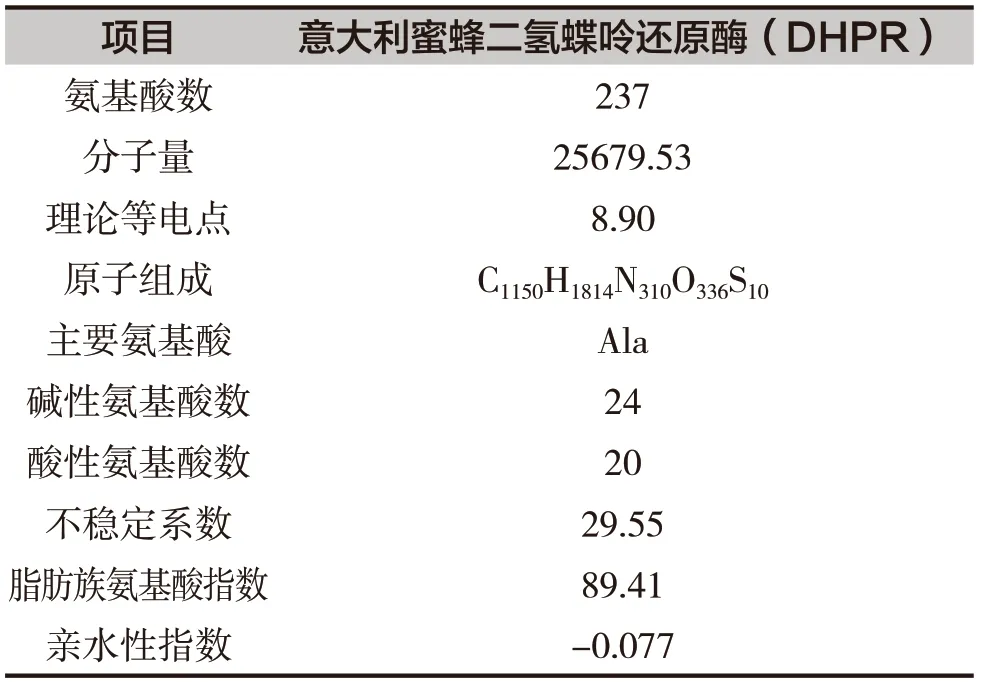
表1 意蜂DHPR的蛋白组分和理化性质
2.3 意大利蜜蜂DHPR蛋白二级结构预测
利用Psipred在线网站(http://bioinf.cs.ucl.ac.uk/psipred/)对西方蜜蜂DHPR蛋白进行二级结构预测,结果如图3所示,DHPR蛋白含有8个α螺旋和8个β折叠结构,以 (beta-alpha)4-(beta-alpha-alpha)2-betabeta的排列方式存在。没有预测到蛋白含有二硫键或跨膜结构域。
2.4 意大利蜜蜂DHPR蛋白三级结构预测
利用SWISS-MODEL在线网站(https://www.swissmodel.expasy.org/)对西方蜜蜂DHPR蛋白进行三级结构预测,选择氨基酸一致性最高为59.83%的秀丽隐杆线虫1ooe.1作为同源模拟的模板,进行DHPR单体的同源建模,得出相关3D模型(图4),8个α-螺旋和8个β-折叠的三级结构,这与哺乳动物DHPR的三级结构的组成相同,也符合该蛋白二级结构预测的结果(图3)。秀丽隐杆线虫DHPR氨基酸序列与人DHPR的同源性为43%,与大鼠DHPR的同源性为49%,它与哺乳动物DHPR/NADH复合物有着显著的结构同源性。因为NADH的结合不会引起DHPR分子构象的任何变化,所以,意大利蜜蜂DHPR蛋白可能具有与哺乳动物DHPR类似的功能。
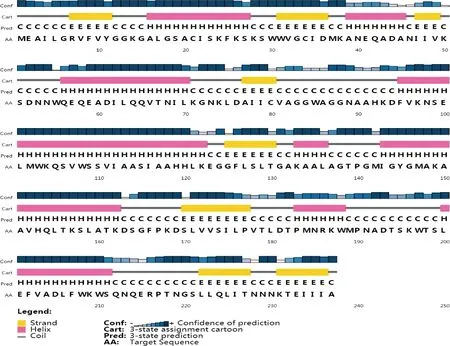
图3 西方蜜蜂DHPR蛋白二级结构预测
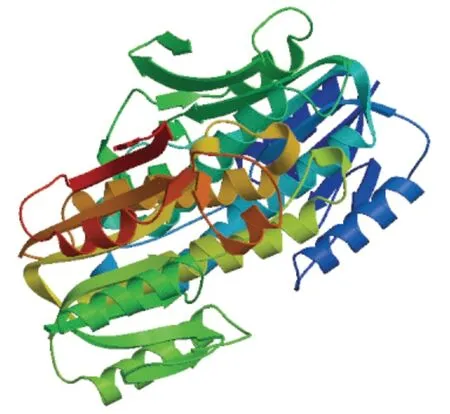
图4 西方蜜蜂DHPR蛋白单体三级结构同源模拟
2.5 意大利蜜蜂DHPR蛋白与其他物种的系统进化树分析
使用软件MEGA 6.0中的最大似然法,将意大利蜜蜂DHPR与其他7个物种DHPR蛋白的氨基酸序列一起构建系统进化树,结果表明:西方蜜蜂DHPR与同为膜翅目的大蜜蜂Apis dorsata和小蜜蜂Apis florea亲缘关系最近,与人类的亲缘关系较远(图5)。此结果为后续开展意大利蜜蜂 DHPR蛋白的功能分析研究提供了参考信息。

图5 基于意大利蜜蜂与其他物种DHPR蛋白氨基酸序列的系统进化树(最大似然法)
3 讨论
蜜蜂在生物学上是全变态昆虫,在农业上是重要的授粉昆虫,在科研中亦是重要的模式生物。目前对昆虫二氢蝶呤还原酶的研究多集中在果蝇和家蚕等其他种类的昆虫上,而膜翅目意蜂二氢蝶呤还原酶的研究却未见报道。意蜂二氢蝶呤还原酶在蛋白质结构和生物学功能方面相对于其他昆虫是否有特别之处,需要科学工作者们做更多的研究与探索。本文利用生物信息学方法对意大利蜜蜂二氢蝶呤还原酶基因进行了系统分析,结果表明,意蜂二氢蝶呤还原酶基因全长2264bp,含有一个714bp的开放阅读框,编码237个氨基酸,属于亲水性蛋白;预测蛋白分子量约为25.67kDa,理论等电点(pI)为8.90,原子组成为C1150H1814N310O336S10;蛋白的二级结构主要由8个α-螺旋和8个β-折叠组成,同源建模了此蛋白质的三级结构,暗示意蜂 DHPR蛋白具有与哺乳动物DHPR类似的功能;使用8种6-丙酮酰四氢蝶呤合成酶氨基酸序列构建系统进化树,意蜂DHPR与大蜜蜂和小蜜蜂的DHPR亲缘关系较近,分析结果与传统的生物学分类结果一致。
本文的研究结果为深入开展意蜂二氢蝶呤还原酶的科学研究提供基础信息,为意蜂该催化酶的克隆分析、分离及纯化提供了参考,也为进一步研究其高级结构与功能关系提供理论依据。本文是基于生物信息学工具对目标基因进行的系统研究,关于意大利蜜蜂二氢蝶呤还原酶的具体生物学功能和表达机制等还需进一步研究。
