多孔炭材料吸附CO2研究进展
2021-03-06张宇航马春慧刘守新
张宇航,李 伟,马春慧,罗 沙,刘守新
(东北林业大学,生物质材料科学与技术教育部重点实验室,黑龙江 哈尔滨 150040)
由温室气体积累导致的全球变暖问题日益成为国际社会关注的焦点。CO2作为主要的温室气体,排放量逐年增加,2016年全球CO2排放总量为406亿吨,预计2050年全球大气中CO2的质量浓度将达到898 mg/m3[1]。由于燃煤发电厂的CO2排放量占总排放量的40%,所以控制发电厂烟道气中CO2的排放至关重要,其主要方法为CO2捕集和封存(CCS)[2]。CO2捕集主要包括:燃烧前捕集、富氧燃烧捕集和燃烧后捕集。其中燃烧后捕集最为常用,主要分为液体吸收法[3]、膜分离法[4]和固体吸附法[5]。固体吸附法由于具有稳定性高、再生能耗低、操作简单、价格便宜且对设备腐蚀性低等优点,应用最为广泛[6]。常用的固体吸附剂有沸石、多孔金属氧化物、金属有机骨架、介孔氧化硅、多孔聚合物材料和多孔炭材料。多孔炭材料不仅具有质轻、比表面积大、化学稳定性和热稳定性高以及价格便宜等特点[7],还具有良好的吸附容量、吸附选择性、吸附循环性以及快速的吸附速率,是最常用的低温(0或25 ℃)CO2固体吸附剂,也是当前CO2吸附研究的重点。目前,多孔炭材料的种类繁多且其用于CO2吸附的机理鲜有研究。因此,本文系统综述了近年来用于CO2吸附的多孔炭材料的种类及其主要制备方法,重点分析了多孔炭材料的结构性质与其CO2吸附性能的关系,总结了多孔炭材料对CO2的吸附机理,最后对该技术面临的问题和未来发展方向进行了展望,旨在为制备高性能CO2吸附多孔炭材料提供合理设计和指导。
1 多孔炭材料种类
1.1 煤/石油焦基活性炭
作为传统化工原料,煤[8]和石油焦[9]价格便宜、含碳量高,并且石油焦还具有灰分和挥发分含量低等优点,从而被广泛用作炭材料的前驱体。Hu等[10]利用石油焦制备活性炭,比表面积可达3 000 m2/g,并具有良好的CO2吸附性能。
煤含有的杂质通常无法从炭材料中去除,从而影响炭材料孔结构的发展。并且煤的成分差异较大,会影响炭材料的性质。因此,为了提高制备炭材料的产率,除炭化外还要对煤和石油焦进行预氧化和活化以用于CO2吸附。Yang等[11]利用HNO3对石油焦炭进行预处理,并活化制备了石油焦基活性炭,该活性炭的CO2吸附容量在100 kPa下可以达到4.13 mmol/g(25 ℃)和6.24 mmol/g(0 ℃)。
1.2 生物质多孔炭
生物质资源被视为可以替代化石原料的绿色资源。较传统石油焦炭而言,生物质活性炭具有孔隙结构易于调控和表面含氧官能团丰富等优点,其用作CO2吸附剂时表现出了高比表面积、发达孔结构、良好吸附容量等性能。生物质原料种类繁多,主要包括木材及木材剩余物[12]、农业剩余物[13]和食物废料[14]等,可以用于制备多种多孔炭材料。
大部分的生物质原料经过简单炭化和活化制备便具有良好的CO2吸附性能。Idrees等[15]以花生废料为原料制备生物质多孔炭,经测试其CO2吸附容量为5.33 mmol/g(100 kPa,0 ℃)和4.24 mmol/g(100 kPa,25 ℃),并且CO2/N2的气体选择性为16。该材料具有大量孔径小于0.80 nm的微孔并且这种孔结构的量与CO2吸附容量呈正相关,所以研究人员认为这种孔径有利于CO2吸附,类似的研究如图1所示。Li等[16]研究发现枣片通过在800 ℃下炭化和化学活化,可以制备出具有微孔或多级孔(微孔/中孔)的生物质多孔炭材料,其微孔孔径主要分布在0.7~0.9 nm,具有很高的比表面积3 337 m2/g;并且这种多级孔结构使得炭材料在常压(100 kPa)和高压(4 MPa)下都有良好的CO2吸附性能,分别为6.40 和22 mmol/g(25 ℃),这表明微孔孔径决定了常压下CO2的吸附性能。
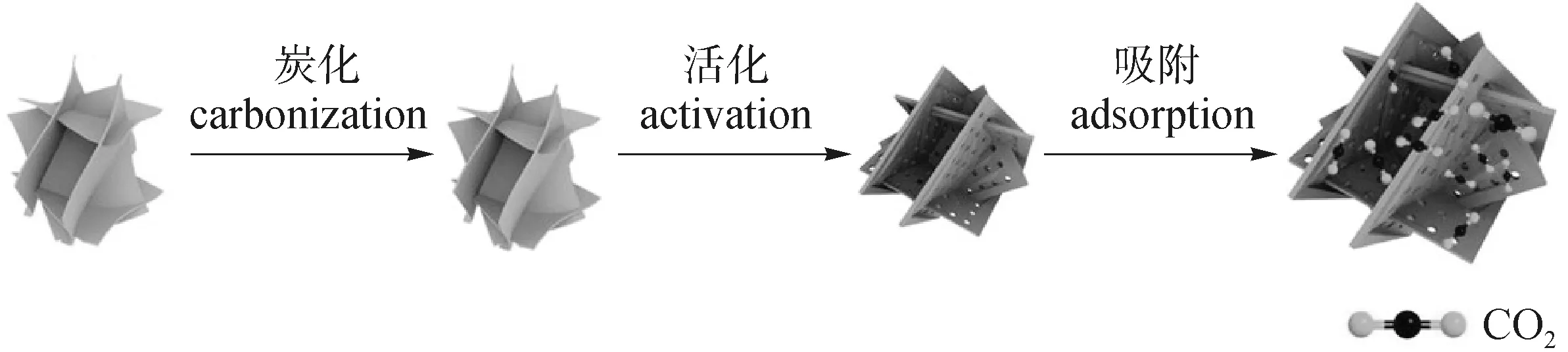
图1 孔径可控的生物质衍生多孔炭合成示意图[16]Fig.1 Schematic illustration of the syntheses of biomass-derived porous carbon with controllable pore sizes[16]
由于许多生物质原料本身含氮,为了进一步提高材料的CO2吸附性能,还会利用含氮试剂(三聚氰胺[17]、尿素[18]等)进行氮掺杂处理。Wei等[19]利用菱角作为碳源,三聚氰胺作为氮源制备出氮掺杂生物质多孔炭。该种炭材料具有很高的比表面积(3 401 m2/g)和含氮量(4.89%),其CO2吸附容量也得到了提高,在100 kPa下达到4.70 mmol/g(25 ℃)和6.00 mmol/g(0 ℃)。Rao等[13]也利用菱角作为碳源,但采用NaNH2作为氮掺杂试剂和活化剂,一步制备出了氮掺杂多孔炭材料。在100 kPa下其CO2吸附容量也可以达到4.50 mmol/g(25 ℃)和6.04 mmol/g(0 ℃)。Han等[14]分别采用甘蔗渣和尿素作为碳、氮源,活化制备氮掺杂生物质多孔炭;该种炭材料孔结构的80%~89%为孔径小于1 nm的微孔,并具有0.6%~3.34%的含氮量,所以其在100 kPa下最高CO2吸附容量达到了4.80 mmol/g(25 ℃)。
生物质原料本身具有各种微观结构,通过简单方法(如高温炭化与活化法、水热法)也可以制备出多种具有特定结构(如片层状[20]、管状[21]、球状[18])的炭材料。如Chang等[21]研究发现柳絮是天然管状结构,并且原料含氮,所以经过简单炭化和化学活化就可以制备出氮掺杂多级孔炭管。其含氮量可以通过活化温度来调控,在100 kPa下CO2吸附容量达到4.05 mmol/g(25 ℃)和6.22 mmol/g(0 ℃)。
现阶段生物质多孔炭的制备技术已经相对成熟,并且具有良好的CO2吸附性能。但这种吸附性能还仅限于实验室研究,其用于大规模吸附CO2的性能还有待考察。同时,生物质多孔炭的物理强度研究较为匮乏,这也对其实际应用有较大影响。
1.3 炭气凝胶
炭气凝胶是一种三维整体式炭材料,具有低密度、高比表面积、丰富的多级孔结构和可调节的表面性质等物理化学特性,被广泛应用于CO2吸附。自从20世纪80年代末首次由Pekala等[22]制备以来,炭气凝胶的生产工艺也不断完善,目前主要由溶胶-凝胶法再经过干燥和炭化制备,并且也可以采用氮掺杂方法进行改性以提高其CO2吸附性能。按照制备原料分类,炭气凝胶主要分为酚醛基炭气凝胶[23]、生物质基炭气凝胶[24]和石墨烯基炭气凝胶[25]。
作为传统的炭气凝胶,酚醛基炭气凝胶是以多元酚和醛类为原料,在碱性催化剂的作用下缩聚制备出的三维网状凝胶。Robertson等[26]利用间苯二酚和甲醛为原料,制备酚醛基炭气凝胶。此类炭材料经过KOH活化后,比表面积、孔容积和微孔率都大幅增加,分别为1 871 m2/g、2.03 cm3/g和87%;并且炭气凝胶以孔径小于1.5 nm的孔结构为主,这也使其CO2吸附容量达到3.00 mmol/g(25 ℃,100 kPa)。为了进一步提高酚醛基炭气凝胶的CO2吸附性能(图2),Jeon等[27]利用相同原料,并以三聚氰胺作为氮源制备氮掺杂酚醛基炭气凝胶。经过测试,炭材料最高含氮量(以质量分数计)为5.54%,当间苯二酚/三聚氰胺的质量比为1 ∶0.3时具有最高的CO2吸附容量2.70 mmol/g(25 ℃,100 kPa)。虽然酚醛基炭气凝胶发展日益成熟,但其成本较高、存在环境污染,并且CO2吸附性能低于其他炭材料,从而导致其商业化受到限制。
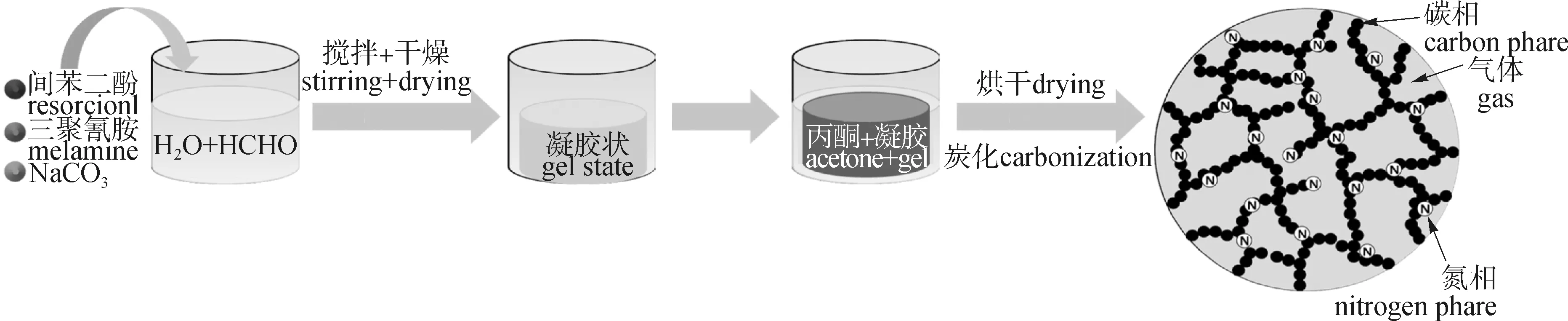
图2 氮掺杂炭气凝胶的制备示意图[27]Fig.2 Schematic diagram of the preparation of N-doped carbon aerogel[27]
生物质资源具有价格低廉、来源广泛和环保等优点,利用其作为原料制备可降解、价廉的生物质炭材料是炭气凝胶目前的主要研究方向。用于制备生物质基炭气凝胶的原料主要为糖类,如纤维素[24,28-29]、壳聚糖[30]等。由于纤维素可以溶解在多种溶剂中,并且纤维素链之间会形成大量氢键而聚集,所以很容易制成凝胶并在炭化后形成多级孔结构,有利于吸附气体。Zhuo等[29]以纤维素作为原料,制备出比表面积为1 364 m2/g的多级孔炭气凝胶,具有良好的CO2吸附性能,吸附量达3.42 mmol/g(25 ℃ 和1.01×105Pa)。这种快速制备多级孔结构的方法也引起了研究人员的关注,Hu等[28]利用相同原料和方法制备了多级孔炭气凝胶,比表面积为496 m2/g、总孔容为0.46 cm3/g、微孔孔容为0.17 cm3/g,CO2吸附容量为3.42 mmol/g(25 ℃,100 kPa);为了提高其吸附性能,又将制备的纤维素气凝胶在NH3气氛下炭化,制成氮掺杂多级孔炭气凝胶,其孔结构得到了明显的发展,且CO2吸附容量提高至4.99 mmol/g(25 ℃,100 kPa)。因此,纤维素基炭气凝胶在吸附CO2方面有很高的应用潜力。
理想的CO2吸附材料应同时具有良好吸附容量、解吸容量和吸附选择性,而功能化石墨烯基炭气凝胶因具有这些特性而被广泛研究。Youngtak等[25]研究出一种由氮化碳功能化的氧化石墨烯炭气凝胶,其具有一定的CO2吸附容量(0.43 mmol/g)和理想吸附溶液理论(IAST)吸附选择性(CO2/N2=113),并且具有良好的吸附循环性能,98%被吸附的CO2通过简单变压就可以解吸。该研究提供了一种制备高循环吸附的炭材料的方法,也拓宽了炭气凝胶的研究范围。
1.4 金属有机骨架衍生炭
金属有机骨架材料(MOFs)作为人工合成的有机-无机杂化晶体材料,具有结构高度有序、比表面积高、孔径可调、孔体积大等优点。得益于其有机配体的高含碳量和有序结构,MOFs可以同时作为模板和前体制备衍生多孔炭材料并广泛应用于催化和气体分离领域。
利用MOFs为模板将合适的碳前体浸渍到MOFs孔道结构中,然后使碳源在相对较低的温度下发生聚合并进行高温炭化,可得到规则有序的多孔炭材料,并且通过控制炭化温度可以调控衍生炭材料的孔结构。Ma等[31]以MOF-5为模板,利用浸渍法添加尿素为氮源,在不同温度下炭化制备金属有机骨架衍生炭材料并用于吸附CO2。随着炭化温度的升高,材料的微孔比表面积增加缓慢(554~601 m2/g),而中孔/大孔比表面积大幅增加(607~1 706 m2/g),其在炭化温度为900 ℃时比表面积最高可达到2 307 m2/g。但比表面积大小对材料的CO2吸附性能影响很小,说明炭材料常压下的吸附性能主要由微孔结构决定。
MOFs直接炭化也可以制备多孔炭材料。由于一些MOFs中存在含氮配体,所以炭化就可以直接得到结构规则的氮掺杂多孔炭,并且某些MOFs材料在溶液中的稳定性较差,通过直接炭化法获得多孔炭的过程要比间接炭化法(MOFs为模板制备多孔炭)更直接、更利于MOFs的结构特征表现在多孔炭材料上。Ding等[32]通过在500~800 ℃下直接炭化等网状的IRMOF-3制备氮掺杂多孔炭材料,未炭化前的MOFs比表面积为1 808 m2/g并具有2.32 mmol/g的CO2吸附容量(0 ℃,100 kPa),炭化后其比表面积下降为1 184 m2/g,但其微孔容积由0.96 cm3/g扩大至2.01 cm3/g,并且含氮量为7.0%,所以CO2吸附容量也提高至3.99 mmol/g(0 ℃,100 kPa)。Pan等[33]通过离子交换将K+引入典型阴离子MOF(bio-MOF-1)中,经过炭化和离子原位活化制备出氮掺杂多孔炭(见图3)。经测试发现,经过原位活化的多孔炭材料具有更高的含氮量(10.16%)和微孔容量(73%),从而具有高CO2吸附容量,在25 ℃、100 kPa条件下达到3.29 mmol/g,且CO2/N2吸附选择性达到99.1。
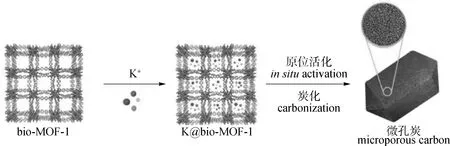
图3 bio-MOF-1和K@bio-MOF-1为前体的衍生多孔炭材料的制备示意图[33]Fig.3 Schematic illustrations for the preparation of porous carbon materials derived from bio-MOF-1 and K@bio-MOF-1 precursor[33]
除了氮含量,MOFs表面的氧含量也会影响材料的CO2吸附能力,Wang等[34]以铝基沸石型MOF(MIL-100AL)为前体,并在700 ℃下按照前体/三嵌段共聚物F127质量比为1 ∶2炭化制备MOF衍生多孔炭材料,这种材料具有高含氧量(39.50%)和大量微孔,其CO2吸附容量可达到4.80 mmol/g(25 ℃,100 kPa)和6.50 mmol/g(0 ℃,100 kPa),并且具有良好的CO2气体选择性,CO2/N2=45、CO2/CH4=14.50(25 ℃,100 kPa)。
1.5 碳纳米材料
1.5.1石墨烯 碳纳米材料指的是分散相尺度至少有一个维度小于100 nm的炭材料,碳纳米材料根据其结构维度主要划分为二维纳米材料、一维纳米材料、零维纳米材料。石墨烯是一种二维片层结构的炭材料,其衍生物氧化石墨烯(GO)[35]是由石墨进行氧化后,再经过片层剥离得到的。GO的结构是由石墨烯结构和含氧基团(羟基、羧基、羰基和环氧基等)共同组成,这一特殊结构使得GO具有较高的结晶度、良好的结构强度和表面功能性,并广泛应用于气体的吸附和分离。同时氧化石墨烯表面的含氧官能团使其具有碱性和亲水性,有利于酸性气体CO2的吸收。目前,氧化石墨烯的主要制备方法是Hummers法[36]:0 ℃下,将石墨和硝酸钠加到浓硫酸中,在搅拌条件下缓慢加入高锰酸钾,反应2 h,再常温搅拌4 h,加水结束反应后加入双氧水除去过量的高锰酸钾,最后水洗烘干得到产物。Ganesan等[37]采用Hummers法制备氧化石墨烯后,再经剥离和KOH活化,所得样品比表面积可达3 240 m2/g,且CO2吸附容量为21 mmol/g(25 ℃,2 MPa)。
用于CO2吸附的GO主要采用胺类改性,Shin等[38]首先利用Hummers法制备GO,在经过聚乙烯亚胺改性后用于CO2吸附,CO2吸附容量和气体选择性CO2/N2分别为0.75 mmol/g(25 ℃,100 kPa)和37.13。Zhao等[39]利用同样方法制备GO,然后使用乙二胺(EDA)、二亚乙基三胺(DETA)和三亚乙基四胺(TETA)对GO进行改性。研究发现:乙二胺改性的GO具有最好的CO2吸附性能,为1.06 mmol/g。An等[40]通过尿素掺杂改性并使用KOH活化制备氮掺杂GO,研究发现:经改性和活化其CO2吸附能力得到了很大提高,吸附容量为3.24 mmol/g(0 ℃,100 kPa)和2.40 mmol/g(25 ℃,100 kPa)。根据扩散模型的计算,石墨烯的片层结构之间的短扩散路径使其具有高的CO2吸附速率,这一性质优于其他炭材料。
1.5.2碳纳米管/碳纳米纤维 碳纳米管(CNTs)是1991年日本电镜学家Lijima发现的一维纳米管状炭材料[41],按照管层数主要分为2类:单壁碳纳米管(SWCNTs)和多壁碳纳米管(MWCNTs)。由于CNTs具有独特的中空结构和许多可结合的活性位点,且机械强度高、稳定性好、易于功能化,也被广泛应用于低温CO2吸附。常用于CO2吸附的CNTs功能化试剂为氮掺杂试剂,主要包括聚乙烯亚胺(PEI)[42]、四亚乙基五胺(TEPA)[43]、尿素[44]和三聚氰胺[45]等。Lee等[42]利用PEI改性MWCNTs,改性后材料的吸附容量提高并具有良好的CO2循环吸附性能。Ye等[43]利用TEPA浸渍制备的氮掺杂CNTs,具有高CO2吸附容量3.87 mmol/g(30 ℃,100 kPa)。
经过Rende等[46]分子模拟研究发现:CNTs吸附CO2不只发生在内外表面,还发生在其内部空间中,并且增加管口直径、提高管口横截面积可以让CO2分子更容易进入管中,从而使CO2在管内更好地分层填充。Omidfar等[44]也进行了类似的研究,制备了不同直径的氮掺杂MWCNTs。经过测试,直径越大的材料CO2吸附容量越高,吸附容量可以由53.9 mg/g提高至64.1 mg/g。这与Rende等的研究结果一致。
随着研究的深入,越来越多新型CNTs被制备并用于CO2吸附。He等[45]将聚多巴胺和三聚氰胺涂在新模板CaCO3上,并加入Fe-Co催化剂活化,制备出氮掺杂CNTs,其CO2吸附容量为4.43 mmol/g(0 ℃,100 kPa)和3.91 mmol/g(25 ℃,100 kPa)。同时,在273 K时CNTs的CO2/N2和CO2/H2的气体选择性分别为18.04和189.65,在298 K时分别为26.64和134.35。Ghosh等[47]以三聚氰胺为原料,利用过渡金属盐(Fe、No和Ni)作为催化剂,合成了首个密封金属的氮掺杂CNTs,并探究过渡金属对CNTs CO2吸附性能的影响(图4)。经过对比高压(<2 MPa)和低压(<0.1 MPa)下的CO2吸收容量可以看出,此类氮掺杂CNTs比原始MWCNTs和纯氮掺杂碳纳米管(NCNTs)具有更高的CO2吸附能力,并且过渡金属的催化性能由高到低依次为Fe>No>Ni。

图4 M@NCNT(M=Fe,Co,Ni)的制备过程示意图[47]Fig.4 Schematic illustration of the preparation process of M@NCNTs(M=Fe,Co,Ni)[47]
碳纳米纤维(CNFs)是介于CNTs和普通碳纤维的一维新型炭材料[48],不仅具有普通碳纤维的低密度和高强度等特性,还具有比表面积大、结构致密性高等优点,可以用作催化剂、电极材料、结构增强材料等。目前部分研究也将CNFs用作CO2吸附剂。Heo等[49]以聚丙烯腈和聚偏二氟乙烯为原料,通过静电纺丝法制备CNFs,并在含有15% CO2的N2模拟烟道气中进行吸附来探究其CO2吸附容量和动态气体选择性,此类碳纳米纤维最高CO2吸附容量为2.21 mmol/g(25 ℃,100 kPa)并且可从上述模拟烟道气中吸附质量分数为2.21%的CO2。
1.5.3富勒烯 1985年,Kroto发现炭的典型同素异形体——富勒烯。富勒烯是由12个五元环和若干六元环组成的笼形全碳单质分子的总称,包括C60、C70等[50],富勒烯及其衍生物也因其独特的结构和稳定性被广泛用于气体吸附。
近年来,利用杂原子修饰富勒烯C60并用于CO2吸附是研究的热点。首先,B掺杂C60是结构上最稳定的富勒烯之一[50]。De Silva等[51]研究掺杂一个B原子的富勒烯BC59的CO2吸附性能,并利用密度泛函理论(DFT)计算在中性和带一个负电荷的情况下BC59的CO2吸附情况。经过计算得到,中性情况下BC59的CO2吸附能为8.54 kJ/mol,只是简单的物理吸附;而带一个负电荷的情况下BC59与CO2之间是化学吸附,并且吸附能为64.52 kJ/mol。Khan等[52]也得到了类似的结论,他们分别在有电场和无电场的情况下,利用DFT来研究P掺杂富勒烯C59P的CO2和N2吸附情况,研究发现:施加电场会将富勒烯的物理吸附转化为化学吸附,从而提高CO2吸附性能,并且富勒烯C59P的CO2吸附能大于N2。由此可知,结合外部电场的P掺杂富勒烯将来可以作为CO2选择性吸附剂。
除了非金属原子的B、P修饰以外,金属原子修饰富勒烯也得到了研究人员的关注。Gao等[53]研究3种金属原子Li、Na和Ca修饰的富勒烯与未修饰富勒烯C60的CO2吸附性能,研究发现:未修饰的C60吸附能力很弱,并且Li、Na修饰对其CO2吸附能力影响不大,而C60用Ca修饰后CO2吸附能力大大提高,一个Ca原子最多可将5个CO2分子吸附在C60上。所以用Ca原子修饰的C60是有效的CO2吸附材料,这进一步拓宽了富勒烯的潜在应用范围。
碳纳米材料具有高含碳量、可控的化学成分和基团、可控的形态学和易于表面改性等优点,所以越来越多的研究者都在设计制备碳纳米材料并用于CO2吸附。
不同种类多孔炭材料的孔隙性能和CO2吸附容量如表1所示。

表1 多孔炭材料的孔隙性能和CO2吸附容量汇总Table 1 Summary of textural properties and CO2 adsorption capacity of porous carbon materials
2 CO2吸附多孔炭材料的制备
2.1 高温炭化与活化法
2.1.1物理活化法 高温炭化法是原料在部分或完全隔绝氧气的高温惰性环境下的热降解过程[60],是制备炭材料的传统方法。由于简单高温炭化法制备的炭材料多数不具有良好的孔结构,所以需要通过活化法造孔。高温炭化与活化法主要用于制备煤/石油焦基活性炭和生物质多孔炭材料。
物理活化法是炭材料与不同的活化剂(O2、CO2、水蒸气等)高温反应活化的方法。当使用O2作为活化剂时,根据反应的焓变O2与碳反应是放热的,这使反应温度和反应速度难以控制,活化剂没有渗透进炭材料内部,只在炭材料的表面快速气化导致了过度燃烧,降低了多孔炭的产率。而CO2和水蒸气与碳的反应是吸热的,因此在外部供热的条件下可以准确控制实验条件,所以许多实验使用CO2和水蒸气作为活化剂制备多孔炭并用于CO2吸附。Vilella等[61]利用椰壳作为原料,900 ℃下通过CO2活化140 min,制备出比表面积、微孔孔容和总孔容分别为1 452 m2/g、0.60 cm3/g、0.65 cm3/g的生物质多孔炭材料,其微孔孔容占总孔容的93.1%。根据Rodríguez-Reinoso等[62]研究表明,使用CO2作为活化剂主要是在炭材料上活化产生微孔结构,而水蒸气作为活化剂时主要是产生中孔和大孔结构。
除了活化剂外,还有其他因素如活化温度和活化时间对炭材料的孔结构也有影响。其中活化温度越高,炭材料表面的挥发性物质越容易挥发;活化时间越长,有机物越容易燃烧。因此,活化温度越高、活化时间越长,制备炭材料的孔隙也越发达。
2.1.2化学活化法 化学活化法是在惰性气氛下前体与化学活化剂反应活化的方法,活化温度一般为450~900 ℃。目前主要使用的化学活化剂有KOH[14-16]、NaOH[63]、K2CO3[64]、ZnCl2[21]、H3PO4[65]和NaNH2[13]等。其中,KOH由于其制备的炭材料具有高微孔率而被广泛使用。根据Lillo-Ródenas等[66]研究发现:KOH作为氧化剂与碳骨架发生氧化还原反应,进行化学活化。碳被氧化成为CO和CO2,进而发展孔结构,同时还有副产物K2CO3形成。最终,KOH会转化为K嵌入到多孔炭孔结构中,在随后的洗涤过程中会被除掉,微孔结构得到发展。Luo等[54]使用杉树皮作为原料,在700 ℃、m(原料) ∶m(KOH) 为1 ∶0.5~1 ∶6条件下进行活化制备多孔炭材料,得到的炭材料比表面积最高为1 552 m2/g,并具有良好的CO2吸附性能,其CO2吸附容量为7.00 mmol/g(0 ℃,100 kPa)和5.20 mmol/g(25 ℃,100 kPa),CO2/CH4的气体选择性分别为7.50(0 ℃)和7.80(25 ℃)。Wei等[55]也使用KOH在600~900 ℃下活化桂圆壳,制备出的多孔炭比表面积高达3 260 m2/g,其CO2吸附容量为5.60 mmol/g(0 ℃,100 kPa)和4.30 mmol/g(25 ℃,100 kPa)。由上述分析可知,使用KOH作为活化剂可以制备出比表面积较高、微孔结构发达的炭材料。
Jagtoyen等[67]研究发现,不同于KOH作为氧化剂进行活化,H3PO4和ZnCl2作为脱水剂参与化学活化。在活化和热处理过程中,存在于颗粒内部的H3PO4和ZnCl2对炭前体产生脱水作用,导致颗粒尺寸减小以发展孔结构。Singh等[56]研究利用ZnCl2在500~700 ℃活化芦竹制备生物质多孔炭材料,经过表征得到炭材料的比表面积最高为1 863 m2/g,并且同时存在大量的微孔和中孔结构;这使得材料在高压下具有良好的CO2吸附性能,吸附容量为13.10和18.20 mmol/g(25和0 ℃,3 MPa)。Yaumi等[65]以谷壳为原料,利用H3PO4进行化学活化制备多孔炭材料,制备出的材料孔结构多为中孔。可以看出,ZnCl2主要活化微孔和孔径小的中孔结构,而H3PO4主要活化孔径大的中孔和大孔结构。
除了上述3种化学活化剂以外,还有K2CO3和NaNH2也被使用。K2CO3是一种比较温和的化学活化剂,也可用作食品添加剂[64]。NaNH2具有良好的亲核性,可以在较低温度下进行活化,其腐蚀性小于KOH,并且由于NaNH2本身含氮,所以既可以作为化学活化剂,又可以作为氮掺杂试剂,降低了炭材料的制作成本。
近年来,也有研究者发展新的化学活化技术。Zhang等[68]研究并使用原位活化法(图5),利用葡萄糖作为原料,通过水热法增加了碳球表面的羧酸基团数量;热处理后掺杂KOH,再通过离子交换形成—COOK 并进行原位活化,制得超微孔碳纳米球。通过测试发现样品的微孔率最高可达95.50%,在典型烟道气条件下的CO2吸附容量为1.58 mmol/g,同时在25 ℃和常压下的CO2吸附容量为4.30 mmol/g。
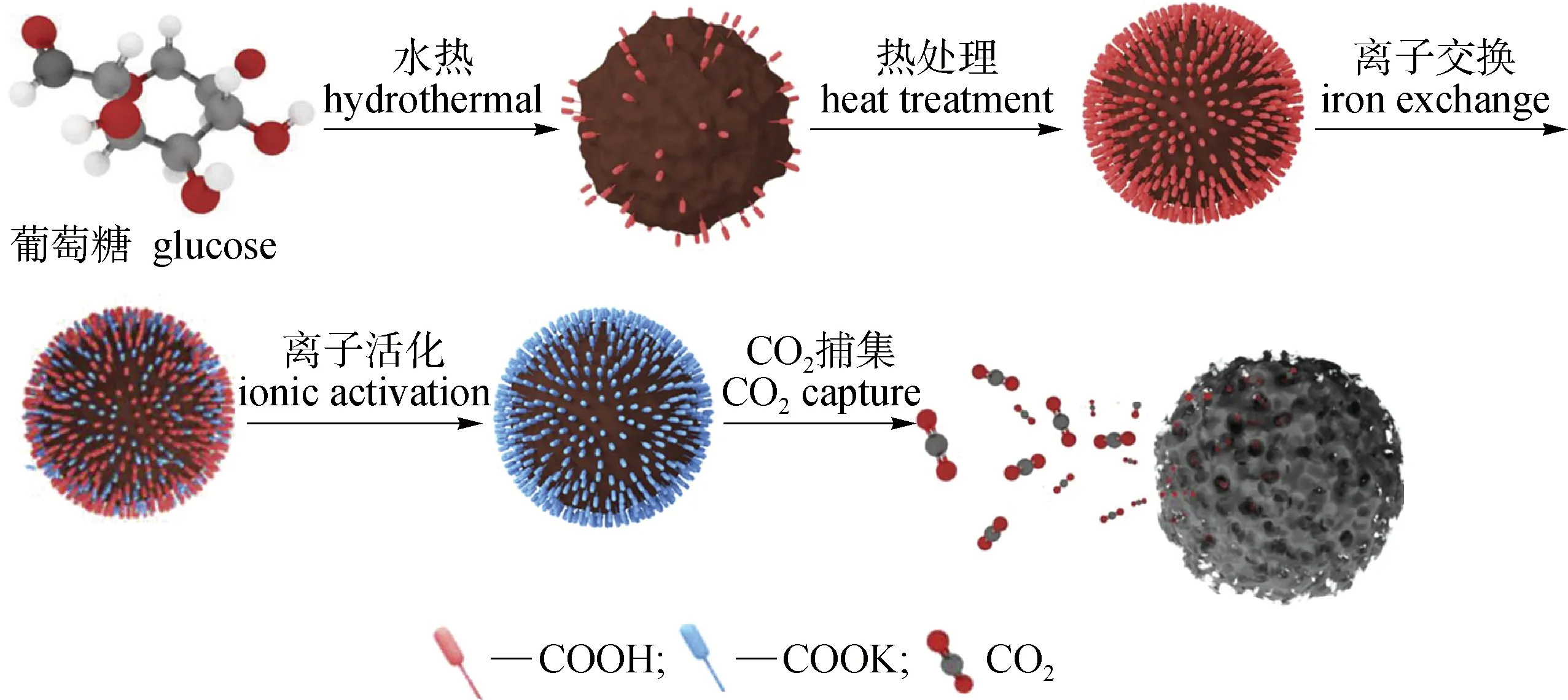
图5 超微孔碳纳米球的合成示意图[68]Fig.5 Schematic diagram of the synthesis of ultramicroporous carbon nanospheres[68]
通过对比物理活化法和化学活化法可以发现,化学活化法的活化温度更低,制备出的炭材料孔结构更发达、含碳量更高,但其腐蚀性更强。2种活化方式都随着活化温度提高,比表面积增加、碳含量降低;随着活化时间的增加,孔结构会更发达、比表面积会降低。虽然活化法的工艺成熟,但由于其原料的多样性和结构的不确定性,难以实现材料结构的精准调控。此外活化法还存在耗能高、环境不友好等缺点。因此,需要继续开发新的活化剂和活化方法来制备结构可控的多孔炭材料,提高其应用潜力。
2.2 水热炭化法
水热炭化法(HTC)简称水热法,是在一定的温度和压力下,原料的有机物质在水中转化为富碳固体产物的一种热化学转换方法[69]。在水热炭化的过程中,水作为溶剂和催化剂,促进了水解反应的进行并且将原料加速分解为较小的生物质低聚物和单体,形成碳质固体。1913年,Bergius首次研究并实现了纤维素在低温水热条件下转化为类煤状物质的工艺[70]。与高温炭化法相比,水热法具有低能耗、高炭化效率、制备材料碳含量高、反应条件温和(一般低于300 ℃)、低污染(没有有机溶剂和气体参与)、制备材料表面有大量附载基团和高湿度原料不需预处理等优点[71],近年来被广泛应用于制备球状生物质多孔炭材料。
研究人员最初采用多糖和葡萄糖等作为水热法原料制备炭材料,并且为了更好地应用于CO2吸附,研究者还会进行活化和氮掺杂处理。Rao等[57]以葡萄糖作为碳源,尿素作为氮源,进行水热反应和KOH活化制备多孔炭材料。通过表征发现:此类炭材料的最高含氮量为12.17%,最高比表面积、微孔孔容和总孔容分别可以达到2 659 m2/g、1.21 cm3/g、1.40 cm3/g。研究还发现,微孔结构和含氮量共同决定了常压下材料的CO2吸附性能,最高CO2吸附容量为6.70 mmol/g(0 ℃,100 kPa)和4.26 mmol/g(25 ℃,100 kPa)。随着研究的发展,水热法的原料也逐渐复杂并开始直接利用废弃生物质资源。Yue等[58]以烂草莓为原料,在180 ℃下进行水热反应12 h并通过KOH活化制备生物质多孔炭,炭材料的最高比表面积、微孔孔容和总孔容分别为1 577 m2/g、0.48 cm3/g、0.68 cm3/g,该材料含有大量孔径小于1 nm的微孔,使其CO2吸附容量可以达到6.35 mmol/g(0 ℃,100 kPa)和4.49 mmol/g(25 ℃,100 kPa)。
影响水热炭制备的因素有水热温度、水热时间和水热压力等。炭材料的碳含量会随着水热温度和压力的升高而增加,而孔结构与水热温度等无线性关系。Yang等[12]以樟脑叶和山茶花叶为原料,利用水热法在180~300 ℃下制备水热炭材料。测试发现水热温度300 ℃时制备的样品具有最高的含碳量(92.14%),但水热温度为240 ℃的多孔炭样品具有最高的比表面积和CO2吸附容量,分别为1 823.77 m2/g 和8.30 mmol/g(25 ℃,400 kPa)。
作为一种环境友好型制备方法,水热法已经广泛应用于炭材料的制备。但还需要寻找一种合适的催化剂来降低水热温度;对于CO2吸附应用来说,水热法还要研究如何实现炭表面化学有效调控以提高CO2吸附选择性。
2.3 溶胶-凝胶法
溶胶-凝胶法是利用高化学活性的化合物作为前体,通过水解、缩合等化学反应以及陈化制备凝胶的方法[72]。溶胶-凝胶法主要用于制备炭气凝胶,其制备炭气凝胶的工艺过程主要有3步[73]:1) 前体在加热的溶剂(一般为水)中均匀混合,经过化学反应形成透明溶胶,溶胶经过陈化得到凝胶体系,此时体系的机械强度得到增强;2) 通过多种干燥手段(常温干燥、冷冻干燥和超临界干燥)除去凝胶中的溶剂;3) 通过高温炭化制得炭气凝胶材料。由于溶胶-凝胶法具有经济环保(使用无污染溶剂)、反应条件温和(室温)和较高的炭产率等优点,并且凝胶化等制备过程质量损失较小而被广泛应用于制备CO2吸附多孔炭材料。Robertson等[26]利用溶胶-凝胶法和活化法制得高孔容积(2.03 cm3/g)和高比表面积(1 980 m2/g)的炭气凝胶。其微孔率高达87%,微孔的尺寸主要集中在0.8和1.2 nm。此炭气凝胶的CO2吸附容量为3.00 mmol/g(25 ℃,100 kPa)。
影响溶胶-凝胶法的因素有很多,如前体与溶剂的浓度比、溶剂的pH值和类型、温度和反应时间等。通过调控这些因素可以控制凝胶的网络结构,并且为了用于CO2吸附也会采取活化法提高炭材料的孔隙率。Dassanayake等[60]以壳多糖为碳源,通过溶胶-凝胶法和冷冻干燥法制备气凝胶,再通过KOH活化制备多孔炭材料并应用于CO2吸附,研究表明:炭材料以微孔为主,其比表面积和微孔孔容积较未活化前分别提高了37和95倍,并且具有良好的CO2吸附能力,吸附容量为3.44和5.02 mmol/g(25和0 ℃,100 kPa)。
溶胶-凝胶法的主要缺点是凝胶干燥过程复杂、孔容易堵塞、制备周期长;在溶剂交换过程中,产物的结构特征和性质不容易控制,这些问题都有待解决。
2.4 模板法
2.4.1硬模板法 模板法是利用模板来有效控制孔结构,制备结构有序、孔径均一材料的方法,主要用于制备金属有机骨架衍生炭和碳纳米材料。硬模板法是将一些具有特殊孔结构的材料作为硬模板,利用渗透技术在其中引入碳前体并经过炭化和除去硬模板得到具有类似结构的多孔炭材料的方法[74]。渗透技术包括湿法浸渍法和化学气相沉积法(CVD)等。1986年,Knox课题组首先提出硬模板法制备多孔炭材料的概念[75],发展至今使用的硬模板包括介孔氧化硅[76]、沸石分子筛[77]、多孔氧化铝、MOF[31]和冰模板[2]等材料。同时,碳源的选择也十分广泛,如酚醛树脂、聚丙烯腈、糠醇、蔗糖、乙烯和中间相沥青等。
自1999年韩国Ryoo课题组首先以MCM-41为模板制备CMK-1,介孔炭材料的研究引起了广泛的关注[78]。其中MCM-41和SBA-15等材料是目前制备介孔炭材料最常用的介孔硅基硬模板。Bajpai课题组[79]以三聚氰胺-甲醛树脂为炭前体、介孔氧化硅MCM-41为硬模板,利用湿法浸渍法制备氮掺杂多孔炭材料,研究发现:所制备出的炭材料中,炭化温度为700 ℃的材料有最高的比表面积和CO2吸附容量,分别为193.28 m2/g、0.93 mmol/g(25 ℃,100 kPa),并且其含氮量高达22.73%。随后Tiwari等[80]又以脲醛树脂为炭前体、介孔氧化硅作为硬模板,通过相同的方法制备氮掺杂多孔炭材料,材料的介孔孔容、微孔孔容和比表面积分别为0.64 cm3/g、0.12 cm3/g和337.07 m2/g;并且同样炭化温度在700 ℃ 的炭材料具有最高的CO2吸附性能,其值为1.30 mmol/g(25 ℃,100 kPa)。上述研究制备出了多种介孔炭材料,虽然其比表面积低于其他炭材料,但具有较低的吸附热(17.36 kJ/mol),易于吸附再生。
除介孔氧化硅以外,沸石也是一种常用的制备有序微孔炭的硬模板剂。1997年,Kyotani课题组最早采用沸石作为硬模板制备微孔炭[81],随后此类炭材料被称为沸石模板炭材料(ZTCs)并应用于CO2吸附。Youn等[77]以Y沸石为模板、糠醇/乙烯为碳源并利用CVD法制备纳米多孔炭材料,其比表面积高达2 563~3 010 m2/g,炭化温度为1 000 ℃的材料高压下具有良好的CO2吸附性能,吸附容量为986 mg/g(25 ℃,4 MPa)。研究还表明:当吸附压力大于2 MPa时,材料的CO2吸附性能主要取决于其比表面积的大小。
随着研究的不断深入,新型的纳米材料MOF和冰模板也被用作硬模板剂。其中,MOF-5[82]、Al-PCP[83]和ZIF-8[84]等是最常用的MOF模板材料。而作为典型的原位合成方法,冰模板是各种硬模板中成本最低、最绿色便捷的一个,其方法是将可溶炭前体溶解在水中并且低温下冻结,通过控制水的凝固过程制备多种不同孔结构的冰模板多孔炭(ITPC)并用于CO2吸附。Roberts等[2]研究利用冰模板和化学活化法,将聚丙烯腈作为前体制备多级多孔炭材料,其比表面积为1 049 m2/g,CO2吸附容量为16.12 mmol/g(25 ℃,1 MPa)。
硬模板法虽然是制备规则孔结构炭材料的有效办法,但受限于模板的形状、合成步骤复杂并且需要使用具有腐蚀性的刻蚀剂(HF和NaOH)移除模板,限制了其应用。软模版法因此得到研究和发展。
2.4.2软模板法 软模板法是通过炭前体与软模板发生相互作用进行自组装,再将组装后的碳前体炭化来制备多孔炭的方法[85]。不同于硬模板法的无机-有机自组装,软模版法的有机-有机自组装一般是碳前体和高分子嵌段共聚物之间通过氢键相互作用、静电相互作用或配位相互作用形成前体/表面活性剂的中间相,中间相进一步缩聚再炭化得到有序多孔炭材料。
使用软模板法需要考虑2个因素:1) 碳前体不仅可以和软模版剂形成有序结构,自身还能相互交联形成稳定的聚合物网络,在高温移除模板后,结构不坍塌。酚醛树脂[86]、脲醛树脂[87]和聚吡咯[88]等由于既可以和软模板发生剧烈相互作用,又可以自身聚合形成高分子结构而被广泛使用,并且脲醛树脂和聚吡咯本身就是含氮前体,也有利于CO2吸附;2) 要选择适合的软模版剂。目前软模板的研究主要采用两亲超分子表面活性剂,如三嵌段共聚物F127(PEO106-PPO70-PEO106)[86,89-90]和P123(PEO20-PPO70-PEO20)[88]等。
随着研究的深入,使用软模版法制备CO2吸附炭材料也在不断创新。如图6所示,To等[88]报道了一种利用软模版法将吡咯单体和软模版P123共组装,成功合成了氮掺杂多级多孔炭材料。经测试发现:材料具有高度有序的多级孔结构,并且较低的炭化和活化温度使材料形成了大量的超微孔结构(孔径小于0.50 nm)和CO2的氮结合位点,这增强了炭材料对CO2的吸附选择性,其气体CO2/N2吸附选择性为124。Yu等[89]利用六亚甲基四胺代替甲醛与间苯二酚反应制备含氮树脂,加入F127作为软模板、乙二胺为氮源,并在100 ℃下水热炭化,制备出氮掺杂有序介孔炭并用于CO2吸附,研究表明:介孔炭最高CO2吸附容量和选择性分别为3.16 mmol/g(25 ℃,95 kPa)和28.34,并且这种方法也可以用于含氮有序介孔炭的大规模生产。
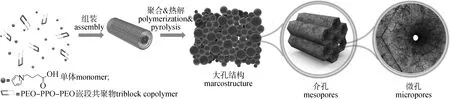
图6 氮掺杂多孔炭材料的合成和多级多孔结构示意图[88]Fig.6 Schematic illustration of the synthesis and the hierarchical porous structures of the nitrogen-doped porous carbon materials[88]
与硬模板法相比,软模板可以在炭化过程中除去,所以软模板法具有步骤简单和污染小等优点,这也使软模板法被认为是制备炭材料和设计材料孔结构最准确的方法。但是软模板法还存在产量低、价格高和软模板材料有限等缺点,这些都有待改进。
3 多孔炭材料吸附CO2的机理
3.1 孔结构
多孔炭材料的孔结构通过物理吸附法吸附CO2,其主要影响因素包括比表面积、孔径、孔容积等。Wei等[90]研究发现竹炭常压(273 K和100 kPa)下的CO2吸附能力与比表面积和总孔容积变化无线性关系;但对不同孔径下孔容积和CO2吸附之间的关系进行研究发现,孔径在0.33~0.82 nm内的微孔容积与CO2吸附性能具有良好的线性关系,且线性相关系数(R2)为0.98。进一步通过CO2吸附容量图和微孔孔径分布图分析得到,0.55 nm处的孔容积(V0.55)越高,CO2吸附量越大。由于样品Bamboo-3-873(活化比m(KOH)/m(C)=3、活化温度873 K)同时具有最高的V0.55和最高的CO2吸附量,表明孔径为0.55 nm的孔结构对于CO2的吸附具有最重要作用,即炭材料的比表面积和总孔容积不是CO2吸附的主要影响原因,而特定孔径及其对应孔容积才是主要的影响因素。并且在常压或者低压下CO2的吸附主要利用孔径在0.82 nm以下的孔结构,其中孔径为0.55 nm的孔结构最利于吸附。
Li等[16]、Presser等[91]、Shao等[92]和Liu等[93]也得到了类似的结论。Liu等[93]通过模拟发现由于CO2与孔壁的相互作用,使得孔径小于0.70 nm的孔吸附的CO2分子更多。Presser等[91]制备出炭化物衍生活性炭,通过研究发现具有最大总孔容积(1.61 cm3/g)和最大比表面积(3 101 m2/g)的炭材料在常压下的CO2吸附容量并不是最高,而孔径小于0.80 nm的炭材料具有更高的CO2吸附性能,并且孔径在0.50 nm的炭材料具有最高的CO2吸附容量,这也和Wei等的实验结果相吻合。
上述结论是在低压或者常压(10~100 kPa)下得到的,之后也有学者就高压下的吸附进行探讨。Hu等[10]利用KOH活化石油焦制得活性炭,并通过淬火固体密度泛函理论(QSDFT)分析其在不同吸附压力(0.1~1 MPa)下,孔结构对CO2吸附性能的影响,研究发现:吸附压力为0.1 MPa时,孔径在1 nm 以下的活性炭有更好的CO2吸附性能,与前人的结论一致;随着吸附压力增加到1 MPa时,孔径在1~4 nm 的活性炭具有更好的CO2吸附性能。根据CO2填充理论分析得到,在吸附压力为0.1 MPa时孔径小于1 nm的微孔容易得到填充;而随着吸附压力的提高,更大孔径容易得到填充。所以吸附压力越高,孔径越大的孔结构更易于吸附CO2,这也是炭材料高压下的CO2吸附机理。
3.2 表面化学性质
3.2.1概述 利用多孔炭材料的表面化学性质吸附CO2,主要是通过化学吸附提高炭材料的CO2吸附量。将杂原子N[94]、O[76]或S[95]引入碳骨架,由于杂原子具有与碳原子不同的电负性,可以改变材料的表面化学性质和碳骨架周围的电子云密度,从而改变CO2分子与炭材料表面之间的相互作用[96],这种相互作用方式就是化学吸附。
3.2.2氮掺杂
3.2.2.1酸碱作用 目前,氮掺杂改性用于提高多孔炭对CO2吸附性能的报道较多,主要的氮掺杂试剂包括尿素、三聚氰胺和聚乙烯亚胺等。由于CO2分子是由1个带正电的碳原子和2个带负电的氧原子构成,碳原子具有缺电子性质,所以CO2被视为是一种弱路易斯酸性的气体。掺杂进入碳骨架的氮原子具有负电子并表现为供电子行为,所以被认为起到路易斯碱的作用[97]。根据路易斯酸碱作用的原理,含氮基团(路易斯碱)与CO2分子(路易斯酸)之间可以发生酸碱相互作用,从而提高炭材料对CO2的吸附性能。Ma等[31]以金属有机骨架(MOF-5)为模板,制备出纳米孔炭材料通过尿素进行改性并通过第一性原理计算研究表面含氮基团与CO2气体的相互作用机理(图7),发现炭材料表面吡啶基团与CO2分子发生路易斯酸碱相互作用,结合能21.26 kJ/mol。

图7 CO2与基团功能化表面的分子相互作用[31]Fig.7 Molecular interaction of CO2 with group-functionalized surface[31]
3.2.2.2氢键作用 含氮基团与CO2分子的酸碱作用不能解释所有的吸附现象,于是学者们从别的角度开始探讨。Lin等[98]以聚苯胺为碳前体、KOH为化学活化剂,在不同的温度下制备出氮掺杂多孔炭,样品AC-1-200-600(KOH/原料质量添加比为1)比AC-3-200-600(KOH/原料质量添加比为3)有更高比表面积和氮含量,但其CO2吸附容量却比后者小,这与物理吸附原理和酸碱作用相悖。分析发现:炭材料的CO2吸附容量与其N/C质量比无线性关系,但与H/C质量比呈正相关,所以C—H基团在炭材料吸附CO2时起到十分重要的作用,C—H基团与CO2分子的作用方式是氢键作用(C—H…O)。
类似的还有Xing等[99]的研究,为了解释氮掺杂炭材料吸附CO2气体的氢键作用机理,引入了一种含有5种不同类型含氮官能团(吡啶氮、吡咯氮、石墨氮、氰基氮和氧化氮)的氮掺杂炭表面模型(NCSM),并引入纯炭表面模型(CSM)作为对比,再通过密度泛函理论对这两种多孔炭模型的不同类型H与CO2的作用进行分析。如图8所示,研究发现氢键作用除了上述实验的C—H…O类型以外,氮掺杂炭材料还有N—H…O氢键类型。通过计算,氢键在不同位置的结合能是不同的,并且结合能越大、吸附亲核性越强。NCSM-CO2模型的平均结合能为7.84 kJ/mol,CSM-CO2模型的平均结合能为1.26 kJ/mol,说明NCSM所形成的氢键要强于CSM,即N—H…O氢键要强于C—H…O氢键。同时,形成NCSM-CO2配合物的位置有8个,而形成CSM-CO2配合物的位置只有7个。上述两点都说明了NCSM的CO2吸附性能要高于CSM,即氮掺杂后的氢键作用提高了炭材料的CO2吸附性能。

图8 氮掺杂炭表面(a)、纯炭表面(b)的理论模型及不同吸附点的氢键能(c)[99]Fig.8 Theoretical models of N-doped carbon surface(a) and pure carbon surface(b) and hydrogen bond energies of different adsorption sites(c)[99]
3.2.2.3静电作用 由于氮掺杂引入极性基团导致碳骨架局部极化和电荷分离,使得多孔炭表面具有极性并产生静电场梯度[100]。CO2分子具有很大的电四极矩,这使其在氮掺杂炭材料表面的静电场中产生静电作用,从而提高炭材料对CO2的吸附性能。
Sun等[101]利用密度泛函理论来研究CO2分子在氮掺杂多孔炭表面的吸附机理,发现多孔炭表面的多种类型氮原子(N-5、N-6)通过其静电作用增强CO2的吸附性能,其他研究者也得到了类似的结论[102-104]。
3.2.3其他掺杂 其他的非金属掺杂包括含氧基团—OH、—COOH和含硫基团等。Liu等[93]通过建立独立的功能化孔结构模型,并利用巴德(Bader)电荷分析和蒙特卡洛(Monte Carlo)模拟研究含氧官能团在CO2吸附中的作用机理,结果发现:含氧官能团使得炭表面的电子密度变大,静电吸附的CO2分子增加;并且被吸附的CO2分子并排填充在孔结构中,提高了炭材料的吸附能力。Wang等[64]以酪蛋白作为碳源、K2CO3作为化学活化剂,制备出含氧氮掺杂多孔炭。经过密度泛函理论计算,—OH基团与含氮基团通过氢键作用提高了材料的CO2吸附性能。
除了非金属掺杂外,还有部分研究者进行金属掺杂,如Ca[105]、K[106]和Li[107]等。这些掺杂方式主要通过改变炭表面的电荷分布来改变多孔炭的堆积结构,这也提高了多孔炭材料对CO2的吸附性能。
4 结 语
在过去的几十年中,多孔炭材料的制备及其CO2吸附应用已经得到了充分的研究和快速的发展。本文系统总结了多孔炭材料的制备方法,并着重分析其结构特征与CO2吸附性能之间的关系。总体而言,CO2的吸附主要来自于1 nm以下微孔,并且多级孔结构可以缩短吸附路径、提高吸附速率。同时杂原子掺杂可以有效提高炭材料吸附性能,所以制备具有大量超微孔/多级孔及高含氮量的多孔炭材料是以后CO2吸附研究的关键。
尽管多孔炭材料吸附CO2研究已有很大进展,但依然存在一些问题,今后要展开以下几方面的研究:1) 对于利用生物质原料制备多孔炭材料需要更温和的化学试剂,应考虑改善制备活化条件,多采取一步制备法来节省反应能耗和减少污染。虽然生物质多孔炭材料已经具有很高的CO2吸附容量,但其吸附选择性和吸附速率等性能还低于其他炭材料,应进一步研究生物质炭复合材料来改进其性能。对于新型炭材料(MOF衍生多孔炭和碳纳米材料)具有巨大的应用前景,还要控制其纳米结构的有序性并探索高效的新型合成技术。2) 由于炭材料表面的复杂性,其表面化学性质对CO2的准确吸附机理仍存在争议,所以未来应该继续吸附机理的研究,为新材料的设计提供理论基础。3) 炭材料已经具有合成烟道气中的高CO2吸附选择性,应多进行炭材料在实际烟道气其他组分(H2O、NOx和SOx)中的稳定性和可重复利用性研究。并且多孔炭材料常用作低温CO2固体吸附剂,其CO2高温吸附研究较少,应研究提高多孔炭材料的吸附温度以用于实际的高温烟道气。4) 目前CO2吸附应用仅限于理想条件下的实验室规模,对于大规模合成炭材料的成本和可行性也是以后研究的重点之一。5) 除了从工厂烟道气吸附CO2外,未来应考虑研究制备用于空气直接捕获技术的低浓度介质多孔吸附炭材料。6) 未来的另一个研究重点应该是开发新技术,将吸附的CO2转化为可再生能源,如甲醇、乙醇等化学品。随着上述问题的解决,多孔炭材料的种类和制备方法将会不断地拓展,其吸附CO2的研究也一定会向着更加完善的方向发展。
