EBV 阳性胃淋巴上皮瘤样癌的诊治进展
2021-03-06崔芷萌
崔芷萌,任 刚,蔡 嵘
(1.上海交通大学医学院附属新华医院放射科,上海 200092;2.上海交通大学医学院附属瑞金医院放疗科,上海 200025)
胃淋巴上皮瘤样癌(lymphoepithelioma-like gastric carcinoma,LELGC)是一类罕见的胃癌,占胃癌的1%~4%[1],其具有独特的临床病理特征,包括伴淋巴细胞广泛浸润、肠型胃癌多见、中老年男性多发、好发于近端胃和残胃等[2]。1976 年,该肿瘤的病理形态特征首次被报道,作者将其描述为伴有淋巴间质的癌[3]。2010 年WHO 消化道肿瘤分类建议,使用“伴有淋巴样间质的胃癌”为其命名,并被将其单独列出[4]。LELGC 分为2 个亚型,即EB 病毒(Epstein-Barr Virus,EBV) 感染阳性癌和高频微卫星不稳定性癌。超过80%的LELGC 与EBV 感染相关[5]。目前,关于EBV 阳性LELGC 的内镜及影像学表现,国内外文献报道较少。EBV 阳性LELGC 的内镜及影像学表现与普通型胃腺癌、胃肠道间质瘤、胃部异位胰腺等有所重叠,导致了该病患者在术前确诊困难。由于EBV 阳性LELGC 患者的预后较普通型胃腺癌患者好,因此,熟悉EBV 阳性LELGC 患者的内镜、影像学表现及临床、病理特征,对患者的术前诊断及后续治疗非常重要。本文将着重对EBV 阳性LELGC 患者的内镜及影像学诊断及相关研究进展进行总结,以期提高医师对该疾病的认识。
EBV 阳性LELGC 的发生机制、病理特征及临床表现
一、发生机制
EBV 感染胃黏膜的机制目前尚存在争议,可能涉及以下2 种机制。①EBV 直接感染胃上皮细胞。由于胃黏膜上皮缺乏EBV 受体CD21,该感染过程可能是通过一种未知的上皮特异性EBV 结合受体来介导的[6]。②EBV 间接感染胃上皮细胞。EBV 主要通过包膜糖蛋白gp350 与B 细胞表面受体CD21 结合而感染B 细胞,再通过细胞间直接接触感染胃上皮细胞[7]。EBV 感染人体后处于一种潜伏感染状态,并表达EBV 编码的小RNA (Epstein-Barr virus-encoded small RNA,EBER)、潜伏膜蛋白2A (latent membrane protein 2A,LMP2A)、EBV 核抗原1 (EBV determined nuclear antigen 1,EBNA1)等产物[8-9]。在有外界因素诱导(如经常摄入过咸的食物或暴露于木粉等引起胃上皮细胞损伤) 或自身免疫功能下降的情况下[10],EBV 大量增殖,激活癌基因或者导致抑癌基因突变,诱发肿瘤。
二、临床表现
LELGC 好发于中老年人,平均发病年龄为45~59 岁[11],男性多发,男女发病比例约为2∶1,可能与患者的职业、生活习惯及激素水平有关[12]。LELGC 发生部位多见于近端胃(即胃体、贲门及胃底),部分见于残胃、胃窦。研究发现,残胃是EBV 阳性胃癌的危险因素[13],残胃中损伤的胃黏膜或胃内微环境变化可能参与了LELGC 的发生、发展。LELGC 患者的临床表现不具有特异性,多表现为上腹痛,部分患者可出现呕血、黑便、吞咽不适[14]。
三、病理学特征
1.大体及镜下表现:大体上,肿瘤好发于近端胃,以单发为主,最大径约1.5~7 cm[15]。多数呈溃疡型,边界较模糊,切面灰白灰红,质实。少数呈隆起型,表面污秽,切面灰红,质脆[16]。在光学显微镜下观察,肿瘤细胞主要呈条索状、巢状、腺管样或单个散在排列,癌细胞呈多角形、卵圆形或梭形;细胞质淡染,边界不清,嗜双色性或碱性,呈合胞体样生长;细胞核呈空泡状,核膜厚,核仁明显,偶见核分裂象,间质可见大量的淋巴细胞、部分浆细胞、嗜酸性粒细胞及少量中性粒细胞浸润,常见淋巴滤泡形成,纤维组织少见[17],且浸润的淋巴样细胞数量明显超过肿瘤细胞数量,肿瘤组织以推挤式浸润生长为主,形成界限分明的肿瘤边缘,具有特征性。
2.免疫组织化学(免疫组化)标志物:肿瘤细胞的免疫组化特征性表现为,角蛋白(cytokeratin,CK)、上皮膜抗原(epithelialmembrane anligen,EMA) 呈阳性,淋巴细胞呈CD3+、CD4+、CD8+、CD20+,且以CD3+、CD8+淋巴细胞浸润为主[18]。EBER 原位杂交法检测显示,肿瘤细胞核呈阳性,而周围胃黏膜及间质淋巴细胞均为阴性[19]。
EBV 阳性LELGC 原发于胃上皮组织,肿瘤组织呈膨胀性生长。当肿瘤浸润胃壁黏膜下层,通过淋巴细胞反应诱导形成黏膜下肿物时,其影像学表现具有一定的特点。但研究报道[20]显示,仅有<10%的EBV 阳性LELGC 表现为黏膜下肿物。近年来,EBV 阳性LELGC 主要采用胃镜、超声胃镜、CT等检查进行诊断,PET-CT 检查应用较少,而其MRI、超声造影等影像学表现未见报道。
EBV 阳性LELGC 的胃镜表现
胃镜检查在消化系统疾病诊断中应用范围相当广泛,可对病变进行全面观察,直观了解病灶的位置、形态及胃黏膜情况,同时可对病灶行活检,为疾病的术前诊断提供病理学支持。但胃镜检查为有创操作,且取材具有一定局限性。
早期EBV 阳性LELGC 胃镜下多呈浅表凹陷型肿块伴中心溃疡[19,21];进展期EBV 阳性LELGC 多表现为溃疡型肿块,由于淋巴细胞广泛浸润,病灶进一步增厚,常浸润达浆膜层。少数癌肿表现为黏膜下肿物,呈隆起型,伴中央凹陷或浅溃疡形成(见图1A),边界尚清晰[22-23]。
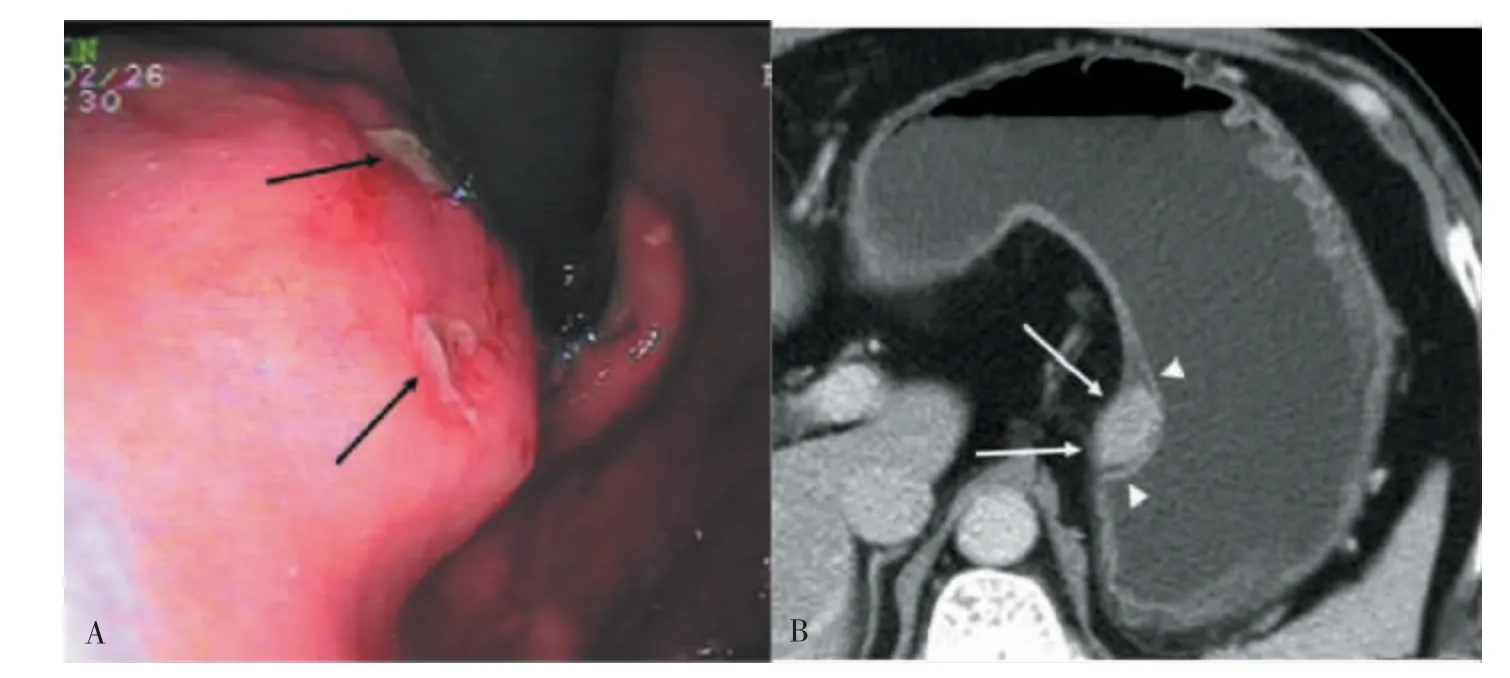
图1 表现为黏膜下肿物的EBV 阳性胃淋巴上皮瘤样癌的胃镜及增强CT 表现
由于肿瘤表面存在正常黏膜,导致胃镜下常规活检很难取到肿瘤组织,难以明确诊断。仅通过胃镜表现很难区分表现为胃黏膜下肿物的EBV 阳性LELGC 与其他胃黏膜下肿瘤(如胃肠道间质瘤、胃部异位胰腺等)。在胃镜下观察,胃间质瘤好发于胃底、体部,肿瘤表面光滑或伴有糜烂;胃部异位胰腺好发于胃窦,表面有脐样凹陷。此外,若胃镜下表现为胃黏膜下肿物,但活检结果为腺癌,这一现象可能提示EBV 阳性LELGC 的诊断[24]。
EBV 阳性LELGC 影像学表现
一、超声胃镜表现
超声胃镜结合了胃镜与超声的双重功能,被认为是诊断胃黏膜下肿瘤的首选方法,具有较高的灵敏度和准确率。超声胃镜既可观察病变的形态,又能根据病变内部回声特点等声像特征对病变的性质及起源作出诊断,并为治疗方法的选择提供参考。
EBV 阳性LELGC 超声内镜下表现为黏膜下肿物时,常起源于黏膜下层或固有肌层,呈低回声团块,回声欠均匀,边缘略呈分叶状,边界尚清[3,22,25],与其他常见的黏膜下肿物鉴别困难。超声胃镜下观察,胃间质瘤多为起源于固有肌层,表现为向肌壁内或腔内生长的低回声病灶;胃部异位胰腺多起源于黏膜下层,呈低、中等回声或混合回声[26],据此有助于鉴别。
二、CT 检查表现
CT 检查作为临床上常用的影像学诊断方式之一,具有扫描快、扫描范围广、减少肠道气体干扰等优点,其在EBV阳性LELGC 诊断中有着独特的优势。多期增强CT 扫描可很好地显示肿瘤的大小、发生部位、生长方式、有无出血和坏死、侵犯层次及其与临近脏器的关系、淋巴结转移情况等,还能显示肿瘤的血供情况,动态观察肿瘤的强化模式,为判断病变性质、进行肿瘤鉴别诊断、选择临床诊疗方式提供更多信息,对后续进一步治疗有指导意义。随着CT 三维重建技术的不断提高,多平面重建(multiplanar reformations,MPR)技术开始被运用到EBV 阳性LELGC 的诊断中,该技术可从多个平面对病变进行观察,能更准确地判断肿瘤的起源部位、肿瘤与周围组织的关系以及是否有临近脏器侵犯等情况。
1.EBV 阳 性LELGC 的CT 表 现:EBV 阳 性LELGC 的CT 图像表现具有多样性,当病灶表现为局灶性或弥漫性胃壁增厚,与普通型胃癌鉴别困难。早期EBV 阳性LELGC 最常见的CT 图像表现局灶性黏膜增厚,表面略凹陷 (见图2A)[20],病变的外边界光滑,周围脂肪间隙清晰,增厚的胃壁不显僵硬,极少出现胃腔狭窄;增强CT 扫描图像显示增厚的黏膜伴局部强化,正常胃壁的低密度带突然终止于病变边缘[27]。进展期EBV 阳性LELGC 在CT 图像上多表现为胃壁广泛增厚(见图2B),小部分表现为胃壁突向腔外的隆起型肿块(见图3),病变累及浆膜,周围脂肪间隙模糊[27],极端膨胀性生长的巨大肿块可能是晚期EBV 阳性LELGC 的特征性形态表现。EBV 阳性LELGC 患者很少出现肿瘤的远处转移及淋巴结转移,该特征可用于与普通型胃癌的鉴别诊断。有文献[28]报道,EBV 阳性胃癌的淋巴结转移发生率低于普通型胃癌,且转移淋巴结以均匀强化为主[20]。此外,Maeda等[27]的研究表明,EBV 阳性LELGC 患者转移淋巴结直径均大于10 mm。EBV 阳性LELGC 患者发生远处转移较罕见,可能与大量淋巴细胞反应及肉芽肿反应而阻止肿瘤穿透胃壁有关[29]。但该肿瘤出现胃周浸润并不少见,Kim 等[20]分析了186 个病灶后发现,EBV 阳性LELGC 的胃周浸润发生率高达51.6%。
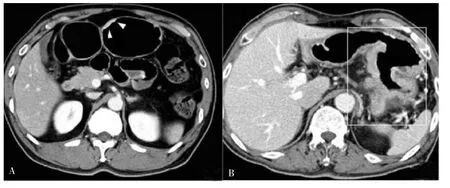
图2 早期、进展期EBV 阳性胃淋巴上皮瘤样癌的常见CT 表现

图3 进展期EBV 阳性胃癌的少见增强CT 表现
少数EBV 阳性LELGC 表现为黏膜下肿物 (见图1B),病灶在CT 图像上呈结节状软组织密度影,以腔内生长为主,厚度/宽度比值较大(0.23~0.41)[30-31]。黏膜下肿物的形成可能与EBV 阳性LELGC 侵犯胃黏膜下层,发生淋巴细胞反应有关[24],而肿瘤的厚度代表了其膨胀性生长方式。CT 平扫图像上,黏膜下肿物的密度不均匀,CT 值为25~48 HU,伴有中央溃疡,溃疡边界清晰,基底部不规则,边界略微隆起;增强CT 扫描图像上,病灶呈均匀或不均匀强化,以不均匀强化为主,不均匀强化者与其内部坏死或囊性区域有关,强化程度为中度强化[14]或明显强化,动脉期CT 值为50~100 HU,门脉期为76~124 HU,强化程度在门脉期强化达到高峰[30],肿块表面被覆黏膜也有强化[24]。
2.鉴别诊断:EBV 阳性LELGC 较胃间质瘤、胃部异位胰腺发病率低。凭借CT 表现对区分EBV 阳性LELGC 与胃间质瘤、胃部异位胰腺有一定的提示作用。文献报道,胃部异位胰腺、胃间质瘤多呈圆形,而EBV 阳性LELGC 多呈卵圆形,三者的厚度/宽度比值[31-32]分别为0.34~0.65、0.51~0.82、0.23~0.41,有一定的鉴别价值。其次,不同于EBV 阳性LELGC 好发于近端胃及残胃,胃部异位胰腺多位于胃窦部,以腔内生长为主,而胃间质瘤瘤好发于胃体部,以腔内腔外混合生长为主,有助于鉴别。
三、PET/CT 检查表现
PET/CT 多应用于原因不明的全身多处病变的诊断、病灶良恶性鉴别、转移及复发监测等。因其费用昂贵,PET/CT应用受限。文献[33]报道,PET/CT 有助于评估LELGC 患者的远处转移或复发,尤其是对晚期LELGC 患者具有较高的诊断灵敏度(85%)。PET/CT 检测LELGC 患者远处转移或复发的灵敏度、特异度均很高(分别为100%、100%),对淋巴结转移的灵敏度较低(47.8%),但特异度很高(96.3%)。
EBV 阳性LELGC 的治疗及预后
目前,EBV 阳性LELGC 的主要治疗手段为胃镜下黏膜剥脱术或根治切除术,化疗为辅助治疗[34]。研究[35]表明,EBV阳性是LELGC 患者预后较好的独立预测因素之一。与普通型胃腺癌组相比,EBV 阳性LELGC 组肿瘤分期较低,同分期肿瘤直径较大[普通型胃腺癌直径为(2.80±1.3) cm,而EBV 阳性LELGC 直径为(5.00±2.10) cm],淋巴结转移率较低(71.43%比38.98%),程序性死亡受体-配体1(programmed death-ligand1,PD-L1)阳性表达率高(21.43%比88.89%),生存质量更好,5 年无病生存率更高 (96.2%比58%)[36-37]。EBV 阳性LELGC 患者良好的预后可能与肿瘤间质淋巴细胞广泛浸润伴反应性滤泡形成有关,其可刺激机体对肿瘤细胞产生有组织的免疫应答,促进细胞免疫以清除肿瘤细胞,限制病变发展[31]。
由于EBV 阳性LELGC 具有独特的免疫微环境,肿瘤细胞巢伴有丰富的淋巴细胞浸润,患者有望从免疫治疗中获益。程序性死亡受体1(programmeddeath-1,PD-1)表达于活化T 细胞、活化B 细胞、单核细胞中,与表达于肿瘤细胞、树突细胞、巨噬细胞等表面的配体PD-L1 结合后,可抑制抗原特异性T 淋巴细胞活化而下调细胞免疫,使肿瘤细胞发生免疫逃逸。因此,PD-1/PD-L1 作为EBV 阳性LELGC 的潜在治疗靶点,未来可能有较好的治疗前景[38]。
小 结
总之,EBV 阳性LELGC 的发病率低,但在与早期普通型胃癌、胃肠道间质瘤、胃部异位胰腺等鉴别诊断中应该被考虑。目前,EBV 阳性LELGC 的术前诊断困难,大多数病例通过肿瘤手术后病理诊断及免疫组化检测确诊。患者的发病年龄、性别等临床特点,黏膜下肿瘤的胃镜发现和腺癌的活检结果之间的差异,CT 图像上肿瘤的发病部位、厚度/宽度比值等,可以提示EBV 阳性LELGC 的诊断。为了提高EBV 阳性LELGC 术前影像学诊断准确率,临床仍需收集更多的影像学资料,进一步研究。
