乌头汤对痛性糖尿病周围神经病变大鼠疼痛行为及KCNQ2/5通道蛋白表达的影响
2021-03-05马运涛祁乐
马运涛 祁乐
(1天津中医药大学第一附属医院,天津 300381;2天津中医药大学)
糖尿病周围神经病变(DPN)是糖尿病常见的慢性并发症,也是糖尿病患者致残的主要原因之一。其中约1/3的患者会发生痛性DPN(PDPN)〔1〕,以肢体远端受累为主,可有针扎样、烧灼样、撕裂样、触碰敏感性疼痛等多种临床表现,疼痛常在夜间加重。PDPN属于神经病理性疼痛,其神经痛主要原因在于外周神经受损〔2〕,其发病机制除受自身遗传因素影响外,还可通过氧化应激损伤、血管损害、代谢紊乱等影响患者的血管及神经,造成神经变性坏死,严重影响神经的传导速度与敏感性。而且近年来亦有国内外诸多研究证实PDPN发生与电压门控钾离子通道(KCNQ)功能障碍相关。钾离子通道广泛分布于各组织细胞表面,尤其对神经细胞的膜电位和兴奋性起重要作用,其中KCNQ2/5蛋白表达和活性水平下调,在PDPN发病机制中起到关键性作用〔3〕。有研究证实乌头汤对急慢性疼痛有镇痛作用,也具有抗炎、抗氧化和免疫调节的生物活性的作用〔4〕。临床以乌头汤辨证加减治疗PDPN,根据患者临床表现酌情增加川乌剂量,可显著改善患者肢体疼痛、麻木的症状,并可获得持续性疗效〔5〕。本研究通过观察乌头汤对PDPN大鼠痛觉行为指标及KCNQ2/5通道蛋白表达的影响,探讨乌头汤治疗PDPN的内在作用机制,为临床治疗PDPN提供依据和方法。
1 材料与方法
1.1实验动物 清洁级健康雄性Wistar大鼠150只,体重(200±20)g,由北京维通利华实验动物技术有限公司提供,实验动物许可证号SCXK(京)2016-0011。适应性喂养1 w后随机分为正常组30只,造模组120只。
1.2实验药物 链脲佐菌素(STZ,100 mg,sigama,产品批号:s0130);乌头汤中药配方颗粒由四川新绿色药业科技发展有限公司提供。制川乌(产品批号:18110132)、麻黄(产品批号:18100067)、黄芪(产品批号:19090015)、白芍(产品批号:19080023)、甘草(产品批号:19100006)。
1.3模型制备与分组 正常组普通饲料喂养,造模组高脂饲料喂养8 w后,造模组大鼠尾静脉注射2%链脲佐菌素-柠檬酸钠混合溶液(25 mg/kg),正常组大鼠尾静脉注射同等剂量(25 mg/kg)柠檬酸钠缓冲液,1 w后造模组大鼠血糖大于16.7 mmol/L则为糖尿病模型大鼠。普通饲料喂养4 w后测量糖尿病大鼠热痛觉及机械性痛觉筛选出PDPN大鼠模型。成功造模112只,随机分为模型组28只,乌头汤低、中、高剂量组各28只。
1.4干预方法 乌头汤低、中、高剂量组分别予以乌头汤中药配方颗粒4.5 g/(kg·d)、 9.0 g/(kg·d)、18.0 g/(kg·d),用生理盐水配成混悬液,按10 ml/kg容积灌胃;正常组与模型组分别灌胃予以同等容积的生理盐水,每日1次,连续12 w。
1.5检测指标与方法
1.5.1大鼠一般状况及体重 观察大鼠精神状态,反应情况,活动情况,进食、饮水、排尿、排便情况,毛发光泽度,尾静脉注射处有无感染、坏死等一般情况。给药前及给药过程中每4 w测量一次体重,做好记录。
1.5.2大鼠血糖监测 给药前及给药过程中每4 w通过大鼠目内眦取血,测量各组大鼠空腹血糖。
1.5.3大鼠50%缩足反应阈值监测 采用弗莱毛(von Frey hair,North Coast,美国)细丝测定大鼠神经50%缩足反应阈值。将大鼠置于高架金属网格内,适应15 min 后,用不同力度的 von Frey 细丝刺激大鼠右后足底中部皮肤,观察其有无缩足或舔足反应。从有阳性反应起连续测量5次,记录相应的细丝力度(f),通过公式计算其50%缩足反应阈值。
1.5.4大鼠甩尾时间监测 将大鼠尾部下1/3浸入温度设置为(52.5±0.5)℃水浴锅中,仪器自动记录鼠尾从浸入水面到甩离水面的时间,剔除时间小于0.1 s及大于20 s的数值。
1.5.5大鼠坐骨神经电镜观察 给药12 w结束后,腹腔注射10%水合氯醛麻醉后处死,取双侧坐骨神经约1 cm,置于4%多聚甲醛中固定24 h后,充分流水冲洗,乙醇梯度脱水,二甲苯透明石蜡包埋,厚度2 μm连续病理切片,分别进行苏木素染色、伊红染色后,进行脱水封片,在电镜下观察超微结构。
1.5.6大鼠L4~6背根神经节及脊髓KCNQ2/5通道蛋白表达 给药12 w结束后,腹腔注射10%水合氯醛麻醉后处死,取L4~6背根神经节和脊髓组织,4℃生理盐水冲洗后,放入冻存管中,-80℃冰箱保存。取相应组织称重,进行总蛋白提取,测定蛋白含量及蛋白变性后,在电泳槽内上样电泳及转膜,将转膜后的聚偏氟乙烯(PVDF)膜放入封闭液中,室温摇床缓慢封闭2 h,分别加入兔抗KCNQ2/5多克隆抗体,4℃冰箱孵育过夜,TBST溶液快速漂洗,滴加二抗孵育,显影后进行Western印迹曝光成像拍照分析,应用Image J分析目的蛋白条带的灰度值与β-actin内参条带的灰度值,计算蛋白相对表达量。
1.6统计方法 采用SPSS17.0软件进行配对t检验(方差不齐时采用t′检验)、单因素方差分析。
2 结 果
2.1大鼠一般情况 正常组大鼠精神状态良好,毛发洁净纯白有光泽,反应敏捷,饮食水及尿量正常;模型组大鼠精神萎靡,毛色枯黄少光泽,行动迟缓,出现“三多一少”的典型症状,饮食水及尿量均明显增加;乌头汤治疗组大鼠与模型组比较精神状态稍好,行动较活跃,但饮食水及尿量情况无明显变化。
2.2各组不同时间点体重比较 给药前模型组及乌头汤各剂量组体重较正常组明显升高(P<0.01),模型组与乌头汤组体重无显著性差异(P>0.05);给药4 w时,模型组体重较正常组明显升高(P<0.01),乌头汤低、中剂量组体重较模型组明显降低(P<0.01),乌头汤高剂量组体重与模型组无显著性差异(P>0.05);给药8 w时,正常组、模型组及乌头汤高剂量组体重无显著性差异(P>0.05),乌头汤低、中剂量组体重较模型组降低(P<0.05);给药12 w时,正常组较模型组体重明显升高(P<0.01),乌头汤低、中剂量组体重较模型组降低(P<0.05),乌头汤高剂量组体重与模型组无显著性差异(P>0.05)。见表1。

表1 各组不同时间点体重及血糖比较
2.3各组不同时间点血糖比较 同一时间点,模型组较正常组血糖明显升高(P<0.01);给药前,模型组与乌头汤各剂量组血糖无显著性差异(P>0.05);给药4 w时,乌头汤低、中、高剂量组较模型组血糖明显降低(P<0.01);给药8 w时,乌头汤低、高剂量组较模型组血糖降低(P<0.05),乌头汤中剂量组与模型组血糖无显著性差异(P>0.05);给药12 w时,乌头汤低、中、高剂量组与模型组血糖无显著性差异(P>0.05)。见表1。
2.4各组不同时间点50%缩足反应阈值比较 给药前,模型组及乌头汤各剂量组50%缩足反应阈值较正常组明显升高(P<0.01),模型组与乌头汤各剂量组50%缩足反应阈值无显著性差异(P>0.05);给药4 w时,模型组50%缩足反应阈值较正常组明显升高(P<0.01),乌头汤中、高剂量组50%缩足反应阈值较模型组明显降低(P<0.01),乌头汤低剂量组较模型组50%缩足反应阈值无显著性差异(P>0.05);给药8 w及12 w时,模型组50%缩足反应阈值较正常组明显升高(P<0.01),乌头汤低、中、高剂量组50%缩足反应阈值较模型组明显降低(P<0.01)。见表2。
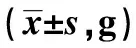
表2 各组不同时间点50%缩足反应阈值比较
2.5各组不同时间点甩尾时间 给药前,模型组及乌头汤各剂量组甩尾时间较正常组明显延长(P<0.01),模型组与乌头汤各剂量组甩尾时间无显著性差异(P>0.05);给药4 w时,各组甩尾时间无显著性差异(P>0.05);给药8 w时,模型组甩尾时间与正常组及乌头汤高剂量组无显著性差异(P>0.05),乌头汤低、中剂量组甩尾时间较模型组显著缩短(P<0.01,P<0.05);给药12 w时,模型组甩尾时间较正常组明显延长(P<0.01),乌头汤低、中、高剂量组甩尾时间较模型组明显缩短(P<0.01)。见表3。
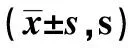
表3 各组不同时间点甩尾时间比较
2.6坐骨神经病理学观察 正常组坐骨神经排列紧密、结构整齐有序,神经纤维髓鞘致密、均匀,排列规则且层次分明,其间散见雪旺细胞。模型组坐骨神经排列混乱,结构疏松无序,神经纤维髓鞘明显增宽,分布不均匀,板层结构紊乱,有的出现节段性脱髓鞘,轴索萎缩,部分雪旺细胞变性坏死,上述病理改变提示PDPN模型造模成功。乌头汤低、中、高剂量组坐骨神经病理损伤与模型组相比,均有不同程度的改善,神经排列相对紧密,结构相对整齐有序,髓鞘分布相对均匀。见图1。
2.7L4-6背根神经节KCNQ2、KCNQ5蛋白相对表达量 与正常组相比,模型组KCNQ2、KCNQ5蛋白相对表达量均明显降低(P<0.01);与模型组相比,乌头汤低、中、高剂量组KCNQ2、KCNQ5蛋白相对表达量均明显升高(P<0.01)。与正常组相比,乌头汤高剂量组KCNQ5蛋白相对表达量明显升高(P<0.01),乌头汤中、高剂量组KCNQ2蛋白相对表达量明显升高(P<0.01),见表4、图2。
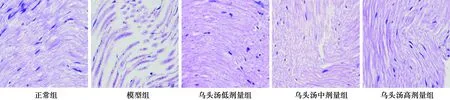
图1 各组坐骨神经病理学观察(×400)

表4 各组KCNQ2、KCNQ5蛋白表达比较
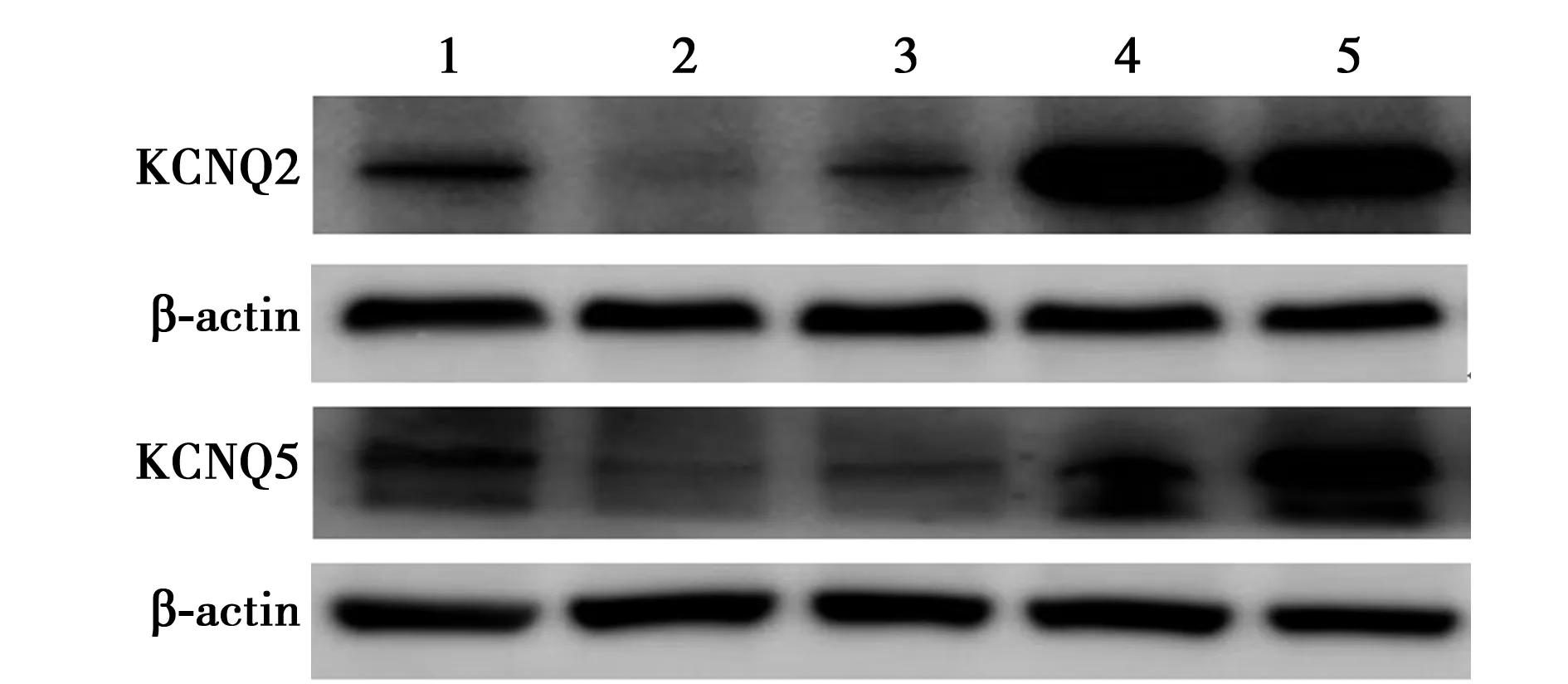
1~5:正常组、模型组、乌头汤低剂量组、乌头汤中剂量组、乌头汤高剂量组图2 Western 印迹检测KCNQ2、KCNQ5蛋白表达
3 讨 论
PDPN是因糖尿病导致周围神经结构和功能改变而诱发的慢性神经病理性疼痛。PDPN患者的感觉障碍比较明显,除病变处的麻木感、震动感及患者的感觉减退、丧失外,更多表现为自发性疼痛〔6〕。随着对糖尿病并发症的深入研究,PDPN的发病机制也有着广泛的探讨,主要包括:代谢紊乱、血管损害、神经营养因子、氧化应激的损伤、炎症反应、自身免疫的损伤、遗传因素、神经元细胞膜离子通道功能障碍、蛋白激酶(PK)C、致痛因子等〔7〕。虽然其具体的发病机制尚不明确,但由于胰岛素分泌不足及外周血管功能不全所导致的神经损伤这一病理因素已得到共识。
钾离子通道是选择性钾离子通道,广泛分布于骨骼肌、神经、血管、胃肠道及腺体细胞中,在调节神经细胞兴奋性及膜电位中起重要作用。电压门控钾离子通道KCNQ属于延迟整流型钾离子通道,其中KCNQ2/5通道参与构成M电流,M电流是一种具有电压依赖性、慢激活、非失活、慢去活的外向钾电流,对于维持和稳定神经元的兴奋性发挥着重要作用〔8〕。Everill等〔9〕研究证实,神经元损伤后M电流减少,可致神经兴奋性升高,从而出现痛觉过敏。亦有学者报道KCNQ2/5开放剂瑞替加滨可有效治疗神经结扎模型所产生的神经病理性疼痛〔10〕。所以KCNQ2/5通道电流在神经病理性疼痛中发挥关键作用,从而上调KCNQ2/5蛋白表达,增强KCNQ2/5通道的开放可作为疼痛治疗的思路。
本研究提示PDPN大鼠的神经损伤得到一定程度的修复。经乌头汤治疗后PDPN大鼠机械痛觉及热痛觉敏感性均较模型组增强,也证实其神经传导速度的提高。说明乌头汤具有改善PDPN大鼠对于机械痛觉及热痛觉的敏感程度,修复受损神经、改善神经传导功能,从而起到缓解PDPN疼痛的作用。模型组PDPN大鼠KCNQ2/5蛋白表达较正常组均明显下降,从而导致M电流减弱,神经元兴奋性增加,产生神经病理性疼痛。经乌头汤低、中、高剂量灌胃治疗后大鼠KCNQ2/5蛋白表达较模型组均明显升高;与正常组相比,乌头汤中、高剂量组KCNQ2/5蛋白表达亦有不同程度升高,证实乌头汤可上调KCNQ2/5通道的表达,增强M电流,使神经元维持正常的兴奋状态,从而减轻疼痛,且其疗效与药剂量呈正相关性。综上,乌头汤可修复PDPN大鼠受损神经,提高神经传导功能,改善对于机械痛觉及热痛觉的敏感程度,同时可修正KCNQ2/5通道的表达和活性,从而减轻PDPN所引起神经性疼痛症状,为其进一步临床应用奠定了理论基础。
