下调miR-199a-5p对阿霉素诱导的心肌细胞凋亡的影响和机制研究
2021-03-05李念阳霞李琼孝俊
李 念 阳 霞 李 琼 孝 俊
心肌损伤是多种心血管系统疾病发生的重要原因之一,心肌细胞过度凋亡是诱导心肌损伤的关键因素[1]。阿霉素是具有抑制DNA和RNA合成作用的抗肿瘤药物,其副作用是能够诱发药物性心肌病,引起心力衰竭,是常见的体外研究心肌细胞损伤模型的诱导因子[2]。心肌损伤发生机制十分复杂,受到细胞内多种基因的表达调控作用,这些基因之间构成复杂的调控网络,共同影响疾病的发生[3]。miRNA是一类在人体组织和细胞中普遍表达的非编码RNA,其在不同病理以及生理过程中的作用可能不同[4]。很多研究表明,miRNA异常表达与心肌损伤有关,miRNA参与调控病理条件下心肌细胞凋亡的发生,可能是改善心肌损伤的分子靶点[5]。miR-199a-5p定位于人类19号染色体上,在人体组织中广泛表达,具有多种生物学作用,参与肿瘤、哮喘等疾病的发生[6,7]。有研究显示,miR-199a-5p在缺氧复氧心肌细胞中高表达,并且下调miR-199a-5p可以抑制缺氧复氧诱导的心肌细胞凋亡,miR-199a-5p在心肌损伤中可能发挥促进作用[8]。Wnt/β-catenin在缺氧复氧心肌细胞损伤中激活水平降低,而激活Wnt/β-catenin信号能够改善心肌细胞损伤[9]。既往研究表明,miR-199a-5p可以通过作用于Wnt信号通路参与肿瘤进展[10]。目前对miR-199a-5p在阿霉素诱导的心肌细胞凋亡中的作用还不明确。本次实验以心肌细胞H9C2作为研究对象,利用阿霉素构建心肌细胞凋亡模型,探讨下调miR-199a-5p对阿霉素诱导的心肌细胞凋亡的影响和机制,为心肌细胞损伤分子靶向治疗提供新思路。
1 材料与方法
1.1 细胞、药剂和仪器
CRL-1446心肌细胞H9C2购自通派(上海)生物科技有限公司;D8740-25阿霉素购自北京索莱宝科技有限公司(实验时,阿霉素直接溶解在细胞培养液中,最终浓度为1μM);9661 C-Caspase-3抗体、18583 c-Myc抗体购自Santa Cruz Biotechnology公司;miR-199a-5p inhibitor、inhibitor control由山东维真生物科技有限公司合成;11668019 Lipofectamine 2000购自美国Invitrogen公司;KF658 β-catenin抗体购自南京建成生物工程研究所;16096040 RNA提取试剂盒、4366597逆转录试剂盒购自美国Thermo Fisher Scientific公司;K1018 CCK-8检测试剂盒购自美国APExBIO公司;C6流式细胞仪购自美国BD公司;680酶标仪购自美国Bio-Rad公司;Exciycler 96荧光定量PCR仪购自韩国Bioneer公司;NANO2000紫外分光光度计购自美国Thermo公司;IX53倒置显微镜购自日本OLYMPUS公司。
1.2 细胞分组和处理
心肌细胞生长密度为80%以上时,利用0.25%胰蛋白酶37℃消化传代,生长至对数期时,将心肌细胞分成5组,(1)Control组:空白对照细胞,常规培养;(2)DOX组:在实验开始时以1μM的阿霉素细胞培养液处理培养;(3)DOX+Anti-miR-NC组:在心肌细胞中转染inhibitor control,然后在实验开始时以1μM的阿霉素细胞培养液处理培养;(4)DOX+Anti-miR-199a-5p组:在心肌细胞中转染miR-199a-5p inhibitor,然后在实验开始时以1μM的阿霉素细胞培养液处理培养;(5)DOX+Anti-miR-199a-5p+DKK1组:在心肌细胞中转染miR-199a-5p inhibitor,然后在实验开始时以1μM的阿霉素和20ng/ml的Wnt/β-catenin信号抑制剂DKK1细胞培养液处理培养。细胞转染步骤按照Lipofectamine 2000转染试剂操作说明进行。
1.3 Realtime PCR方法测定miR-199a-5p表达
Control组、DOX组、DOX+Anti-miR-NC组和DOX+Anti-miR-199a-5p组细胞(n均=9)培养24h以后,收集细胞,在细胞内添加Trizol试剂提取各组细胞总RNA,以miScript Reverse Transcription Kit合成cDNA,体系配制如下:5μl的Total RNA、4μl的5×miScript RT Buffer、1μl的miScript Reverse Transcription Mix,最后添加RNase-free Water使体积为20μl,反应条件为:37℃ 60min、95℃ 5min,合成的cDNA保存于-20℃。引物设计和合成均由上海生工完成,PCR引物如下:miR-199a-5p, forward: 5’-CCC AGT GTT CAG ACT ACC TGT-3’, reverse: 5’-GTG CGT GTC GTG GAG-3’; U6, forward: 5’-CTC GCT TCG GCA GCA CA-3’ ,reverse: 5’-AAC GCT TCA CGA ATT TGG T-3’。PCR反应体系包括:5μl的miScript Primer Assay、2μl的cDNA、25μl的Quanti Tect SYBR Green PCR Master mix、5μl的引物,最后添加RNase-free Water至体积为50μl。PCR反应条件为:95℃ 15min,而后95℃ 15s,55℃ 30s,70℃ 30s,共40个循环。以2-△△Ct方法计算miR-199a-5p的相对表达水平,U6作为内参。
1.4 CCK-8测定细胞增殖
各组心肌细胞分别添加到96孔细胞培养板内(n均=9),每个孔内加入100μl的细胞悬浮液(含有104个细胞)。于37℃,5% CO2培养箱内培养24h后取出细胞培养板,加入100μl CCK-8溶液,置于37℃中结合4h。在酶标仪上检测450nm的A值,经过空白孔(只会细胞培养液,不加入细胞)调零以后,计算细胞存活率变化。细胞存活率=(实验组A值÷对照组A值)×100%。
1.5 流式细胞术测定细胞凋亡
各组细胞培养24h以后,用PBS溶液将细胞洗涤2次,每组细胞分别收集5×105个,以400μl的Binding Buffer重悬细胞,加入5μl的Annexin V-FITC到细胞悬浮液内,均匀混合,置于4℃条件、避光环境中结合15min。再加入10μl的PI染色液,放在4℃环境中结合10min。上流式细胞仪测定细胞凋亡情况。
1.6 Western blot测定C-Caspase-3、β-catenin、c-Myc蛋白表达
各组细胞(n均=9)培养24h以后收集细胞,以提前预冷的PBS溶液洗涤3次,用移液器吸除残留液体。在细胞内添加RIPA试剂,置于冰上结合15min,用细胞刮子收集各组细胞,4℃,12 000离心10min,收集上清,常规BCA法检测上清液蛋白浓度。在蛋白样品中添加1/4体积的5×Loading Buffer,100℃结合5min后置于冰上备用。制备12%的分离胶和5%的浓缩胶进行SDS-PAGE电泳。在每个上样孔内依次添加30μg的蛋白样品,以80V的恒压条件电泳40min,当染料到达分离胶以后,再将电压调整到120V继续电泳。在90V的电压条件下进行转膜50min。将PVDF膜经5%牛血清白蛋白封闭后,再置于稀释好的一抗(C-Caspase-3、β-catenin、c-Myc抗体按照1∶400、1∶800、1∶800稀释)溶液内,4℃冰箱内孵育过夜,再置于含有辣根过氧化物酶标记的二抗稀释溶液中,37℃孵育1h。以BeyoEcL Plus显色试剂盒进行显色。以ImageJ软件分析各个条带的灰度值,以GAPDH为参照,各目的条带与GAPDH条带灰度值的比值为该蛋白相对表达水平。
1.7 统计学处理

2 结 果
2.1 各组心肌细胞miR-199a-5p表达水平比较
各组细胞miR-199a-5p水平差异有统计学意义(P<0.01);与Control组相比,DOX组心肌细胞中miR-199a-5p表达水平升高(t=19.98,P<0.01);与DOX+Anti-miR-NC组相比,DOX+Anti-miR-199a-5p组心肌细胞中miR-199a-5p表达水平降低(t=20.11,P<0.01),见表1。

表1 各组心肌细胞中miR-199a-5p水平
2.2 各组心肌细胞凋亡水平比较
各组细胞存活率、凋亡率和C-Caspase-3、β-catenin、c-Myc蛋白水平差异有统计学意义(P<0.01)。与Control组相比,DOX组心肌细胞存活率降低(t=9.08,P<0.01),细胞凋亡率(t=27.95,P<0.01)和C-Caspase-3蛋白水平升高(t=27.95、18.98,P<0.01),β-catenin、c-Myc蛋白水平降低(t=13.99、13.40,P<0.01);与DOX+Anti-miR-NC相比,DOX+Anti-miR-199a-5p组心肌细胞存活率升高(t=7.39,P<0.01),细胞凋亡率和C-Caspase-3蛋白水平降低(t=14.24、13.38,P<0.01),β-catenin、c-Myc蛋白水平升高(t=10.09、12.68,P<0.01);与DOX+Anti-miR-199a-5p组相比,DOX+Anti-miR-199a-5p+DKK1组心肌细胞存活率降低(t=9.19,P<0.01),细胞凋亡率升高(t=13.52,P<0.01),细胞中C-Caspase-3蛋白表达水平升高(t=8.84,P<0.01),β-catenin、c-Myc蛋白表达水平降低(t=12.65、13.86,P<0.01);见图1、图2和表2。

图1 各组心肌细胞凋亡(流式细胞术)
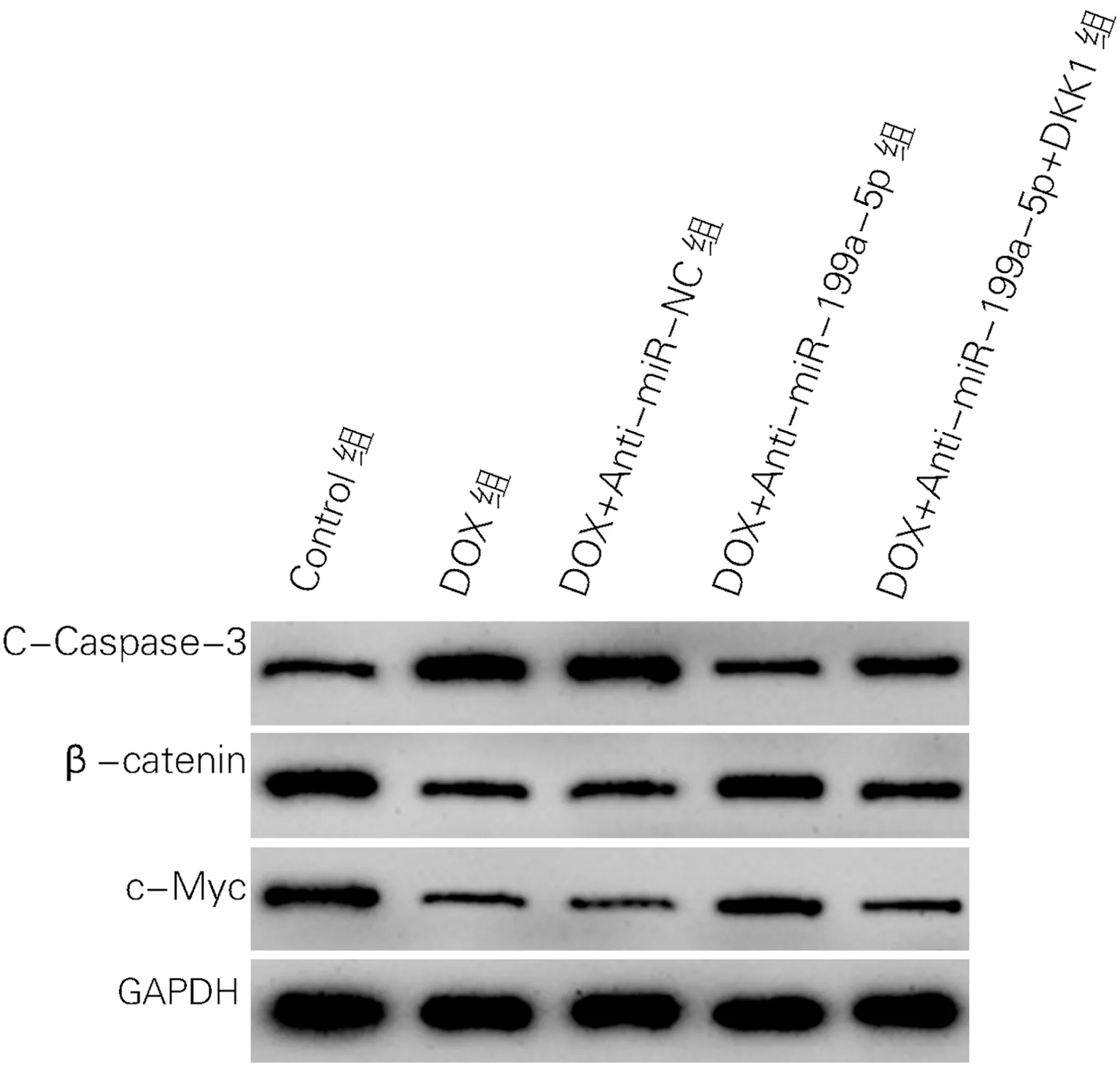
图2 各组心肌细胞中C-Caspase-3、β-catenin、c-Myc蛋白表达(Western Blot)
3 讨 论
细胞凋亡是一个复杂过程,是细胞内很多基因共同作用的结果。Caspase是一个与细胞凋亡关系密切的蛋白家族,其含有多个蛋白成员,这些蛋白成员在正常情况下以无活性的酶原形式存在,只有在受到外界因素刺激后,才能被活化剪切成有活性的Caspase,这些Caspase成员共同构成Caspase级联反应,诱导细胞凋亡发生[11-13]。Caspase-3是位于Caspase凋亡级联反应的下游因子,其活化后形成C-Caspase-3,而C-Caspase-3可以不可逆的诱导细胞凋亡发生[14,15]。C-Caspase-3也被认为是细胞凋亡发生的标志[16]。本文结果表明,miR-199a-5p在阿霉素诱导的心肌细胞中表达上调,并且下调miR-199a-5p可以抑制阿霉素诱导的细胞凋亡,提高细胞增殖活性,说明下调miR-199a-5p在阿霉素诱导的心肌细胞损伤中发挥保护作用,提示miR-199a-5p可能是一个心肌细胞损伤因子。下调miR-199a-5p可以降低阿霉素诱导的心肌细胞中C-Caspase-3蛋白表达水平,说明下调miR-199a-5p有抑制心肌细胞凋亡的作用,这与细胞凋亡检测结果一致。

表2 各组阿霉素诱导的心肌细胞存活率、凋亡率和C-Caspase-3蛋白水平
miRNA是在自然界中广泛存在的小分子RNA,其没有开放阅读框,没有编码蛋白质的功能,miRNA能够通过影响下游信号通路的转导发挥多种生物学作用,如细胞生长、细胞凋亡、氧化应激等[17]。miRNA还与人类疾病发生有关,在肿瘤、神级系统疾病等进展过程中扮演关键角色,miRNA有可能成为某些疾病分子靶向治疗的靶点[18,19]。miR-199a-5p可能是一个心肌损伤促进因子,靶向抑制miR-199a-5p可能是治疗阿霉素诱导的心肌损伤的途径。
miRNA参与不同病理以及生理进展与其复杂的调控机制有关,其可以通过影响下游信号通路的转导发挥生物学作用[20]。本实验表明,下调miR-199a-5p可以提高阿霉素诱导心肌损伤细胞中β-catenin、c-Myc蛋白表达水平。β-catenin是经典Wnt/β-catenin信号通路的关键蛋白,c-Myc是Wnt/β-catenin信号的下游基因[21]。Wnt/β-catenin信号与细胞生长、分化及凋亡等有关,其在人体组织中广泛表达[22,23]。有研究显示,Wnt/β-catenin参与心肌损伤,在阿霉素诱导的心肌细胞中Wnt/β-catenin激活水平降低,并且激活Wnt/β-catenin可以改善心肌损伤[24,25]。本实验显示,Wnt/β-catenin抑制剂可以逆转下调miR-199a-5p对阿霉素心肌细胞凋亡的影响,说明下调miR-199a-5p通过激活Wnt/β-catenin信号抑制心肌细胞凋亡。 miR-199a-5p是一个与细胞生长、运动等关系密切的miRNA调控因子,参与恶性肿瘤生长[26]。研究显示,miR-199a-5p参与缺氧复氧心肌损伤,其在心肌损伤中发挥促进作用,下调其表达可以抑制心肌细胞损伤,减少细胞凋亡[27]。本实验首次证明了miR-199a-5p在阿霉素诱导的心肌细胞凋亡中可能发挥促进作用,其作用机制与激活Wnt/β-catenin信号有关。与心肌细胞损伤有关的基因及信号通路较多,已有研究[8]表明miR-199a-5p参与缺氧复氧心肌细胞损伤与HIF-1α-GSK3β-mPTP有关,miR-199a-5p是否还可通过HIF-1α-GSK3β-mPTP调控阿霉素诱导的心肌细胞损伤还不明确。
综上所述,下调miR-199a-5p能够抑制阿霉素诱导的心肌细胞凋亡,作用机制与激活Wnt/β-catenin信号有关。目前尚未在体内实验中验证miR-199a-5p的作用,也没有观察上调miR-199a-5p对阿霉素诱导的心肌细胞凋亡的影响,而且对miR-199a-5p的下游具体的靶向调控机制以及其是否通过调控其它基因或信号通路发挥作用还不明确,后续研究将会对上述内容进行深入探讨。
