2型糖尿病患者血糖变异性与脑结构及认知功能的相关性研究
2021-03-05陈蜜蜜周善磊刘福军汪洁罗维邓大同余永强
陈蜜蜜 ,周善磊,刘福军,汪洁,罗维,邓大同,余永强*
血糖变异性亦称血糖波动,是指血糖水平在最大值与最小值之间的非稳定状态,已有研究表明血糖变异与糖尿病血管疾病、神经疾病、视网膜病变等多种并发症密切相关[1]。针对餐后血糖发布的指南中表明糖尿病患者血糖变异性越大,出现并发症的概率越高,患者整体预后也越差[2]。监测血糖变异性的方法很多,目前最新技术为连续血糖监测系统,不仅能减轻指尖血糖测试的痛感,还能提高患者的依从性和生活质量[3]。MRI研究证实糖尿病患者存在额叶、颞叶、枕叶等多个脑区灰质体积减小,认知功能下降[4]。虽然大量临床研究已证实血糖变异性与认知功能相关,部分研究证实2型糖尿病(type 2 diabetes mellitus,T2DM)患者血糖变异性与某些脑区功能连接相关,但尚未有研究调查T2DM患者血糖变异性与灰质体积之间的关系,尤其是血糖变异性、灰质体积及认知功能三者之间的关联,因此该研究旨在探讨血糖变异性对T2DM患者大脑结构及认知功能的影响。
1 材料与方法
1.1 研究对象
前瞻性分析2019年11月至2020年12月就诊于安徽医科大学第一附属医院内分泌科并确诊为T2DM的患者,同期招募性别年龄教育年限匹配的健康对照(healthy control,HC)组。入组标准:T2DM组入组标准:(1)T2DM的诊断符合国际公认诊断标准[5],且病程≥1年;(2)右利手,年龄30~65岁,教育年限≥6年;(3)简易智力状态检查量表(the Mini-Mental State Examination,MMSE)≥24分,蒙特利尔认知评估量表(Montreal Cognitive Assessment,MoCA)≥19分,以排除痴呆[6]。HC组入组标准:(1)空腹血糖<6.1 mmol/L或餐后2 h血糖≤7.8 mmol/L;(2)右利手,年龄 30~65岁,教育年限≥6年;(3)MMSE≥24分,MoCA≥19分,以排除痴呆。排除标准:(1)甲状腺、心血管、肝肾等疾病;(2)抑郁、焦虑、帕金森病、癫痫等神经、精神疾病;(3)脑出血、脑梗死、肿瘤等脑部疾病或脑外伤或手术史;(4)MRI扫描禁忌证:幽闭恐惧症、体内金属植入物等。共纳入完成所有检查的T2DM组71例,其中49例男性,22例女性,年龄(47.34±7.86)岁。HC 70名,其中48名男性,22名女性,年龄(45.69±7.49)岁。本研究经过安徽医科大学第一附属医院伦理委员会审批(批准号:P2021-10-13)。所有参与者均自愿参加并签署知情同意书。
1.2 神经心理学评估
测试内容包括:Folstein编制的MMSE、Nasreddine编制的MoCA、香港大学-安徽医科大学版本的听觉词语学习测验(Auditory Verbal Learning Test,AVLT)、Halstead-Teitan版本的连线测验_A(the Trail Making Test_A,TMT_A)、Aaron版本的符号数字模式测验(Symbol Digital Modalities test,SDMT)、韦氏版本的数字广度测验(the Digit Span Test,DST)和Thurstone等编制的词语流畅性测验(the Verbal Fluency Test,VFT)以及William编制的抑郁自评量表(Self-rating Depression Scale,SDS)和焦虑自评量表(Self-rating Anxiety Scale,SAS)。
1.3 动态血糖测试
使用美国雅培公司连续血糖监测系统获取全面的血糖信息并评估血糖变异性。连续血糖监测系统由一次性电子设备和粘附在皮肤上的皮下传感器组成。由护理人员将传感器佩戴于患者上臂,最长时可监测间长达14 d内的血糖值。在此过程中患者需规律饮食、避免剧烈运动。数据获取方法为通过读取器对传感器进行快速无线扫描,最终通过计算机软件持续血糖谱得到血糖均值(mean blood glucose,MBG)、血糖水平标准差(standard deviation of blood glucose,SDBG)、变异系数(coefficient of variation,CV)、平均血糖波动幅度(mean amplitude of glycemic excursion,MAGE)、日间血糖平均绝对差(absolute mean of daily difference,MODD)和葡萄糖目标范围内时间(time in range,TIR)等一系列血糖变异性的测量值。
1.4 磁共振数据采集与分析
1.4.1 数据采集
所有参与者均使用3.0 T GE扫描仪(Discovery MR 750w,General Electric,Milwaukee,WI,USA)进行头颅磁共振扫描以获取T1WI、T2 FLAIR和3D T1相。扫描前被试安静休息30 min,并与被试充分沟通扫描流程及注意事项等,扫描过程中要求被试清醒、闭眼、放松、保持不动,并用耳塞减少扫描仪的噪音,舒适的泡沫垫填充头部周围以减少头部运动。先扫描T1WI、T2 FLAIR图像用以检查参与者是否存在器质性疾病。随后利用快速自旋回波序列获得3D T1相,参数如下:TR 8.5 ms,TE 3.2 ms,TI 450 ms,FA 12°,FOV 256 mm×256 mm,矩阵256×256,层厚1 mm,采集时间296 s。图像采集完成后由2名工作10年以上的经验丰富的诊断医师独立对图像进行检查,且医师对图像信息未知。如遇分歧,则协商解决。主要观察是否存在伪影、头动情况、图像清晰度、扫描序列是否齐全、颅内是否有病灶等。
1.4.2 数据分析
采用基于体素的形态学测量(voxel-based morphological analysis,VBM)分析3D T1像。首先运用dcm2nii软件包进行格式转换。在MatLab(11.0,Mathworks,Inc.,Sherborn,Mass)上使用SPM8(SPM,Wellcome Department of cognitive Neurology,London,UK)软件包中VBM8工具箱(http://dbm.neuro.unijena.de/wbm8)进行图像预处理。包括将图像分割成灰质、白质和脑脊液,DARTEL算法进行空间标准化,6 mm高斯平滑核完成空间平滑。然后采用两独立样本t检验分析两组参与者灰质体积的差异,以团块水平的FWE方法进行多重比较校正,性别、年龄、教育年限和颅内总体积作为协变量。特定脑区的灰质体积概率值提取采用DPABI(http://rfmri.org/dpabi)软件包完成。
1.5 统计学方法
使用SPM8软件中两独立样本t检验比较两组灰质体积的差异,且均行双侧检验。后续分析使用SPSS 21.0统计软件。计量资料以±s表示,计数资料以中位数和四分位数间距[M(P25,P75)]表示。χ2检验分析性别差异,双样本t检验用于比较一般资料、认知测试分数等的组间差异。偏相关分析用于分析T2DM患者动态血糖数据与脑区灰质体积概率值及认知测试分数之间的关系,其中性别、年龄、教育年限作为协变量。P<0.05认为差异有统计学意义。
2 结果
2.1 一般资料及认知、血糖变异性数据的组间比较
本研究最初共招募参与者157人(T2DM:80例;HC:77名),因MoCA<19分排除5名(其中T2DM:3例),因未完成认知或嗅觉测试或MRI扫描排除7名(其中T2DM:6例)。HC组中因MR扫描结束后发现异常者排除4名。最终,本研究共纳入T2DM患者71例,HC组70名。两组性别、年龄、教育年限差异无统计学意义(P>0.05)。T2DM组MoCA、SDMT、DST_forword、VFT测试分数较HC组减低,差异有统计学意义(P<0.05)。两组在AVLT(immediate)、AVLT(delay)、AVLT(recognize)、MMSE、TMT_A、TMTA_F、SDMT_F、DST_backward差异均无统计学意义(P>0.05)。结果见表1。
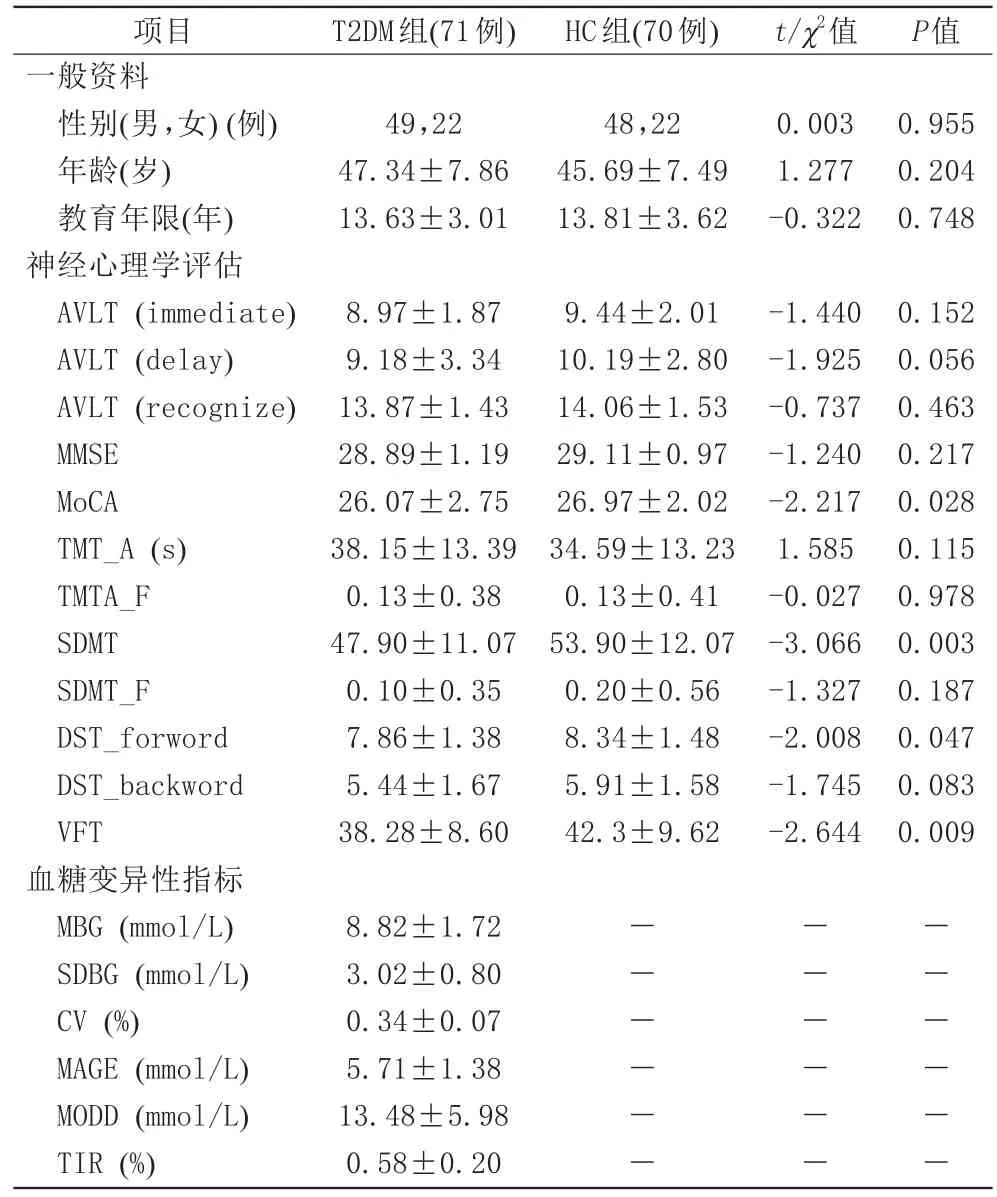
表1 两组一般资料、认知测试分数及血糖变异性血糖数据比较Tab.1 Comparison of general information,cognitive test scores and glycemic variability data between the two groups
2.2 全脑灰质体积的组间比较
与HC组相比,T2DM组灰质体积减小的脑区有右侧小脑4、5区、左侧尾状核、左侧丘脑、左侧额中回及左侧内侧额上回。T2DM组与HC组相比不存在灰质体积增加的脑区(图1)。

图1 2型糖尿病组与健康对照组组灰质体积差异脑区图。注:红色为健康对照组灰质体积增加的脑区(即2型糖尿病组灰质体积减小脑区),FWE校正,P<0.05,团块>420为差异有统计学意义Fig.1 Brain regions of the gray matter volume difference between the T2DM group and the HC group.Note:Red is the brain area where the gray matter volume increases in the HC group(that is,the gray matter volume decreases in the T2DM group),FWE correction,P<0.05,cluster>420,the difference is statistically significant.
2.3 脑区灰质体积与认知测试分数的偏相关分析
在T2DM组中,左侧尾状核灰质体积与TMT_A呈负相关(Pr=-0.276,P=0.023)。左侧丘脑灰质体积与AVLT(delay)呈正相关(Pr=0.251,P=0.039)。左侧内侧额上回灰质体积与DST_forward呈正相关(Pr=0.258,P=0.034;图2)。
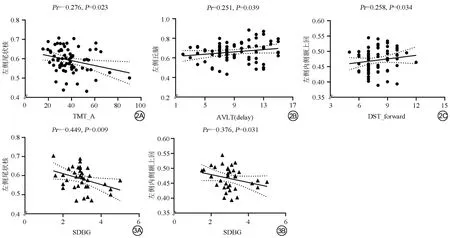
图2 2型糖尿病组脑区灰质体积值与认知测试分数的偏相关分析。A:左侧尾状核灰质体积与连线测验A用时(s)(TMT_A)测试分数偏相关分析图;B:左侧丘脑灰质体积与听觉词语学习测验短时延迟回忆[AVLT(delay)]测试分数偏相关分析图;C:左侧内侧额上回灰质体积与数字广度测验(顺背)(DST_forward)测试分数偏相关分析图。图3 2型糖尿病组血糖变异性指标与脑区灰质体积的偏相关分析图。A:血糖水平标准差(SDBG)与左侧尾状核灰质体积偏相关分析图;B:SDBG与左侧内侧额上回灰质体积偏相关分析图Fig.2 Partial correlation analysis of brain gray matter volume and cognitive test scores.A:Partial correlation analysis of left caudate gray matter volume and TMT_A test scores.B:Partial correlation analysis of left thalamus gray matter volume and AVLT(delay)test scores.C:Partial correlation analysis of left medial frontal superior gyrus gray matter volume and DST_forward test scores.Fig.3 Partial correlation analysis of glycemic variability index and brain gray matter volume in T2DM group.A:Partial correlation analysis between SDBG and gray matter volume of left caudate.B:Partial correlation analysis between SDBG and gray matter volume of left medial frontal superior gyrus.
2.4 血糖变异性指标与脑区灰质体积的偏相关分析
在T2DM组中,SDBG与左侧尾状核、左侧内侧额上回灰质体积呈负相关(Pr=-0.449,P=0.009;Pr=-0.376,P=0.031;图3)。
2.5 血糖变异性指标与认知功能的偏相关分析
在T2DM组中,MBG与SDMT、VFT测试分数呈负相关(Pr=-0.357,P=0.042;Pr=-0.374,P=0.032)。SDBG 与DST_forward测试分数呈负相关(Pr=-0.465,P=0.006)。CV与DST_forward测试分数呈负相关(Pr=-0.383,P=0.028)。MODD与SDMT测试分数呈负相关(Pr=-0.562,P=0.002)。TIR与DST_forward测试分数呈正相关(Pr=0.406,P=0.032;图4)。
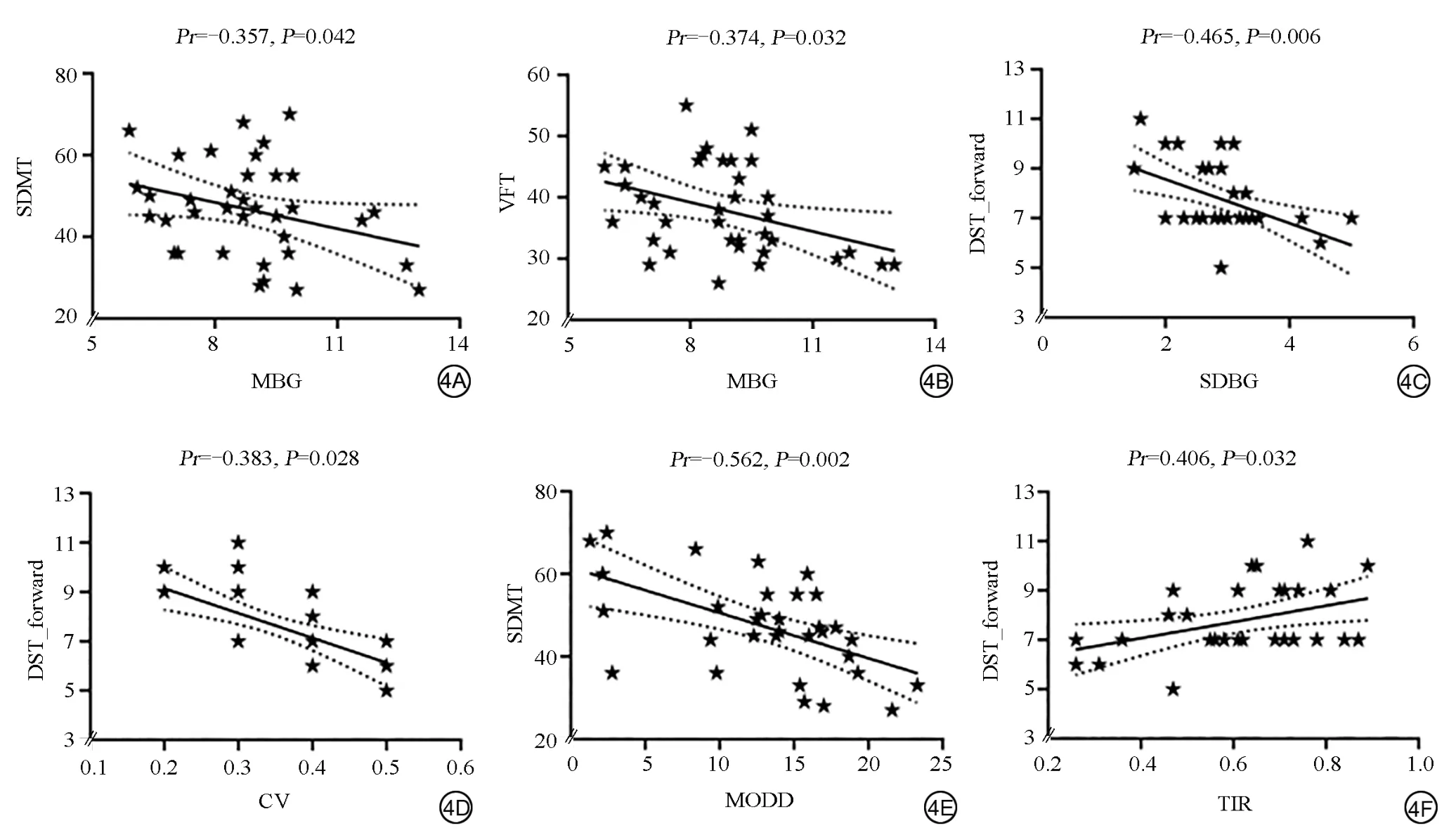
图4 2型糖尿病组血糖变异性指标与认知功能的偏相关分析图。A、B:血糖均值(MBG)与符号数字模式测验(SDMT)、词语流畅性测验(VFT)测试分数的偏相关分析图;C:血糖水平标准差(SDBG)与数字广度测验(顺背)(DST_forward)测试分数的偏相关分析图;D:变异系数(CV)与DST_forward测试分数的偏相关分析图;E:日间血糖平均绝对差(MODD)与符号数字模式测验(SDMT)测试分数的偏相关分析图;F:葡萄糖目标范围内时间(TIR)与DST_forward测试分数的偏相关分析图Fig.4 Partial correlation analysis of glycemic variability index and cognitive function in T2DM group.A,B:Partial correlation analysis between MBG and SDMT,VFT test scores.C:Partial correlation analysis between SDBG and DST_forward test scores.D:Partial correlation analysis between CV and DST_forward test scores.E:Partial correlation analysis between MODD and SDMT test scores.F:Partial correlation analysis between TIR and DST_forward test scores.
3 讨论
既往研究已证实血糖变异性与T2DM患者脑区功能连接存在相关性,但尚未探究血糖变异性对灰质体积及认知功能的影响。因此,笔者运用VBM方法比较T2DM患者与健康对照之间全脑灰质体积的差异,结果发现与HC组相比,T2DM患者存在相应脑区灰质体积减小。偏相关分析中,血糖变异性指标与部分脑区灰质体积及多项认知功能存在负相关关系。该研究结果是对前人研究成果的补充,更加证明血糖变异性与T2DM患者认知功能及大脑结构和功能的改变有着密不可分的联系。
3.1 T2DM患者脑区灰质体积与认知功能的关系
T2DM会导致认知障碍已成为共识。一项荟萃分析称糖尿病患者患痴呆的风险增加了73%[7]。MRI技术能无创性检查大脑结构变化,有利于疾病的早期诊断和治疗。Li等[8]研究报道T2DM患者不论是否伴发轻度认知障碍(mild cognitive impairment,MCI)均存在多个脑区灰质体积的减少,并且T2DM-MCI患者丘脑、壳核及海马灰质体积越小,MMSE、MoCA等认知测试分数越低。另有研究证实T2DM患者存在岛叶、海马和额叶、颞叶皮层的局部灰质体积下降,与视觉空间构造、规划和视觉记忆有关[9]。本研究亦得出T2DM组左侧尾状核、左侧丘脑及左侧内侧额上回灰质体积越小,AVLT(delay)、TMT_A及DST_forward认知测试分数越差。笔者推测出现脑区萎缩及认知功能下降的潜在机制可能为:(1)脑胰岛素抵抗降低葡萄糖摄取和利用率,进而导致认知功能障碍。脑内胰岛素和胰岛素受体在海马、小脑、大脑皮层等区域水平最高[10]。长期血糖波动会使脑胰岛素水平下降、与受体亲和力降低,进而会损坏3-磷酸肌醇激酶/蛋白激酶B信号通路,诱发脑能量代谢障碍,导致T2DM患者认知功能障碍[11]。(2)T2DM患者脑萎缩可能涉及皮层-丘脑-小脑网络,该网络涉及很多高级认知功能[12]。Bruchhage等[13]研究发现小脑萎缩可能是阿尔兹海默病(Alzheimer's disease,AD)患者早期标志物。Tang等[14]指出MCI和AD患者存在皮层-小脑功能连接的改变,并与认知功能下降有关。Ou等[15]报道小脑-丘脑-大脑皮层环路与计划、工作记忆等相关。
3.2 T2DM患者血糖变异性指标与脑区灰质体积及认知功能的关系
血糖变异性指标主要通过CGM系统获得,包括MBG、SDBG、MAGE、CV、MODD、TIR,均是反映血糖波动幅度大小的重要参数[16]。MBG是指血糖监测值的平均值,能反映血糖控制的总体水平。SDBG和MODD均反映血糖波动的离散程度,一般认为SDBG<1.4 mmol/L、MODD<1.84 mmol/L为血糖波动正常[17]。MAGE不受整体血糖水平的影响,能准确反映血糖变异性大小[18]。CV是指血糖水平在最高值与最低值之间的不停波动的状态,其与糖尿病微血管并发症及低血糖发生率、病死率密切相关[19]。TIR即目标范围内时间,其目标范围一般为3.9~10.0 mmol/L。其可作为评估短期内血糖控制的指标[20]。
近年研究提出血糖变异性越大,T2DM患者认知功能越差。Xia等[21]研究证实与血糖变异性大的T2DM患者MoCA、VFT得分更低。王凯亮等[22]报道MBG、SDBG、MAGE、CV、MODD、TIR是T2DM患者认知障碍的独立危险因素,并且血糖变异性越大,认知水平越差。本研究亦得出MBG、SDBG、MODD、CV波动幅度越大,TIR占比越小,T2DM患者记忆、执行控制、注意力等多方面认知功能越差,这些结果均与前人研究相似。在血糖变异性指标中,SDBG是常用且准确的参数。丁文萃等[23]发现SDBG越大,T2DM患者认知越差。本研究证实SDBG越高,T2DM患者左侧尾状核和左侧内侧额上回灰质体积越小,记忆、注意力等认知功能越差。尾状核体积缩小会导致认知障碍[24]。内侧额上回与记忆、持续注意力密切相关[25]。
3.3 血糖变异导致T2DM患者认知功能减退的潜在病理生理学机制
人脑不能合成葡萄糖或储存大量糖原,需要持续的葡萄糖供应,因此人脑是对葡萄糖水平最敏感的器官之一。而血糖变异会加剧糖尿病患者神经损伤,加速认知功能的恶化,其潜在病理生理学机制可能为:(1)血脑屏障受损。在链脲佐菌素诱导的糖尿病大鼠中,因紧密连接蛋白的减少和相应蛋白酶的活性的升高,血脑屏障通透性会增加[26]。(2)血糖变异性增加,导致活性氧(reactive oxygen species,ROS)过度产生,进而诱导线粒体功能障碍、氧化应激受损、促炎因子释放增加和细胞凋亡。Quincozes-Santos等[27]报道血糖波动会使星形胶质细胞中线粒体功能障碍以及内皮细胞损伤。Xue等[28]证实施万细胞因血糖波动造成氧化应激受损,导致神经纤维脱髓鞘、周围神经再生能力下降、轴突萎缩。由血糖波动引起的过量ROS还可激活促炎症因子,如核转录因子-kβ、激活蛋白-1、生长因子-1、肿瘤坏死因子-α和白介素家族等[29]。Hsieh等[30]通过体外实验证实丝裂原激活蛋白激酶和3-磷酸肌醇激酶/蛋白激酶B通路介导了小胶质细胞中大多数氧化应激反应。因此,血糖波动可能通过以上途径损伤人脑,导致糖尿病认知障碍的发生。
本研究的不足之处:(1)71例T2DM患者中只有36例患者有动态血糖数据,且健康对照组未收集相关数据,无法分析血糖波动对健康人大脑结构及认知功能的影响。(2)血糖变异性指标、脑区灰质体积和认知功能三者之间的相关性较弱。推测其原因可能与血糖变异性数据样本量较小以及纳入的T2DM患者症状轻、年龄偏小有关。未来将继续扩大样本量并收集全面数据进行深入研究。
综上所述,T2DM患者存在不同脑区的灰质体积减小及认知水平的降低,且血糖变异性越大,T2DM患者部分脑区灰质体积萎缩越明显,认知功能越差。
作者利益冲突声明:全体作者均声明无利益冲突。
