生物气溶胶监测仪生物计数评价装置的搭建和方法研究
2021-03-04张国城刘佳琪沈上圯潘一廷李晶晶
田 莹, 张国城, 吴 丹, 刘佳琪, 沈上圯, 潘一廷, 李晶晶
(1. 北京市计量检测科学研究院, 北京 100029; 2. 北京大学 环境科学与工程学院,北京 100871)
1 引 言
生物气溶胶是源于生物的,动力学直径在100 μm以内的各类微粒,广泛存在于空气中。病原微生物如SARS-CoV-2、SARS、结核杆菌等通过空气传播,引发呼吸道疾病、过敏、炎症反应等,严重威胁公众的健康安全[1~4]。
传统的病原菌检测方法首先采用固体撞击式采样器或过滤式采样器或液体冲击式采样器等进行采样[5~9];随后根据实际的目的以及场所选择合适的分析方法,如菌落培养法、显微观察法、分子生物学法。总的来说,这些检测方法耗时长,无法满足疾病防控和环境监测的实时需求。
近年来,基于激光诱导荧光的生物气溶胶监测仪迅速发展,其最大的优势在于实时连续监测空气中的颗粒物和微生物。尤其新冠疫情爆发以来,受到了市场的极大青睐。生物细胞包含自发荧光团,例如烟酰胺腺嘌呤二核苷酸(磷酸盐)、特定氨基酸和核黄素等,当通过不同波长的激发光后,产生荧光光谱,从而被识别[10~13]。生物气溶胶监测仪对公共场所、室内外空气质量的监测与分析,可对有害生物气溶胶进行预警。本课题组利用荧光粒子能够被特定光源激发发射荧光现象,初步实现对生物气溶胶监测仪(粒径≥2 μm)的校准[14,15];但目前缺乏以微生物气溶胶为研究对象而建立的有效评价标准和方法。
本文开展了生物气溶胶监测仪量值溯源关键技术的研究。搭建微生物气溶胶的发生装置,通过雾化发菌、流量控制、采样分析等技术手段,比对菌落培养法与生物气溶胶监测仪量值,初步实现对生物监测仪器计数的评价,从而提高生物气溶胶监测仪的准确性、可靠性。
2 实验方法
2.1 装置的搭建与表征
本研究搭建了如图1所示的生物气溶胶校准装置,包括雾化气溶胶发生装置、混匀舱、测量舱、采样器等。为了保障生物检测安全,可放置于普通生物安全柜里进行检测操作,该装置设计高度不超过0.6 m。
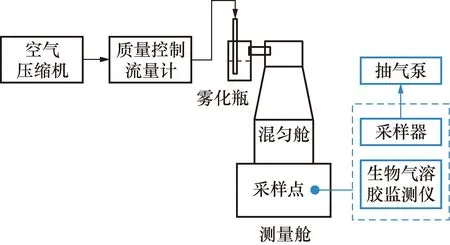
图1 生物气溶胶发生装置的示意图Fig.1 Schematic diagram of bioaerosol generating device
为了表征装置产生气溶胶的稳定性和均匀性,在测量舱内部安装颗粒物传感器对气溶胶浓度进行监测,分别用聚苯乙烯小球和细菌进行表征。通过将与细菌气溶胶粒径相近的聚苯乙烯小球悬浮液以雾化的方式喷出,在混匀舱形成气溶胶。其中,实验中使用的标准物质分别是粒径为1, 2, 2.6 μm的单分散聚苯乙烯微球。再将细菌菌液以雾化的方式喷出,在混匀舱形成稳定的气溶胶。整个实验过程在生物安全柜中进行,每次实验前对所有的装置进行紫外灭菌30 min。
2.2 菌液的准备
本实验使用的菌种是革兰氏阴性菌大肠杆菌和革兰氏阳性菌金黄色葡萄球菌,以及真菌白色念珠菌。挑取培养皿中的单克隆菌落分别放到30 mL的LB液体培养基(成分为酵母提取物,氯化钠,胰蛋白胨)或者YPD培养基(成分为酵母提取物,葡萄糖,胰蛋白胨)中,在37 ℃的恒温振荡器中培养18 h,速度设为220 r/min;之后,在25 mL新鲜LB培养基中加入0.5 mL上述培养的菌悬液,以220 r/min的转速在摇床中培养6 h左右。最后将细菌悬液5 000 r/min离心5 min,去除培养基,用灭菌的超纯水进行清洗,再次离心后重悬在50 mL的超纯水中,用于雾化。本研究中,我们采用冲击式液体采样器BioSampler(SKC Inc.,MSA)采集微生物。相较于安德森撞击采样器,BioSampler通过结合撞击和离心作用,将颗粒物采集到捕集液中,具有更高的物理效率以及生物效率,所得样品可以用于后续生化分析,同时避免了再悬浮效应[16,17]。采样的流量为12.5 L/min,采样的时间为30 min,采样瓶中的介质为20 mL的灭菌超纯水。
2.3 菌落培养法
Biosampler将细菌采集到液体介质中,经过稀释后取100 μL涂布到LB固体培养基上,放置到培养箱中,37 ℃下培养24 h,形成肉眼可见的菌落。通过全自动菌落计数器得到菌落个数,并根据采样体积计算测量舱中可培养菌的浓度。具体可通过以下公式进行计算:
式中:Cculturable为测量舱中可培养微生物气溶胶的浓度;DF是稀释的倍数;CFU是平板上长出的菌落数;Qsampler是采样的流量;tsampler是采样的时间。
2.4 荧光强度分析
通过荧光光谱仪(日立F-7000)检测BioSampler采集的样品的荧光强度,激发波长为280 nm。将荧光信号强度与该样品中可培养细菌数的比值作为这一菌种的相对荧光强度。
3 实验结果
3.1 评价装置的表征
3.1.1 气溶胶的稳定性和均匀性
在舱内采样位置以及中心点的位置放置光散射颗粒物传感器,监测舱内气溶胶浓度的均匀性和稳定性。如图2所示,3种不同粒径的聚苯乙烯微球雾化之后,连续测量舱内中心点位置的颗粒物浓度10 min,平均浓度分别为721.2 μg/m3,252.7 μg/m3, 391.4 μg/m3,采样位置的平均浓度分别为721.4 μg/m3,247.5 μg/m3,389.4 μg/m3,对应的浓度偏差为0.0%,2.1%和0.5%。根据“JJG 846—2015粉尘浓度测量仪检定规程”,符合舱内不同位置的颗粒物浓度平均值偏差不超过 ±5%的要求。因此装置的测量舱内粉尘浓度分布较为均匀。以中心位置监测的浓度来计算,把10 min数据平均分为6段,每段取平均值得到6个数据用来计算测量重复性,得到相对标准偏差分别为1.4%,2.2%和1.1%。满足JJG 846—2015有关重复性相对标准偏差≤5%的要求,说明该装置发生的颗粒物气溶胶稳定性、均匀性较好。
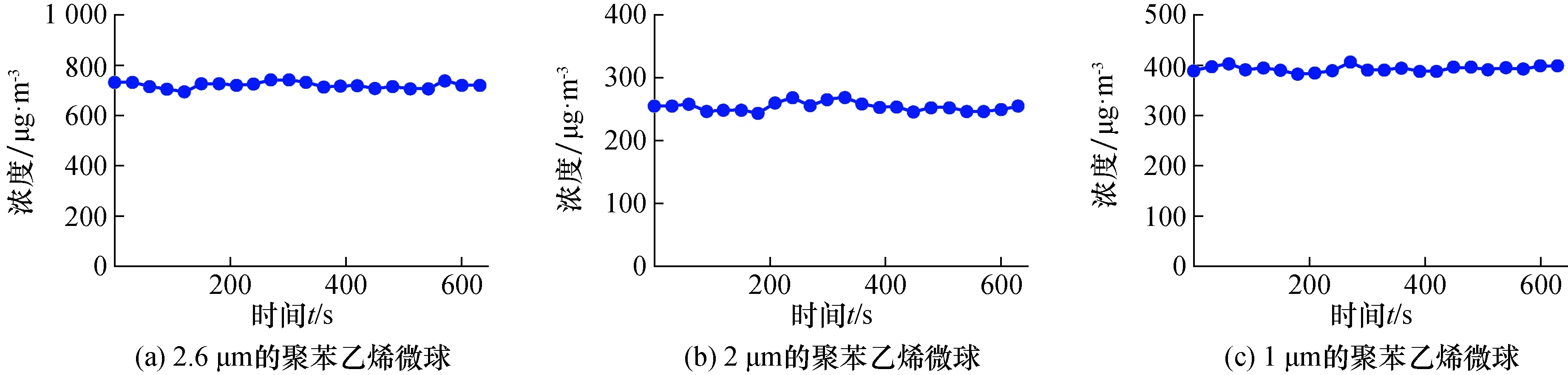
图2 测量舱中的不同粒径的聚苯乙烯微球形成的颗粒气溶胶浓度随时间的变化情况Fig.2 The concentration of aerosol particles formed by polystyrene microspheres of different particle sizes over time in the measurement chamber
同时,为了验证微生物气溶胶在舱内的分布情况,大肠杆菌菌液经过雾化喷出,如图3所示。在600 s内中心位置的气溶胶浓度为472.6 μg/m3,与采样位置监测的浓度平均值的偏差为1.0%,中心位置重复性相对标准偏差为1.6%;表明该装置可以保障微生物气溶胶的稳定性和均匀性,为后续评价生物气溶胶监测仪的性能奠定基础。
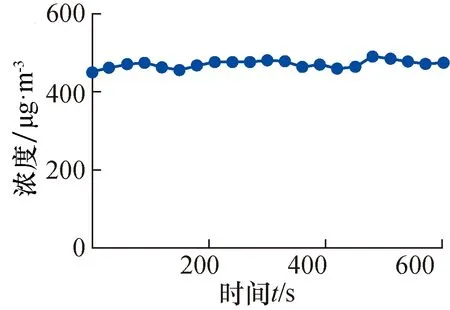
图3 测量舱中大肠杆菌菌液经雾化后形成的微生物气溶胶浓度随时间的变化情况。Fig.3 Changes in the concentration of microbial aerosol formed by the atomization of E.coli liquid in the measuring chamber over time.
3.1.2 响应时间
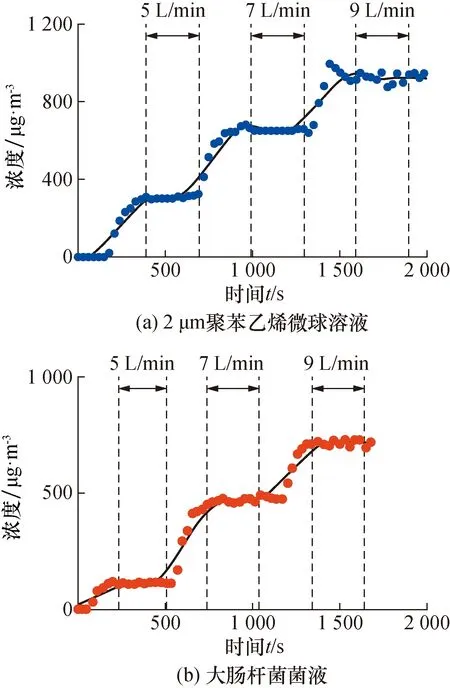
图4 气溶胶浓度随进样流量的变化Fig.4 The change of aerosol concentration with the injection flow rate
为了验证该装置能否快速调节产生不同浓度的生物气溶胶,及调节后浓度多久能达到稳定,我们考察了该装置的响应时间。图4为舱内气溶胶浓度随雾化进气流量增加的变化图,在舱内分别雾化2 μm的聚苯乙烯微球溶液和大肠杆菌菌液,进气流量从5 L/min增加到7 L/min,直至9 L/min,可以看到雾化进气流量越大,产生气溶胶浓度越高;舱内的气溶胶浓度对进样流量的响应时间短,在5 min之内基本达到目标浓度并保持稳定状态。为了保障装置内生物气溶胶浓度达到稳定,我们后续实验都是设置某一条件后至少5 min后才开始检测。
3.2 生物气溶胶监测仪的评价
在验证了生物气溶胶校准装置所产生的生物气溶胶的稳定性和均匀性后,我们以两台国内不同厂家生产的生物气溶胶监测仪(Bioaerosol1,Bioaerosol2)为研究对象,根据GB/T 38517—2020《颗粒生物气溶胶采样和分析 通则》的要求,采用菌落培养法进行观察计数,定量分析捕集液中微生物的含量,研究不同生物气溶胶浓度下监测仪测量结果的准确性。
研究的两种不同品牌的生物气溶胶监测仪的性能,它们的工作原理均基于微生物体内的辅酶NADH和核黄素等荧光物质的存在,使用激光激发后目标颗粒物释放光子,通过光电倍增管同时检测颗粒物的弹性散射和荧光发射,进而得到颗粒物的光学粒径和荧光粒子数,从而达到实时区分生物颗粒和非生物颗粒的目的。我们前期工作研究了荧光微球模拟生物气溶胶用于生物气溶胶监测仪的评价,发现荧光微球个数和仪器示值有较好的线性关系[14]。但是实际细菌等生物气溶胶不像荧光微球形状那么单一、均匀、稳定,因此本文重点研究了生物气溶胶监测仪对细菌颗粒物检测结果的准确性。
为了避免由于雾化流速不同,造成细菌生物气溶胶成活率不同,我们保持雾化流量和稀释流量不变,通过改变所采用菌液浓度,来发生不同浓度的生物气溶胶。我们将初始的大肠杆菌菌液进行1/2梯度稀释,同时用颗粒物传感器进行监测,结果如图5(a)所示,左侧纵坐标为菌落培养法和生物气溶胶监测仪得到的气溶胶浓度,右侧纵坐标为颗粒物传感器监测得到的气溶胶浓度。雾化不同的初始浓度的菌液可以产生不同浓度的生物气溶胶,菌落培养法得到的大肠杆菌气溶胶的浓度在891~22936 CFU/L之间。不管是颗粒物传感器,还是细菌菌落培养法得到的结果,都是随着菌液浓度的稀释,颗粒物(细菌)数浓度下降相应比例,但是和稀释倍数不是完全线性关系。当菌液原液和1/2原液浓度的菌液进行雾化时,菌落培养得到的结果高于2种监测仪的结果;当菌液稀释为1/4和1/8原液浓度时,2种方法得到的结果比较相近。高浓度的初始菌液雾化后形成的生物气溶胶浓度过高,很容易产生细菌的团聚,生物气溶胶监测仪无法通过颗粒物散射和荧光发射得到准确的荧光粒子数。因此,在评价生物气溶胶监测仪时,应根据发生舱的体积以及生物气溶胶监测仪的量程确定初始菌液浓度,保证生物气溶胶浓度控制在合适的范围内。
图5(b)给出了2个型号生物气溶胶监测仪随着细菌浓度变化,仪器示值的变化情况。2种不同品牌的生物气溶胶监测仪得到的气溶胶浓度分别与菌落培养得到的气溶胶浓度线性相关性。结果表明,Bioaerosol2与细菌浓度的线性关系良好,相关因子可以达到0.937 2,表明菌落培养法可以作为一种评价生物监测仪生物计数量值溯源的手段。但是Bioaerosol 1与细菌浓度的线性相关因子只有0.796 6,说明该型号仪器的性能不如Bioaerosol 2。
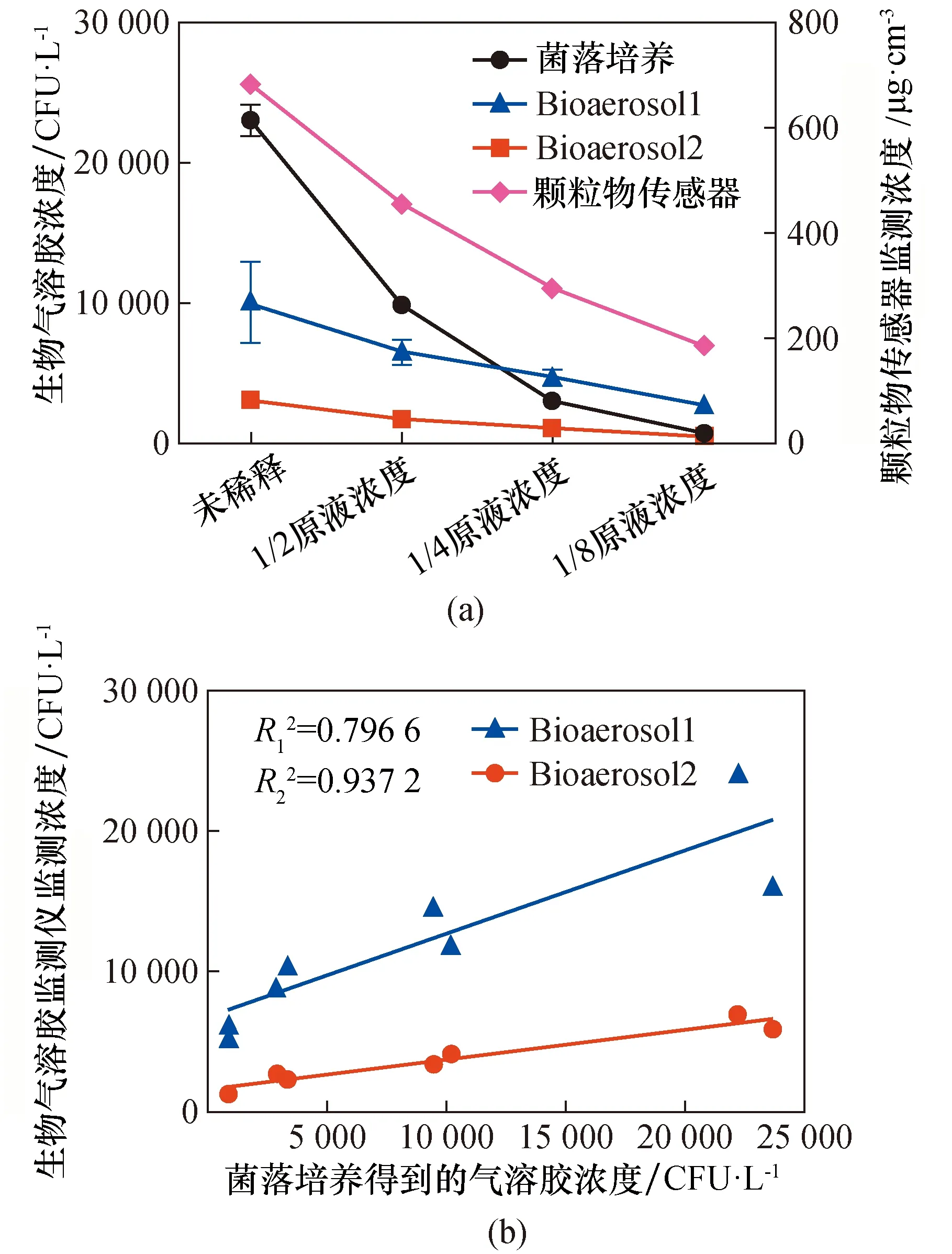
图5 菌落培养法和生物气溶胶监测仪的线性相关性Fig.5 The linear correlation between colony counting method and bioaerosol detector
3.3 不同菌种的影响
我们以Bioaerosol 2为例,研究不同菌种对生物气溶胶监测仪监测结果的影响。根据图5的结果,我们将初始菌液的浓度调整到雾化菌液后生物气溶胶监测仪读数合适的范围内,50~5 000 CFU/L。革兰氏阳性菌金黄色葡萄球菌和真菌白色念珠菌作为研究对象,雾化之后比较菌落培养法和监测仪监测结果的数值差异。如图6(a)所示,通过菌落计数法得到的金黄色葡萄球菌气溶胶浓度为 2 900 CFU/L,监测仪监测的浓度约为3 464 CFU/L,计数效率为119%。对于白色念珠菌而言 (图6(b)所示),菌落计数法的结果是77 CFU/L,监测仪监测的结果是83 CFU/L,两者的比值是107%,表明Bioaerosol 2对金黄色葡萄球菌和白色念珠菌同样具有较好的监测能力。
图6 不同物种对生物气溶胶监测仪监测结果的影响Fig.6 The influence of different species on the monitoring results of the bioaerosol detector
微生物含有相同的自发荧光源,其荧光信号强度与生物分子(NADH,NADPH和核黄素)的含量有关,当荧光信号超过生物气溶胶监测仪设定的阈值后,则判定待检粒子为生物粒子。但是,不同菌种含有的荧光基团种类、数量不同,单个细菌产生的荧光强度也不同。如图7所示,金黄色葡萄球菌和大肠杆菌的相对荧光强度比较低,而白色念珠菌的相对荧光强度远高于这两种细菌,表明相对荧光强度与物种本身有关。白色念珠菌属于真菌,空气动力学直径在2~4 μm,大于金黄色葡萄球菌和大肠杆菌(空气动力学直径在1 μm左右)。前人的研究中提到荧光强度会随着物种的空气动力学直径增加而增强,因为较大的颗粒在代谢上更为旺盛[18,19]。因此,不同菌种的荧光强度是影响生物气溶胶监测仪灵敏度的重要因素。
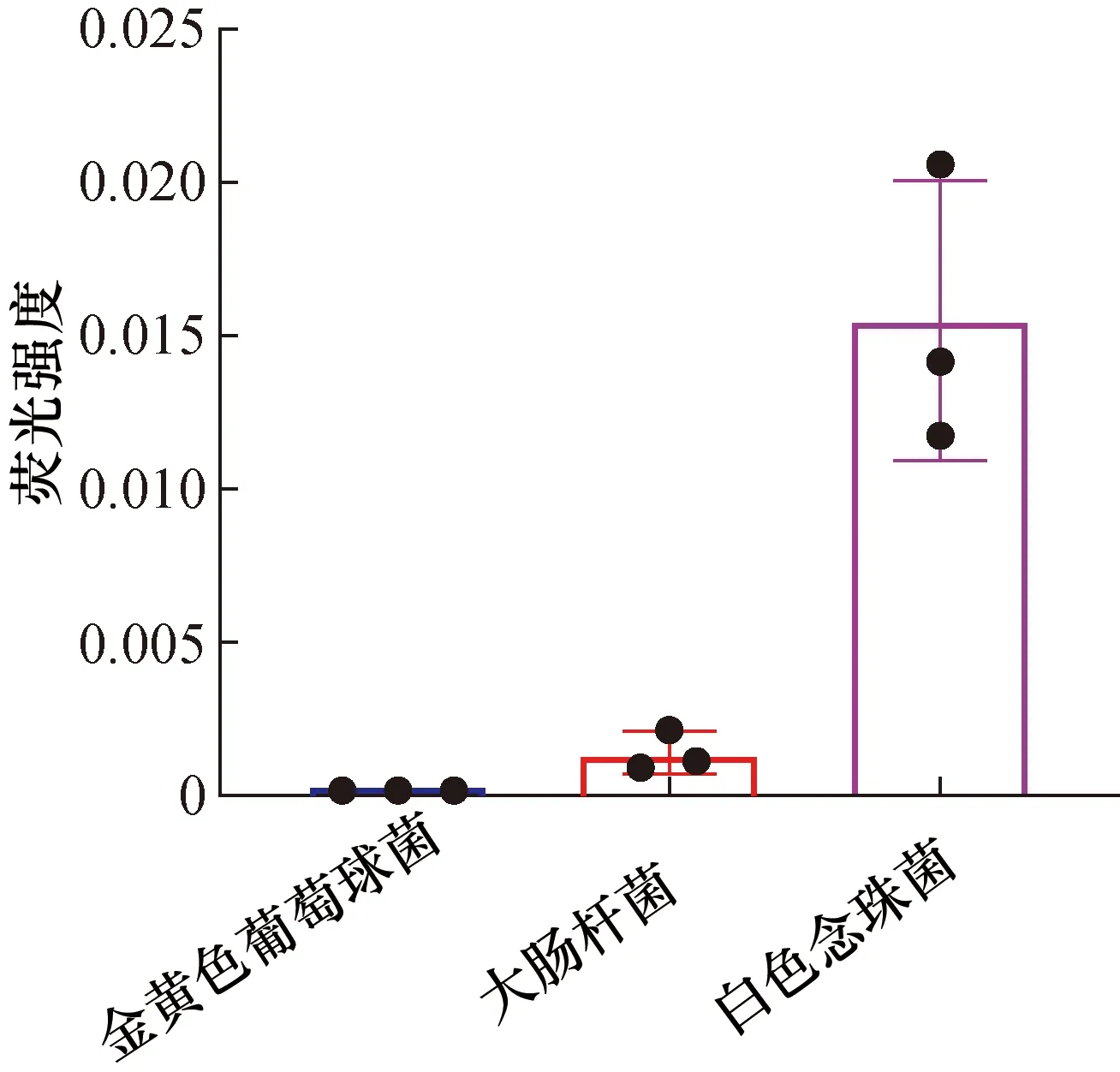
图7 不同菌种的相对荧光强度Fig.7 Relative fluorescence intensity of different strains
4 结 论
本文设计并搭建了微生物气溶胶监测仪评价装置,并分别利用不同粒径单分散聚苯乙烯微球溶液和大肠杆菌进行表征,证实了该装置形成的气溶胶稳定性和均匀性良好,为生物气溶胶的采样和检测提供了保障。通过采用传统的采样菌落培养法检测微生物气溶胶的浓度,对比国产生物气溶胶监测仪的量值,利用两种方法的线性相关性评价生物监测仪生物计数性能指标。研究表明,将细菌个数控制在50~5 000 CFU/L,能保障比对结果的可比性,避免雾化后的生物气溶胶团聚严重,这对于生物气溶胶监测仪的适用监测浓度范围具有一定的指导意义。同时研究发现不同菌种的荧光强度差异较大,在监测不同的细菌时监测仪应该设定不同的荧光阈值,从而保障测量结果的可靠性。
