喀斯特土壤生境下丛枝菌根真菌侵染对任豆根系构型的影响
2021-03-03屈明华俞元春张金池
屈明华, 李 生, 俞元春, 张金池
(1.南京林业大学南方现代林业协同创新中心 南京林业大学林学院,210037, 南京;2.中国林业科学研究院亚热带林业研究所, 311400, 杭州)
根系是植物的重要器官,吸收水分和矿物质养分,稳固和储存同化物[1]。根系形态是描述植物根系随环境变化的重要指标,植物对养分吸收效率与根系构型有关[2]。植物根系构型特征参数主要有根系总长度、根表面积、根系平均直径、比根长、比根面积、根系生物量等。根长是根系形态的重要指标,反映根系空间吸收范围,影响养分和水分吸收,是根系生长发育的重要特征;根表面积反映根系对土壤接触面积,影响植物对土壤资源利用;根系直径影响水分传导效率,直径大,输送水分效率增加[3]。养分胁迫下,植物通过改变根系构型及形态,增加根长度、表面积和根毛数量及密度或形成排根来增强对养分获取[4]。低磷胁迫下,紫穗槐(Amorphafruticosa)能调节光合产物分配格局,使其优先向根系分配,根系生物量增加,根冠比达到最大,与土壤接触面积扩大,从而获得更多磷素,植物通过维持较大比例根冠比来响应低磷胁迫[5]。
丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)能与绝大多数植物根系形成共生体,促进植物养分吸收(尤其是P),提高植物抗旱性[6],对植物生长发育有重要作用。菌根接种不仅影响根系形态,还影响宿主植物的生理状态[7]。AMF与香樟幼苗共生提高了根系生物量、根系总长、根系表面积、根体积[8],导致宿主细根比例降低,粗根比例增加[9]。菌根有利于桑树在极端逆境中生长,提高桑苗主根长、根尖总长,促进植株营养生长[10]。摩西球囊霉(Funneliformismosseae)和根内球囊霉(Rhizoglomusintraradices)有助于菌根释放多种挥发性物质,改变根际环境和根系形态,促进高粱苗(Sorghum)细根直径、总根长和比根长增加[11];提高枳(Poncirustrifoliata)根系表面积、投影面积、根体积和0~1.5 cm短根系总长度[12]。摩西球囊霉、地表球囊霉(Glomusversiforme)和混合接种显著提高枳生物量,诱导1级、2级和3级侧根发生,增加根系投影面积、表面积、体积和总长度(主要是0~1 cm根长),根系平均直径降低[13]。干旱胁迫,接种摩西球囊霉显著增加小马鞍羊蹄甲(Bauhiniafaberivar.microphylla)幼苗总根长、根表面积,中度和轻度胁迫,显著促进小马鞍羊蹄甲根鲜质量、根体积增加[14]。
我国西南喀斯特地区岩溶作用强烈,土层浅薄且不连续,生态环境极其脆弱,是我国水土流失最严重的的地区之一[15],植被恢复困难。接种菌根真菌能显著促进喀斯特地区造林树种植物地上部生长,提高植株对土壤养分元素和水分吸收,养分和干旱胁迫下,菌根真菌能改变植物根系形态,促进植物对水分和矿质元素吸收[16]。任豆(Zeniainsignis)学名翅夹木,是我国特有树种,也是石山地区造林的先锋树种,主要分布于贵州、广西、广东、云南等石灰岩地区[17]。任豆萌芽性强,侧根粗壮发达,穿透能力强,能固氮且耐干旱瘠薄,可在石缝中生长,是我国南方绿化石山的优良速生树种[18]。本研究以喀斯特侵蚀区土壤为基质,任豆为试验材料,供试AMF为喀斯特优势菌属—摩西球囊霉、根内球囊霉[19],研究不同喀斯特土壤养分生境下接种AMF对任豆根系生长和根系构型影响,探讨喀斯特土壤生境下菌根真菌对宿主根系构型特征的影响,为喀斯特地区高基岩裸露,土层浅薄,蓄水能力差的自然条件下植被定植恢复、水土保持提供微生物干扰途径,同时也为喀斯特地区筛选优势菌种提供依据。
1 材料和方法
1.1 试验材料
菌种摩西球囊霉和根内球囊霉由长江大学园艺园林学院提供,接种菌剂含有孢子、菌丝片段和侵染根段。供试土壤采自贵州省普定县喀斯特高原生态综合治理试验示范区,分别为贫瘠喀斯特土壤(简写为S)和20年林龄滇柏林下土壤(简写为D),土壤理化性质见表1。土壤过2 mm筛孔,高压蒸汽灭菌(121 ℃,0.11 MPa,1 h)后作为试验基质。任豆种子采自喀斯特地区任豆次生林,试验前用10%的双氧水表面消毒15 min,灭菌水冲洗多次,备用。试验用塑料盆规格:上口径16 cm、下口径11 cm、高13 cm,用75%酒精表面擦拭消毒。

表1 供试土壤理化性质
1.2 试验设计
试验采用完全随机区组设计,2种土壤处理和4个接种处理(2×4)。其中每个处理9个重复,接种处理设置为:接种摩西球囊霉处理(Fm)、接种根内球囊霉处理(Ri)、混合接种处理(mixture inoculation,Mi)和不接种处理(CK)。接种方法:塑料花盆中装入灭菌土1.5 kg,称取菌剂平铺在灭菌土上,同时点播入消毒并催芽的任豆种子3粒,用灭菌土覆盖。单菌种接种处理按25 g/盆施加菌剂(孢子密度7~12个/g);混合接种处理:2种菌剂按1∶1混合后,再称取25 g菌剂施入花盆中;对照处理不加菌剂,加入经微孔滤膜过滤的菌液和25 g高温灭菌后的混合菌剂,以保持除目的菌外和其他处理土壤微生物组成一致。各处理每3 d用去离子水补充水分,以水分不流出盆底为准。幼苗正常生长30 d后,每盆定苗1株。2018年3月13日播种至2018年8月9日共培育150 d,采集植物样品测定生物量及根系指标。
1.3 测定指标
试验结束后,将植株连同花盆放入水盆中,小心冲掉土壤,以获取完整根系,利用根系扫描仪(Epson Perfection V700)扫描完整根系图像,用Win-Rhizo根系分析系统软件分析根系总根长、总根表面积、总根体积、根系平均直径等。参照吴强盛等[20]方法进行菌根侵染率观察,马放等[21]方法计算菌根依赖性。
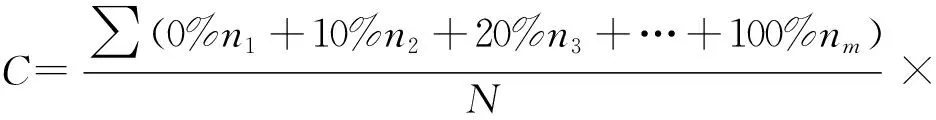
(1)
(2)
式中:C为菌根侵染率,%;ni为侵染根段数,i为1,2,…,m;N为观察总根段数;MD为菌根依赖性,%;M+为接种后植物生物量,g;M-为未接种植物生物量,g。
1.4 数据处理
试验数据利用Excel 2010软件进行计算及绘图,采用SPSS 19.0软件进行统计分析,用LSD多重比较法进行差异显著性检验(差异显著水平P<0.05)。菌根侵染率在方差分析之前利用Excel进行反正弦转换。
2 结果与分析
2.1 任豆根系侵染率
由表2,任豆根系侵染率在不同养分土壤处理和接种处理间有极显著交互作用(P<0.001)。接种处理任豆根系均能形成菌根共生体,未接种处理植株根系也受到侵染,但显著低于接种处理。图1,贫瘠喀斯特土壤,接种处理根系侵染率显著高于CK,Fm处理具有最侵染率,其次是Mi和Ri处理,均达到显著差异水平;滇柏林下土壤,接种处理根系侵染率显著高于CK,Fm和Ri处理侵染率显著高于Mi处理,单接种差异不显著。养分贫瘠土壤上侵染效果好于养分较丰富土壤,Fm侵染率达到89.79%,与不同土壤不同菌种处理达到显著差异水平,Mi略低于Fm为76.22%,Ri处理侵染率尽管低于养分较高土壤上Ri处理,但差异不显著,贫瘠土壤上Mi处理侵染率显著高于养分较高土壤上Mi处理。

表2 土壤处理和接种处理对任豆侵染率与根系形态指标影响的双因素方差分析

图中数据为平均值,不同小写字母表示同一土壤不同接种处理间差异显著(P<0.05);不同大写字母表示不同土壤不同接种处理间差异显著(P<0.05);Fm、Ri、Mi和CK表示摩西球囊霉、根内球囊霉、混合接种和对照处理,下同。The data in the figure are average, and different lowercase letters indicate significant differences in different inoculation treatment of the same inoculated soil at the 5% level by LSD (P<0.05); different uppercase letters indicate significant differences in different inoculation treatment of the different inoculated soil at the 5% level by LSD (P<0.05).Fm,Ri,Mi and CK in the figure represents the Funneliformis mosseae, Rhizophagus intraradices, mixture inoculation and the control, the same below.图1 不同喀斯特土壤不同接种处理任豆幼苗根系菌 根侵染率Fig.1 Colonization rate of Zenia insignis seedlings at different inoculations in different karst soils
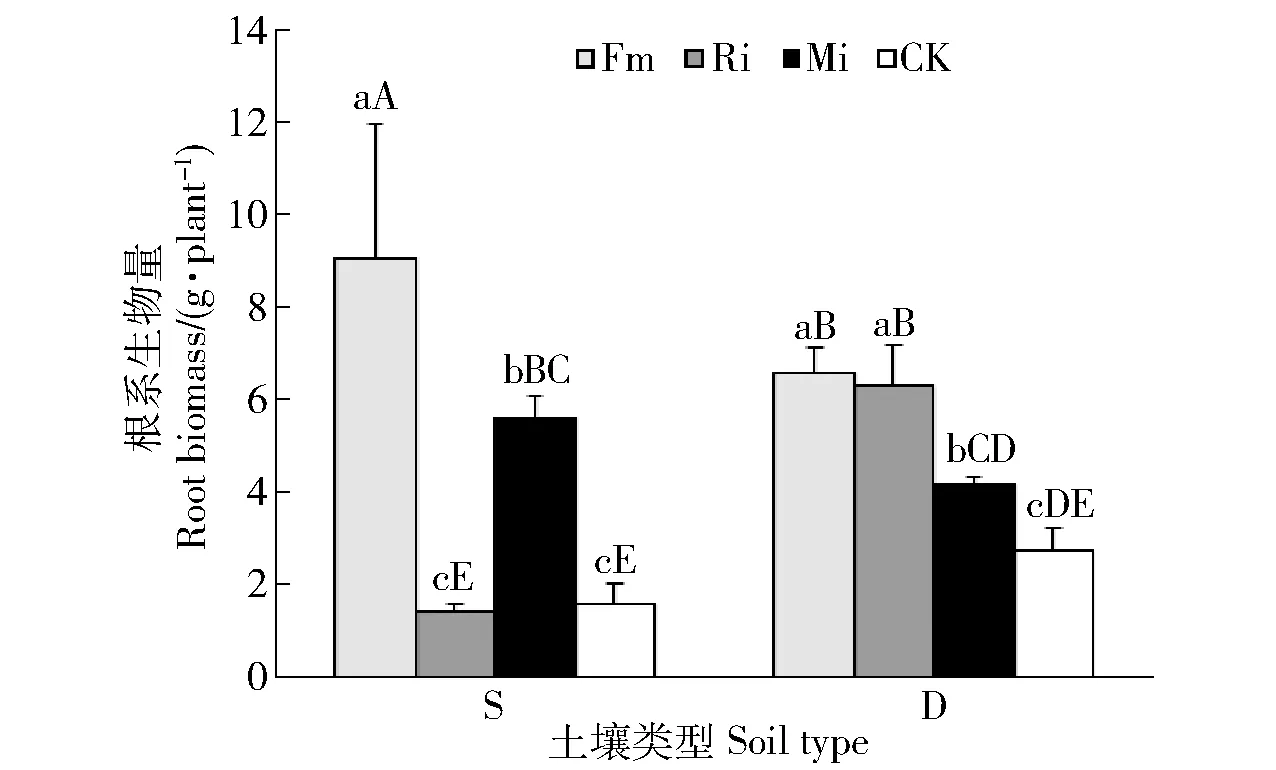
图2 不同喀斯特土壤不同接种处理任豆幼苗根系生物量Fig.2 Root biomass of Zenia insignis seedlings at different inoculations in different karst soils
2.2 任豆根系生物量和菌根依赖性
贫瘠喀斯特土壤Fm和Mi处理均显著提高任豆地下生物量,分别提高460.49%和246.91%,与对照差异显著,2种处理具有高强度菌根依赖性,分别达到366.91%和314.38%,Ri对根系生物量累积无显著影响,菌根依赖性为70.60%,为无依赖;滇柏林下土壤接种处理均促进任豆根系生物量累积,Fm、Ri和Mi处理根系生物量提高分别138.04%、128.62%和51.45%,单接种之间差异不显著,与混合接种差异显著。3种处理菌根依赖性为弱依赖,各处理间差异不显著。不同养分喀斯特土壤生境下,Fm均促进任豆根系生物量累积,贫瘠土壤上累积效应更大,Mi处理在低养分土壤生境下根系生物量累积效应介于单接种之间,Ri在养分较高喀斯特土壤生境下对根系生物量累积效应大(图2和图3)。
2.3 任豆根系总根长
任豆根系总根长在土壤处理和接种处理之间交互作用极显著(P<0.001),不同养分土壤处理差异显著(P<0.05),不同接种处理差异极显著(P<0.001)(表2)。贫瘠喀斯特土壤,Fm和Mi处理总根长提高分别233.91%和44.64%,Ri处理总根长降低46.67%,Fm显著促进任豆总根长生长,Mi和Ri对总根长影响不显著;养分较高喀斯特土壤接种处理任豆根系总根长均高于对照,Fm、Mi和Ri处理分别提高28.51%、39.79%和57.30%,单接种间差异显著,单接种与Mi处理差异不显著。Fm在养分贫瘠喀斯特土壤上显著提高任豆根系总根长,不同土壤不同接种处理达到显著差异水平,Ri在养分较高喀斯特土壤生境下显著促进任豆根系总根长增加(图4)。

图3 不同喀斯特土壤不同接种处理任豆幼苗菌根依赖性Fig.3 Mycorrhizal dependency of Zenia insignis seedlings at different inoculations in different karst soils

图4 不同喀斯特土壤不同接种处理任豆幼苗总根长Fig.4 Total root length of Zenia insignis seedlings at different inoculations in different karst soils
2.4 任豆总根表面积
任豆总根表面积在土壤处理和接种处理之间交互作用极显著(P<0.001),不同养分土壤处理差异显著(P<0.05),不同接种处理差异极显著(P<0.001)(表2)。贫瘠喀斯特土壤Fm和Mi处理总根表面积较CK分别扩大258.99%和70.22%,Ri总根表面积降低42.70%,Fm和Mi与CK差异显著,Ri与CK差异不显著;养分较高喀斯特土壤接种任豆总根表面积均获得提高,Fm、Mi和Ri处理分别提高50.79%、38.89%和66.27%,单接种间差异不显著,Fm与Mi差异不显著,Ri与Mi差异显著。Fm在贫瘠喀斯特土壤上显著扩大任豆总根表面积,不同土壤不同菌种处理差异显著,Ri在养分较高喀斯特土壤生境下显著促进任豆总根表面积增加(图5)。
2.5 任豆总根体积
任豆总根体积在土壤处理和接种处理之间交互作用极显著(P<0.001)(表2)。贫瘠喀斯特土壤,Fm和Mi处理总根体积分别提高292.04%和101.99%,与CK差异显著,Ri处理任豆总根体积降低39.30%,与CK差异不显著;滇柏林下土壤接种处理任豆总根体积均获得提高,Fm、Mi和Ri处理总根体积分别提高76.37%、36.99%和75.68%,单接种间差异不显著,单接种与混合接种差异显著。Fm在贫瘠喀斯特土壤上显著扩大任豆总根体积,不同土壤不同菌种处理差异显著,Ri在养分较高喀斯特土壤生境下显著促进任豆总根体积增加(图6)。
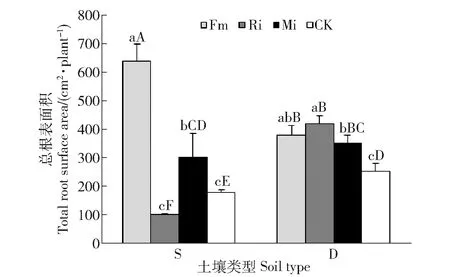
图5 不同喀斯特土壤不同接种处理任豆幼苗总根表面积Fig.5 Total root surface area of Zenia insignis seedlings at different inoculations in different karst soils

图6 不同喀斯特土壤不同接种处理任豆幼苗总根体积Fig.6 Total root volumes of Zenia insignis seedlings at different inoculations in different karst soils
2.6 任豆根系平均直径
任豆根系平均直径在土壤处理和接种处理之间交互作用显著(P<0.05)(表2)。贫瘠喀斯特土壤,Fm、Ri和Mi处理根系平均直径分别提高9.29%、6.14%和23.64%,单接种与CK差异不显著,Mi处理与CK差异显著;滇柏林下土壤,Fm、Ri和Mi处理根系平均直径分别提高20.71%、8.63%和1.29%,单接种与CK差异显著,Mi与CK差异不显著。Mi在养分贫瘠喀斯特土壤上具有最高根系平均直径,Fm和Ri在不同养分喀斯特土壤上对任豆根系平均直径的促进作用没有显著差异(图7)。

图7 不同喀斯特土壤不同接种处理任豆幼苗根系 平均直径Fig.7 Average root diameters of Zenia insignis seedlings at different inoculations in different karst soils
3 讨论
3.1 接种处理对任豆根系生物量影响
丛枝菌根真菌对植物显著效应表现在促进植物生长,特别是在低磷条件下接种效果更显著。AMF促进植物生长不仅表现在正常生态环境条件下,逆境条件下也具有显著效果[22-23]。本试验中,喀斯特土壤无论养分高低,任豆根系均受到AMF侵染,说明摩西球囊霉和根内球囊霉均可与任豆形成内生菌根,相同菌属不同菌株之间侵染效果不同。养分胁迫,摩西球囊霉具有最大侵染率、最强菌根依赖性,显著促进任豆地下生物量提高,而根内球囊霉促生效应不显著,混合接种促生效应介于单接种之间。养分较高喀斯特土壤,接种处理均促进任豆根系生物量提高,Fm和Mi处理提高效应低于贫瘠土壤处理,Ri处理促生效应提高。
菌根植物通常比非菌根植物生长快速且更茂盛,肥力低土壤上更显著。土壤高浓度磷降低了叶片组织中Zn含量和菌根活性,高含量有机质、铵态氮降低了菌根侵染率[24],从而使AMF在肥力较高土壤上促生效果与贫瘠土壤上表现不同。低养分土壤上摩西球囊霉促使任豆地下生物量显著提高,可能为了适应低养分环境,摩西球囊霉具有增强根系觅食养分能力。低养分条件下,植物为寻求矿质养分,根系发育增强、伸长,通过对根冠比增加与根轴增长的方式改变自身根系形态和根系构型,增强对低养分环境适应[25],摩西球囊霉促生效应好,可作为喀斯特石山地区任豆接种的优势菌种,这与姜英等[26]、宋凤鸣等[18]研究结果一致。
3.2 接种处理对任豆根系构型影响
AMF能改变宿主植物根系形态和生理特性,进而影响植物对矿质养分和水分吸收[27]。接种改变根系结构,促进根系发育,诱发生根,增加根系数量[21]。养分和水分胁迫下,植物通过提高细根量,比根长(单位重量的根长)、根冠比、根毛长度来适应环境,从而使植物对菌根依赖性增强[16]。本试验,摩西球囊霉在养分胁迫下显著促进任豆总根长、总根表面积、总根体积增加,这与前人对枳苗[7,28]、高粱苗[11]、土沉香[29]、翅果油树[30]、草莓[31]接种摩西球囊霉显著提高根系长度、根表面积和根体积的研究结果一致。养分较高喀斯特土壤,摩西球囊霉促进根系总根长、总根表面积、总根体积、平均根系直径提高,但提高效应低。Ri在不同喀斯特养分生境下对根系构型影响效应不同,养分胁迫下降低任豆总根长、总根表面积、总根体积,养分较高土壤生境下,Ri显著促进任豆总根长、总根表面积、总根体积、平均根系直径提高。养分胁迫,单接种没有显著增加根系平均直径,混合接种显著促进根系平均直径提高。土壤中矿质养分含量低会增加根系长度,降低根系平均直径[32],摩西球囊霉对根系平均直径影响与对照无显著差异,这与Wu等[7]研究枳(Poncirustrifoliate)接种AMF没有提高平均根系直径结论类似。养分较高喀斯特土壤,单接种显著促进根系直径提高,混合接种根系直径与对照差异不显著。养分胁迫下Mi处理对任豆根系构型影响介于单接种之间(除根系平均直径最高)。
3.3 接种处理对任豆根系促生效应机制
AMF种类对植物生长增强、促生效应不同[7],丛枝菌根改善根系构型依赖寄主植物和AM真菌两者的兼容性[20]。Ri对垂穗披碱草(Elymusnutans)地下生物量、根长具有显著促进效应[33],川梨(Pyruspashia)接种Ri对根系生长促进效应显著高于Fm[34],高养分基质上Ri与桑树共生显著促进根系表面积和总根长增加,与贫瘠养分基质达到显著差异水平[35],本试验中,Ri在养分较高喀斯特土壤上与任豆共生具有良好的兼容性,从而改善根系构型。不同菌根真菌具有不同生态功能,菌丝生长模式、分支频率差异导致菌丝不同的营养策略和对土壤中不同生态位反应,而土壤物理性质及化学性质(颗粒表面积、体积、温湿度、酸碱性以及有机配体、养分浓度)也会影响AMF与植物共生进程,植物和AMF共生体对不同类型养分基质响应不同,具有不同菌根效应[36],从而造成AMF真菌在不同养分基质上对同一宿主植物促生效应不同。AMF与宿主具有一定偏好选择性,同样对不同养分基质也具有一定选择性,因此对于不同养分喀斯特土壤,选择合适的AM菌种与适生植物共生,AMF- 养分基质-宿主三者共生体系养分协调分配利益最大化才能获得最高促生效应,才能显著促进贫瘠喀斯特土壤生境上植被定植、恢复。
4 结论
本试验结果表明任豆根系能与AMF真菌形成侵染结构,低养分条件下,接种摩西球囊霉和混合接种任豆具有高侵染率和强菌根依赖性。不同菌种在不同养分喀斯特土壤上对任豆根系构型促生作用不同,贫瘠喀斯特土壤上,摩西球囊霉显著促进任豆根系生物量累积,促进根系形态向有益于觅食养分方向转变。根内球囊霉对任豆生长促进作用不显著,混合接种介于单接种之间;养分较高喀斯特土壤上,摩西球囊霉对根系促生作用降低,Ri表现出较强的促生效应,促进任豆根系生物量、总根长、总根表面积、总根体积、平均根系直径提高。摩西球囊霉可作为贫瘠喀斯特土壤植被恢复优势菌种,利用菌根生物技术有助于促进喀斯特地区植被恢复。
