基于转录组测序分析研究枸芪多糖对育肥猪肠黏膜免疫功能的作用机理
2021-03-03霍金金褚耀诚陈长增李建东刘凤华
霍金金 褚耀诚 金 娜 李 祯 郝 壮 陈长增 李建东 刘凤华*
(1.北京农学院动物科学技术学院,北京 102206;2.河北北方学院动物科技学院,张家口 075000)
肠道作为动物发挥免疫调节作用的重要场所,与动物机体的健康息息相关,是机体最大的免疫器官。肠道黏膜可以有效阻止细菌或毒素等生物化学物质进入细胞,是机体天然的免疫屏障[1],肠道黏膜系统受损会导致机体内环境紊乱、组织损伤和病理变化,增加疾病的发生[2]。枸芪多糖主要由枸杞、黄芪等天然植物经干燥提炼后配伍而成,具有安全无害、无抗药性、无残留、加工工艺简便等特点[3]。黄芪主要含皂苷、黄酮类化合物、多糖等成分,具有改善动物生产性能、增强机体免疫、抗病毒、抗细菌感染、抗炎症和抗癌症等功能[4-6]。枸杞的主要营养和功能成分有多糖、维生素、氨基酸等,具有抗氧化、免疫调节、抗炎抗癌等作用[7-9]。研究发现,黄芪多糖不仅能够有效促进仔猪的生长发育,还能提高其免疫力,增强细胞免疫功能[10]。在肉鸡养殖中添加枸杞多糖能够提高其脾脏、法氏囊、胸腺的白细胞介素-2(IL-2)和白细胞介素-6(IL-6)的基因相对表达水平,促进机体的正常代谢,提高肉鸡的免疫力[11]。枸杞多糖对免疫抑制小鼠具有免疫增强作用,可调节肠道黏膜免疫系统[12]。黄芪多糖和复方多糖可促进鸡免疫器官的生长发育,提高机体的免疫功能[13]。黄芪多糖和枸杞多糖也是增强T细胞功能的免疫增强剂[14-16]。Chen等[16]研究表明,粗多糖可以提高动物的免疫力,其中最有效的方式是刺激转录因子中的活化T细胞核因子(NFAT)和刺激蛋白-1(AP-1),抵抗机体的炎症反应,阻挡病原体造成的感染,从而得到提高免疫能力的目的。
本项目组前期研究发现,枸芪多糖可有效提高育肥猪的生长性能,降低腹泻率,改善肠道形态和菌群结构[17-18],这些变化与肠黏膜免疫有着很大关联,但关于把枸杞和黄芪提炼为枸芪多糖探究其对育肥猪肠道免疫的潜在分子机制的影响尚不明确。鉴此,本研究进一步研究枸芪多糖对育肥猪肠黏膜免疫功能的作用机理,以期为枸芪多糖在育肥猪生产中的应用提供更多参考。
1 材料与方法
1.1 试验材料
枸芪多糖为本实验室自制,枸杞与黄芪1∶1混合后取1 500 g,加10倍量的水煎煮、干燥,加淀粉至900 g,粉碎,混匀,经提取、浓缩、干燥后制得,每克枸芪中提取的复合多糖含量为106 mg。
1.2 试验动物与试验设计
选用80~90日龄、初始体重为(50±3)kg、血缘和胎次相近的健康杜×长×大三元杂交育肥母猪180头,随机分成对照组和试验组,每组6个重复,每个重复15头猪。对照组饲喂基础饲粮,试验组在基础饲粮中添加0.1%枸芪多糖,试验期90 d。基础饲粮组成及营养水平见表1。
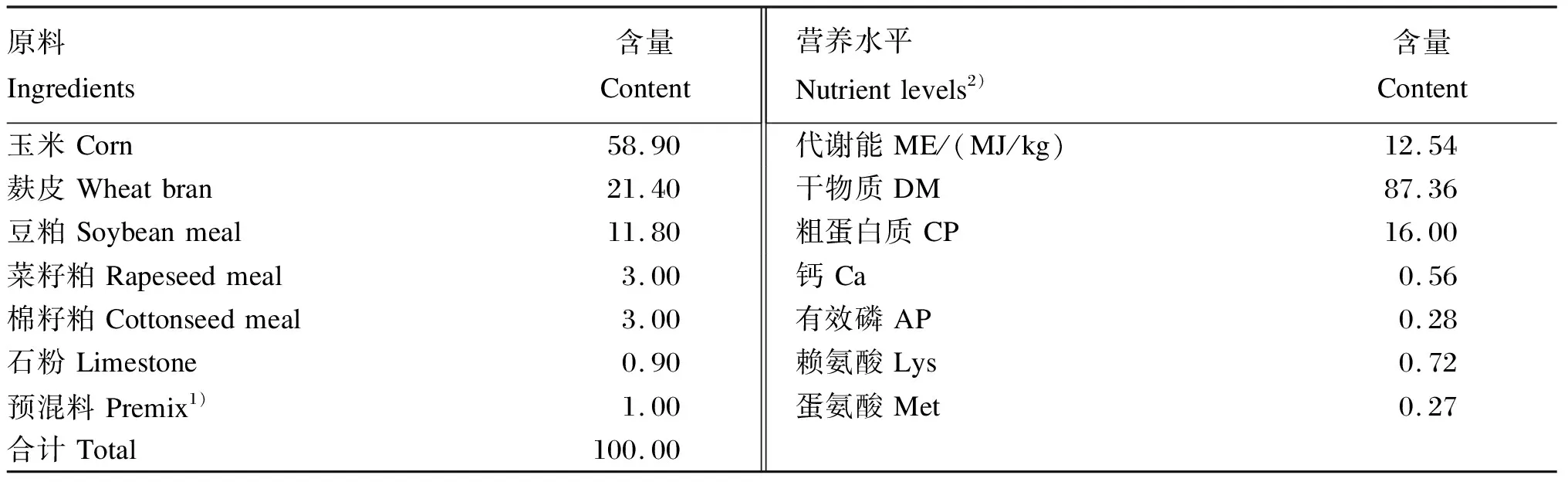
表1 基础饲粮组成及营养水平(干物质基础)
1.3 饲养管理
试验开始前对猪舍及料槽、水槽全面消毒,试验猪分栏饲养,按常规免疫程序进行免疫和驱虫,自由采食和饮水。
1.4 样品采集与处理
1.4.1 空肠组织总RNA提取
试验结束后,从每组随机选取3头育肥猪进行屠宰,迅速剪取3 cm左右的空肠肠段,冲洗后装入5 mL的无菌离心管中,立即放入液氮中保存待检,并严格按照总RNA提取试剂盒说明书对样品中总RNA进行抽提。
1.4.2 建库测序与分析
根据HiSeq平台,采用Illumina TruseqTMRNA sample prep Kit方法进行文库构建。利用带有Oligo(dT)的磁珠与ploy A进行A-T碱基配对,富集mRNA。将富集得到的mRNA随机打断成300 bp左右的小片段,再以mRNA为模板反转录成cDNA,合成稳定的双链结构,在3’末端加上一个A碱基,连接Y字形的接头,对连接adapter后的产物进行纯化和片段分选,用分选产物进行PCR扩增,纯化得到最终的文库。Illumina HiSeq X10上机测序。用Trim Galore软件对原始测序数据(raw reads)进行过滤得到高质量有效读段数据(clean reads),利用HISAT2软件将clean reads与猪的参考基因组比对,将比对成功的clean reads组装成Unigene,然后分析基因表达量。
1.4.3 转录组测序差异表达基因的实时荧光定量PCR(qRT-PCR)验证
选择同批次的RNA样本进行qRT-PCR验证,验证测序结果的可靠性。总RNA样品经反转录后,用TIANGEN的SYBR Green试剂盒进行基因表达荧光定量分析,反应体系共20 μL:1 μL cDNA,上、下游引物各1 μL,6.7 μL 经焦碳酸二乙酯(DEPC)处理过的灭菌蒸馏水,10 μL SuperReal PreMix Plus,0.3 μL ROX Reference Dye。反应条件:95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火30 s,72 ℃延伸30 s,循环35次,用2-ΔΔCt法分析。qRT-PCR所用基因引物序列见表2。

表2 基因引物序列
1.4.4 蛋白免疫印迹(western blot)检测信号通路
将提取的组织匀浆液于4 ℃、12 000×g离心5 min后取上清液即为全蛋白溶液。将提取的蛋白进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)(上样量为15 μg),将蛋白转移至硝酸纤维素(NC)膜,封闭2 h后,进行孵育,一抗孵育2 h,二抗孵育40 min,利用Odyssey成像系统扫描NC膜,分析结果。
1.5 数据处理与分析
数据采用SPSS 16.0软件进行处理,采用单因素方差分析(one-way ANOVA)并进行组间差异显著性比较,P<0.05表示差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 测序数据统计
通过Illumina HiSeq X10平台得到转录组测序数据,6个样本的clean reads条数从51 700 340到58 609 640,共得到329 895 374条clean reads(表3),可以定位到猪基因组上的clean reads数占84%以上,在参考序列上有唯一比对位置的序列数占比为76%~79%,有多个比对位置的序列数占7.0%~8.5%,各个样本定位到参考基因组不同区域的分布比例相似,75.99%~78.02%定位到编码区(CDS),其余依次定位到3′端非编码区、基因间区、内含子区和5′端非编码区。

表3 育肥猪空肠组织转录组测序数据
2.2 差异表达免疫基因
转录组测序数据显示,以P-adjust<0.05,|log2FC|≥0.75为筛选条件,共鉴定出试验组相对对照组有479个基因发生显著变化,其中免疫基因有75个发生显著变化,包括26个基因表达上调,以及49个基因表达下调(表4)。对表达水平相似的差异基因进行层级聚类分析,构建聚类热图(图1),从图中可清晰地看出不同基因的表达量情况。聚类热图中,颜色越红表示表达量越高,颜色越蓝表示表达量越低。
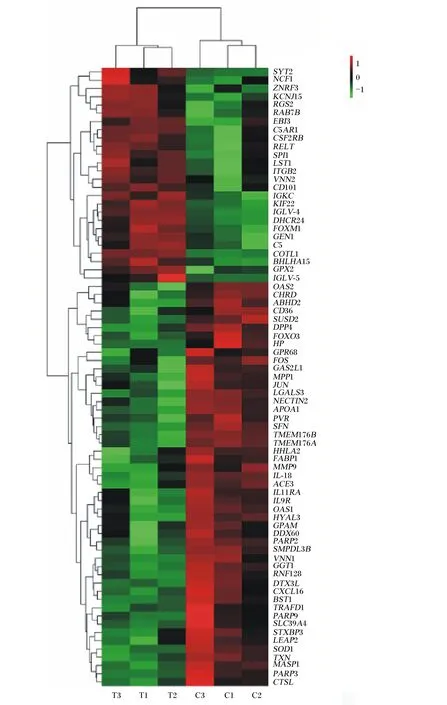
C1:对照组样本1;C2:对照组样本2;C3:对照组样本3;T1:试验组样本1;T2:试验组样本2;T3:试验组样本3。

表4 75个差异表达免疫基因
2.3 差异表达免疫基因的生物功能分析
为了探究差异表达免疫基因与表型之间的关系,将全部差异显著的免疫基因进行基因本体(GO)富集和信号通路(pathway)分析,发现2组间存在差异的生物学过程。GO富集分析结果如图2所示,差异表达基因主要在免疫效应过程、免疫调节、免疫应答和应激反应等生物学过程有较高的富集值。信号通路分析结果如图3所示,差异表达基因主要在白细胞介素-17(IL-17)信号通路、NOD样受体(NLR)信号通路有较高的富集值,说明这2个信号通路作为差异调控肠道变化的主要靶信号通路。
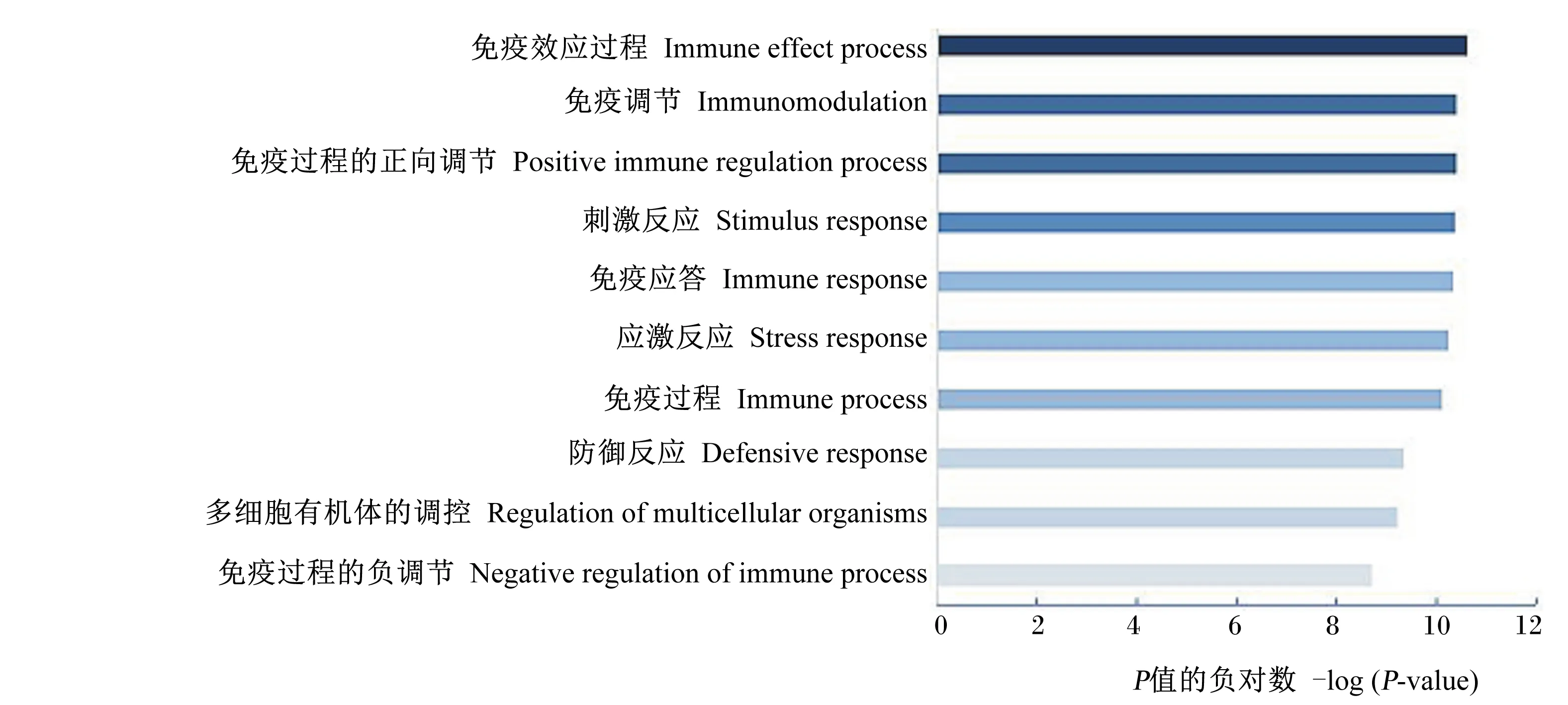
图2 差异表达免疫基因GO富集分析

图3 差异表达免疫基因信号通路分析
将差异表达免疫基因与其相关生物学功能形成基因网络图(图4),发现原癌基因Jun(JUN)和原癌基因Fos(FOS)是其中2个最关键的差异基因,JUN和FOS基因表达产物Jun和Fos蛋白组成的二聚体复合物AP-1是细胞核内重要的转录因子,可以接收细胞外界刺激信号进而调节下游基因。结合之前的GO富集发现,基因网络图的节点位置很多蛋白都与免疫相关,除了JUN和FOS,白细胞介素-18(IL-18)、脂肪酸结合蛋白1(FABP1)、基质金属蛋白酶9(MMP9)、趋化因子配体16(CXCL16)、补体5(C5)、补体C5a受体1(C5AR1)、谷胱甘肽过氧化物酶2(GPX2)、多聚腺苷二磷酸核糖聚合酶(PARP9)基因也是关键的差异基因(表5),主要参与免疫应答、体液免疫、DNA损伤、抗氧化损伤修复和细胞凋亡过程,这些基因的表达在枸芪多糖作用于机体后调控肠道免疫功能方面起到了重要作用。

表5 关键免疫基因

图4 差异表达免疫基因网络图
2.4 差异表达免疫基因的qRT-PCR验证
为了验证转录组测序的准确性,对JUN、FOS、C5和IL-18这4个差异基因进行qRT-PCR验证,图5结果表明,结果与转录组数据结果趋势一致,说明转录组测序数据具有可靠性。
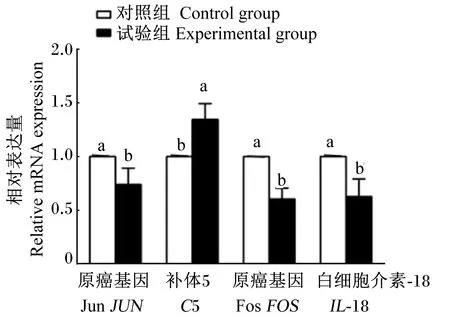
数据柱形标注相同字母表示差异不显著(P>0.05),不同字母表示差异显著(P<0.05)。下图同。
2.5 Jun和Fos的Western Blot分析
通过转录组分析得到JUN和FOS是2个肠黏膜差异表达的关键基因,在试验组中表达下调。Western Blot证实试验组的Jun和Fos蛋白表达水平明显低于对照组(图6),灰度分析见图7,结果均显示Jun和Fos蛋白表达水平显著低于对照组(P<0.05),其结果和聚类热图结果相符合。

图6 Jun和Fos的Western Blot验证
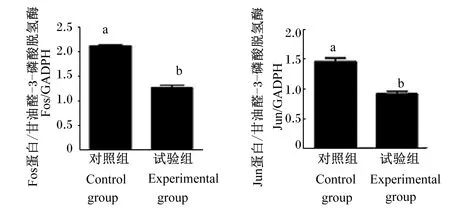
图7 定量验证Jun和Fos表达水平
3 讨 论
肠道是机体最大的免疫器官,具有消化吸收、排毒、强化免疫等生物学功能,机体自身的免疫力、饲粮结构等均会直接影响肠道功能的正常运作[19]。已有相关转录组测序研究得出,一些差异表达基因与免疫力有关[20-21]。本文采用转录组测序技术,通过枸芪多糖组和对照组免疫基因比较分析,发现共有75个差异基因发生显著变化,26个基因显著上调,49个基因显著下调,基因的上调和下调影响着一些表达蛋白和因子分泌发生变化,通过一系列的信号通路过程最终对机体产生重要影响。
通过GO富集发现差异基因主要参与免疫调节、免疫应答和应激反应,信号通路分析发现免疫基因表达主要集中在IL-17信号通路和NOD样受体信号通路,这2个信号通路作为差异调控肠道变化的主要靶信号通路。将差异免疫基因与其相关生物学功能形成基因网络图,发现JUN、FOS、IL-18、FABP1、MMP9、CXCL16、C5、C5aR1、GPX2、PARP9的基因表达情况差异极显著,差异免疫基因与其相关生物学功能形成基因网络图,显示JUN和FOS是其中2个最关键的差异基因。
炎症相关差异表达的重要基因JUN和FOS,在参与机体的免疫应答方面有着重要的影响,Jun蛋白和Fos蛋白组成的二聚体复合物AP-1是细胞核内重要的碱性亮氨酸拉链转录因子,以磷酸化的c-JUN/c-FOS形式与基因序列上的AP-1结合位点结合[22]。在炎症、肿瘤发生时AP-1是调节炎症因子表达的重要转录因子[23],是IL-17信号通路、丝裂原活化蛋白激酶(MAPK)信号通路和c-Jun N端激酶(JNK)通路等炎症信号通路的下游信号因子。当受到上游信号刺激后下游因子被激活,后续引发一系列链式反应,从而使得炎症反应发生。当机体受到刺激,AP-1接收到上游信号被激活后,会由胞浆进入到胞核中,使炎症因子发生转录[24]。本试验发现枸芪多糖使Jun蛋白和Fos蛋白表达明显降低,表明枸芪多糖组的炎症反应受到抑制,AP-1没有被激活,未使炎症因子发生转录,使得通路未被激活。炎症因子通常作为免疫调节的生物标记,炎症过程是先天性免疫反应的重要组成部分,这也说明枸芪多糖可以通过调控炎症因子的激活,调节白细胞介素和趋化因子的表达来发挥抗炎作用,调节肠道免疫功能。JUN、FOS、IL-18、FABP1、MMP9、CXCL16、C5、C5aR1、GPX2、PARP9这些基因主要富集在IL-17信号通路、NOD样受体信号通路,故推测枸芪多糖可能通过作用于IL-17信号通路、NOD样受体信号通路抑制AP-1入核调控炎症相关基因的转录,抑制炎症因子发生,从而对育肥猪肠道进行免疫保护。
Okamura等[25]发现,IL-18是白细胞介素-1(IL-1)家族蛋白中的一员,作为促炎因子的IL-18在一些疾病发生中显著表达,如肿瘤、胃肠疾病、动脉粥样硬化等。本试验发现,枸芪多糖使IL-18的基因表达被抑制。补体系统是体液免疫的重要组成部分,被激活后发挥调理吞噬、介导炎症、免疫调节及清除免疫复合物等多种生物学效应。C5是补体系统的重要组成成分,研究表明,C5参与体液免疫,补体系统在炎症和抗感染中发挥重要作用[26]。本试验中,饲粮中添加枸芪多糖育肥猪体内C5表达水平显著增加,表明枸芪多糖可增强机体补体系统,进而增强肠道黏膜免疫力。
4 结 论
本试验通过转录组分析,在饲粮中添加枸芪多糖能够增强肥育猪肠黏膜免疫功能,枸芪多糖可能通过调节JUN、FOS、IL-18等免疫相关基因的表达,影响IL-17和NOD样受体信号通路,以此来抑制炎症反应。
