人工饲粮对幼年工蜂生长发育及生理代谢的影响
2021-03-03庄明亮李剑飞李志勇牛庆生陈东海
庄明亮 李剑飞 李志勇 王 志 牛庆生 陈东海 葛 蓬 张 发
(吉林省养蜂科学研究所,吉林 132108)
蜜蜂作为重要的传粉昆虫,具有巨大的生态价值和经济价值[1-2]。其中,工蜂是蜂群中的主要组成部分,负责采集花粉花蜜、修造巢脾、哺喂幼虫等除了生殖以外的所有任务。研究工蜂的营养代谢,寻求合理、均衡的蜜蜂饲粮,在蜂群无法获得天然饲粮或者特殊环境中使用时,有利于工蜂的生长发育和延长工蜂的寿命,对于养蜂生产意义重大。
近年来,蜜蜂的营养研究取得了阶段性进展,但主要集中在蜜蜂幼虫发育时期的蛋白质[3-5]、维生素[6-7]、矿物质[8]等营养需要,缺少对成年工蜂营养的系统研究。蜂粮是成年工蜂的天然食粮,是蜜蜂从蜜源植物中采集的花粉混入花蜜和分泌物贮存在蜂巢中后发酵的不规则团状物[9]。有研究表明,蜂粮中营养成分特别复杂,含碳水化合物、蛋白质、脂肪、维生素、类黄酮和类胡萝卜素等[10-12],对维持蜂群正常的发育生长有着至关重要的作用[13-14]。
本试验通过饲喂蜜蜂含有一定比例蜂粮、花粉、蔗糖粉的饲粮,与传统的炼糖饲料进行对比,筛选出最优配方的饲粮,通过液相色谱/质谱联用技术(liquid chromatograph mass spectrometer,LC-MS)检测其对幼年工蜂代谢图谱的影响,通过主成分分析(principal component analysis,PCA)、偏最小二乘法判别分析(partial leastsquares discriminant analysis,PLS-DA)和正交偏最小二乘法-判别分析(orthogonal partial leastsquares-discriminant analysis, OPLS-DA),筛选对工蜂代谢影响的差异代谢物,并结合代谢通道数据库京都基因和基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)探讨代谢通路,发掘对蜜蜂生长发育和寿命起关键作用的营养因素,为合理配制工蜂饲粮提供理论基础。
1 材料与方法
1.1 试验材料
1.1.1 蜂群
试验蜂群为吉林省养蜂科学研究所饲养的意大利蜜蜂(Apismelliferaligustica),蜜蜂群势13足框,蜂子比为0.9,3.0张封盖蜜脾、0.5张粉脾的健康蜂群。
1.1.2 试剂与原料
蜂粮(取自健康蜂群,现取现用)、花粉(杂花粉)、蜂蜜(7月蜂场自取波美度42°成熟椴树蜜,保存于干燥通风的室内)、蔗糖粉(食品级研磨80目颗粒,广西大新湘桂制糖有限公司)、甲醇(色谱纯,上海筠安分析技术有限公司)、甲酸(色谱纯,上海筠安分析技术有限公司)、乙腈(色谱纯,上海筠安分析技术有限公司)、L-2-氯苯丙氨酸(色谱纯,生工生物工程股份有限公司)等。
1.2 试验饲粮
以蔗糖粉、蜂粮、蜂蜜和花粉为原料,按照一定比例混合配制5种饲粮。对照组饲粮:蔗糖粉和蜂蜜按3∶1比例进行充分揉搓,装入饲粮盒5 g备用;试验组A饲粮:蔗糖粉、蜂粮、蜂蜜按照6∶5∶1比例充分揉搓,装入饲粮盒5 g备用;试验组B饲粮:蔗糖粉、蜂粮、蜂蜜按照6∶3∶1比例充分揉搓,装入饲粮盒5 g备用;试验组C饲粮:蔗糖粉、花粉、蜂蜜按照6∶5∶1比例充分揉搓,装入饲粮盒5 g备用;试验组D饲粮:蔗糖粉、花粉、蜂蜜按照6∶3∶1比例充分揉搓,装入饲粮盒5 g备用。饲粮盒为长方体(长×宽×高=15 cm×4 cm×3 cm),顶面用铁纱,其余为木质结构。饲粮组成见表1。
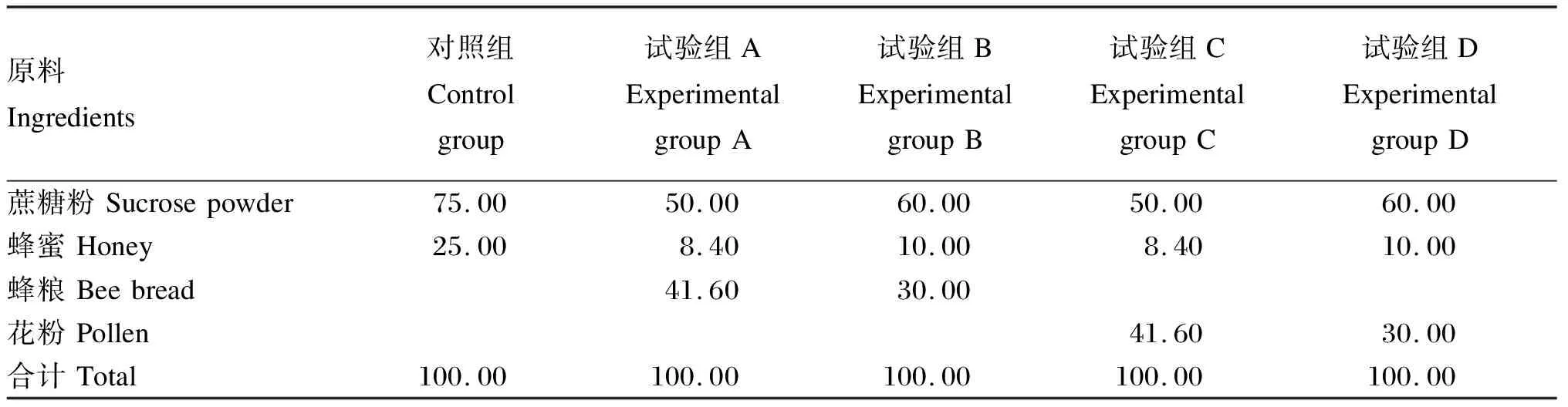
表1 饲粮组成
1.3 试验方法
试验前准备空巢脾,放到继箱里利用工蜂清理干净。将清理干净的巢脾放入巢箱中间位置,并用框式限王产卵器限制蜂王在此巢脾上产卵12 h,然后将蜂王取出,把产卵巢脾放入继箱中,工蜂出房前1天放到34.5 ℃培养箱里,待工蜂出房,即1日龄工蜂。试验抓取1日龄工蜂在室内常温(25~29 ℃)饲养,分为5组,模拟蜂王邮寄时饲喂工蜂情况,一次性补足上述5种人工饲粮。每组做3个平行。
1.4 指标的观察和测定
1.4.1 蜜蜂死亡情况的观察
每组饲粮盒内装入30只1日龄的工蜂,放在室内常温(25~29 ℃)饲养。每天定时观察蜜蜂的死亡情况,作记录并清理死蜂。
1.4.2 咽下腺重量测定和观察
室内饲养对照组和试验组A第1、3、5和7天后,每组取7只工蜂,剪下工蜂头部用浓度75%的酒精进行表面消毒,并剪去触角,用昆虫针固定在蜡盘中间。在解剖显微镜下用小手术剪刀剪除复眼,然后用昆虫针挑去咽下腺周围的头涎腺后,轻轻取出咽下腺。把刚解剖好的咽下腺用天平进行称重。然后把咽下腺放在干净的载破片上,滴1滴蒸馏水,让咽下腺展开,置于显微镜下观察颜色和饱满程度。
1.4.3 代谢组学分析测定
1.4.3.1 样品采集
对照组和试验组A室内饲养7 d,取样生命体征正常的蜜蜂(以能自由爬动为准),2只成年工蜂装入1个2 mL离心管中,放入液氮中冷冻2 h转入-80 ℃冰箱保存,每组6个重复。
1.4.3.2 样本前处理
研磨整只蜜蜂,称取30 mg,加入内标(L-2-氯苯丙氨酸,0.3 mg/mL;Lyso PC17∶0,0.01 mg/mL,均为甲醇配制)各20 μL和400 μL的甲醇∶水(体积比为4∶3);加入2个小钢珠,在-20 ℃放置2 min预冷,加入研磨机(60 Hz,2 min);冰水浴中超声提取10 min;-20 ℃静置20 min;离心10 min(13 000 r/min,4 ℃),取300 μL上清液挥干,然后400 μL甲醇-水(体积比为1∶4)复溶,涡旋30 s,超声2 min;离心10 min(13 000 r/min,4 ℃),用注射器吸取150 μL的上清液,使用0.22 μL的有机相针孔过滤器过滤后,转移到LC进样小瓶,-80 ℃下保存,直到进行LC-MS分析。
1.4.3.3 检测条件
色谱条件:色谱柱为ACQUITY UPLC BEH C-18色谱柱(100 mm×2.1 mm,1.7 μm),流速0.35 mL/min,柱温45 ℃;流动相A为0.1%甲酸,流动相B为甲醇。流动相梯度洗脱程序见表2。

表2 流动相梯度洗脱程序
质谱条件:质谱采用电喷雾离子源(ESI),喷雾电压正离子3 500 V负离子3 100 V,鞘气体流速35 arb,辅助气体流速10 arb,毛细管温度320 ℃。
1.5 数据统计分析
试验数据通过预处理,利用代谢组学处理软件Progenesis QI v2.3 软件(Nonlinear Dynamics, Newcastle, UK)分析,利用PLS-DA、OPLS-DA得分图和PLS-DA排序点图验证模型是否稳定和出现过拟合现象,用变量投影重要度(variable importance in the projection,VIP)分析结合t检验来筛选差异代谢物。计算方法为R语言的Cor函数,其中Q2代表模型预测率,R2代表模型可解释率,Q2>0.5表示模型具有较好的判别分析能力,Q2和R2越接近说明模型越稳定可靠无过拟合现象。基于精确质量数、二级碎片以及同位素分布,使用KEGG、人类代谢组数据库(the human metabolome database,HMDB)、Lipidmaps(v2.3)以及Metabolite Link(METLIN)数据库并结合文献进行定性。
2 结 果
2.1 不同饲粮对蜜蜂死亡数量的影响
由表3可知,各组蜜蜂在第1和2天时均没有出现死亡;试验组C和试验组D均在第3天时出现死亡,在第5天时30只工蜂全部死亡;试验组B在第3天时出现死亡,在第6天时30只工蜂全部死亡;对照组和试验组A第1~5天时均没有出现死亡,在第6和7天时试验组A蜜蜂死亡数量均显著低于对照组(P<0.05)。
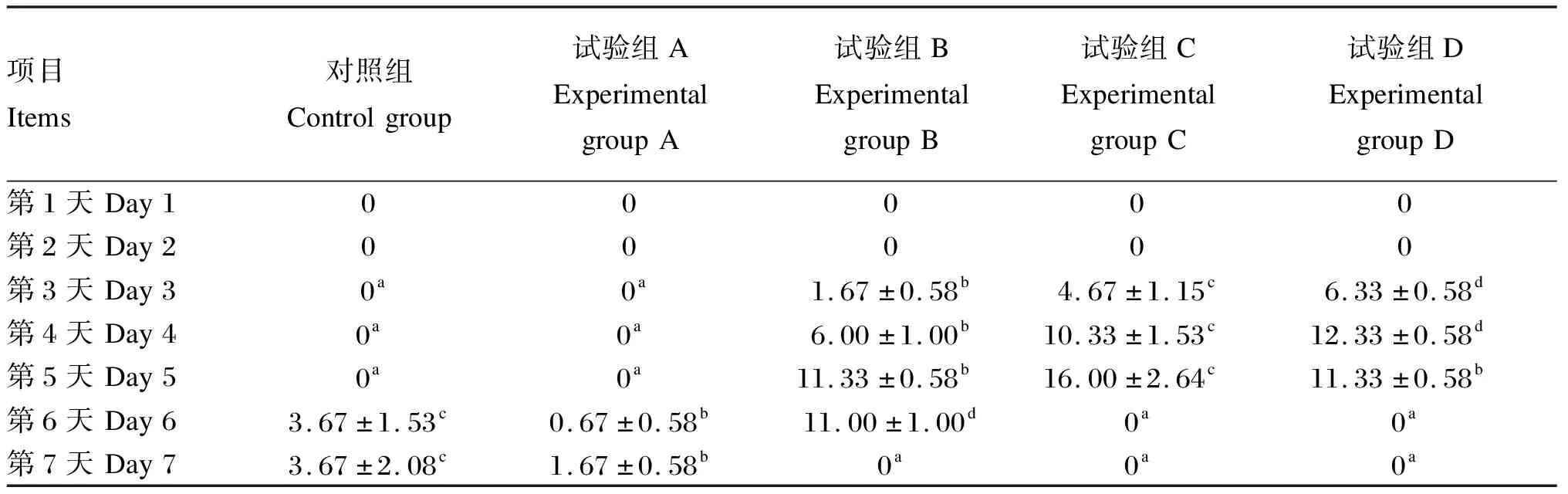
表3 不同饲粮对蜜蜂死亡数量的影响
2.2 不同饲粮对蜜蜂咽下腺发育的影响
由表4可知,工蜂食用人工饲粮第1天时,对照组和试验组A咽下腺平均重量差异不显著(P>0.05);咽下腺颜色均为水白色;咽下腺小体饱满度均为不饱满。工蜂食用人工饲粮第3天时,对照组和试验组A咽下腺平均重量差异不显著(P>0.05);对照组咽下腺颜色为水白色,试验组A咽下腺颜色为少数乳白色,多数水白色;咽下腺小体饱满度均为不饱满。工蜂食用人工饲粮第5天时,对照组和试验组A咽下腺平均重量差异不显著(P>0.05);对照组咽下腺颜色为少数乳白色,多数水白色;试验组A咽下腺颜色为少数水白色,多数乳白色;对照组咽下腺小体饱满度为不饱满,试验组A咽下腺小体饱满度为较饱满。工蜂食用人工饲粮第7天时,对照组和试验组A咽下腺平均重量差异显著(P<0.05);对照组咽下腺颜色为少数乳白色,多数水白色;试验组A咽下腺颜色为全部乳白色;对照组咽下腺小体饱满度为较饱满,试验组A咽下腺小体饱满度为饱满。
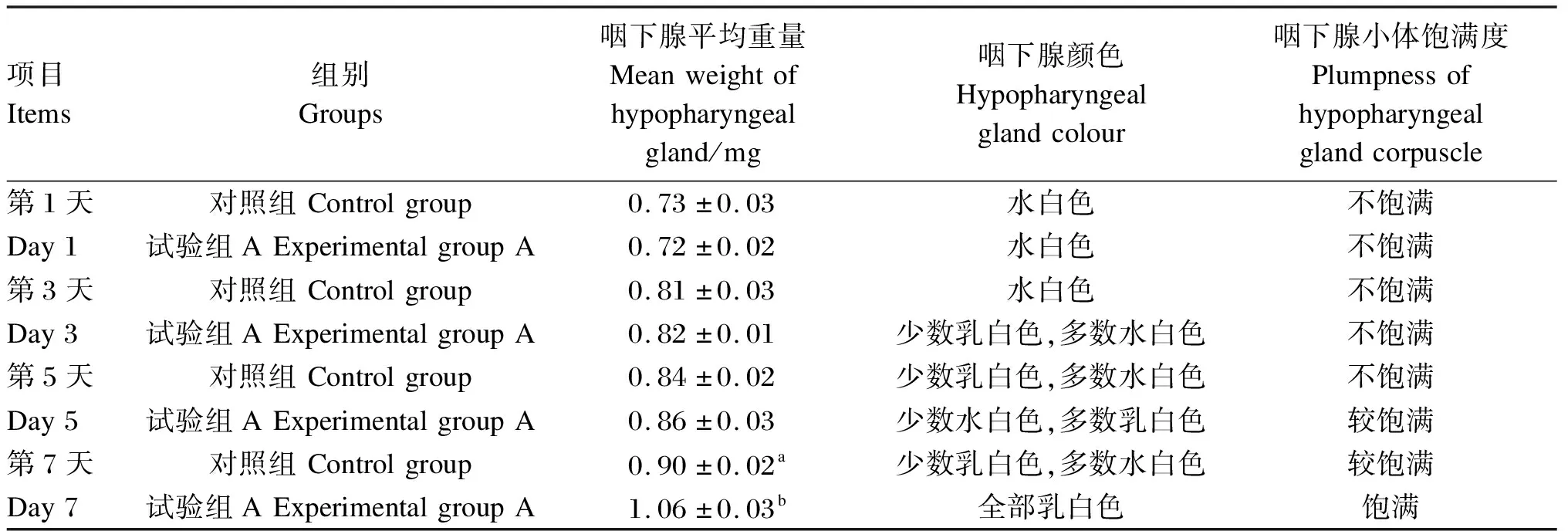
表4 不同饲粮对蜜蜂咽下腺发育的影响
2.3 蜜蜂代谢物PCA
由图1可知,以基于LC-MS的代谢组学方法鉴别代谢物,总离子色谱图没有明显的峰漂移,具有稳定的保留时间。将提取出的数据矩阵进行单变量和多变量统计分析,通过t检验,设置阈值为VIP>1.0,差异倍数(FC)>2.0,筛选出429个差异代谢物,其中185个下调,244个上调。

图1 对照组与试验组A差异代谢物的火山图
由图2-A可知,每个点代表1个样本,点与点的距离代表样本之间的相似性,全部样本均在95%的置信区间内,对照组与试验组A能够明显区分(正方形代表对照组,三角形代表试验组A)。
由图2-B可知,在PCA模型的基础上进一步探讨不同饲粮对蜜蜂引起的代谢差异,找到差异代谢物,建立PLS-DA模型,对对照组和试验组A重建模型,放大它们之间的差异,得到更好的分类效果。运用交叉验证(cross validation)法对PLS-DA模型进行验证,Q2均大于0.50,模型均稳定可靠(Q2>0.50表示模型具有较好的判别分析能力)。

图2 对照组与试验组A代谢物PCA和PLS-DA得分图
OPLS-DA得分图见图3-A,结合了正交信号矫正(OSC)和PLS-DA方法,减少噪音干扰,使重要变量得到凸显,有利于差异代谢物的识别,OPLS-DA分析通过去除不相关的差异来筛选,能够得到更准确的差异变量。对OPLS-DA模型分析,前3个有效主成分的R2X(cum)=0.628,R2Y(cum)=0.995,Q2(cum)=0.917,表明模型质量较好(正方形代表对照组,三角形代表试验组A)。
为了判别模型是否过拟合,对模型进行排序验证,见图3-B。所有的Q2均在R2之下,并且Q2的回归直线与y轴的交点均在y轴的负半轴(Q2<0),没有过拟合现象,模型稳定可靠有意义,可进行差异代谢物的分析。
2.4 差异代谢物鉴定与分析
2.4.1 差异代谢物鉴定
由表5可知,试验组A与对照组的差异代谢物情况,利用代谢物的精确分子质量和二级质谱信息在KEGG、HMDB等数据库搜索比对,进行鉴定指认,共指认出23个差异代谢物,包括氨基酸、维生素、糖类等,其中有10种代谢物上调,13种代谢物下调。

表5 对照组与试验组A的差异代谢物
2.4.2 差异代谢物通路分析
由图4可知,差异极显著的通路有牛磺酸和亚牛磺酸生物合成通路,赖氨酸降解通路、戊糖磷酸盐代谢通路、戊糖和葡萄糖醛酸相互转化通路(P<0.01);差异显著的通路有氨基酸的生物合成通路,色氨酸代谢通路,碳代谢通路,丁酸代谢通路,丙氨酸、天冬氨酸和谷氨酸代谢通路,丙酮酸代谢通路(P<0.05)。

Taurine and hypotaurine metabolism:牛磺酸和亚牛磺酸生物合成;Lysine degradation:赖氨酸降解;Pentose phosphate metabolism:戊糖磷酸盐代谢;Pentose and glucuronate interconversions:戊糖和葡萄糖醛酸相互转化;Biosynthesis of amino acids:氨基酸的生物合成;Tryptophan metabolism:色氨酸代谢;Carbon metabolism:碳代谢;Butanoate metabolism:丁酸代谢;Alanine, aspartate and glutamate metabolism:丙氨酸、天冬氨酸和谷氨酸代谢;Pyruvate metabolism:丙酮酸代谢。
3 讨 论
随着人们对蜜蜂种质资源的重视,引入蜜蜂良种成为饲养管理的重要措施,其中长途邮寄蜂王引种又是目前最为常用方式。长途邮寄蜂王会装入几只陪嫁青年工蜂,再装入炼糖饲粮,保证邮寄过程蜂王的安全,但通常会出现蜂王腹部收缩变小、延迟产卵的现象。蜜蜂营养对于蜜蜂正常生长、繁殖起着重要的作用,在日常饲养管理中通过补充蜂蜜和花粉来保证蜂群的生长和繁育[15],但在长途邮寄等特殊环境中如何保证蜜蜂存活和发育。本试验通过陪嫁工蜂入手,通过不同配方的饲粮对比,找到既能保证工蜂长时间存活又能保证咽下腺发育的饲粮,这样陪嫁青年工蜂就能分泌蜂王浆饲喂蜂王,保证蜂王的营养需求。然后利用代谢组学研究蜜蜂工蜂代谢规律,找到影响工蜂生长发育的关键营养因子。
3.1 不同饲粮对蜜蜂死亡数量的影响
根据工蜂在蜂群日常的饲粮,本试验配制不同比例的蜂粮和花粉的人工饲粮,与仅含有蜂蜜和蔗糖的练糖饲粮对比。结果发现,最先出现蜜蜂死亡是试验组C和D,出现在室内饲养的第3天,第5天时试验组C和D蜜蜂全部死亡。试验组B蜜蜂在第5和6天出现大量死亡,试验组B的饲粮出现粘黏蜜蜂现象,这可能是导致蜜蜂出现大量死亡的原因。试验组B、C、D蜜蜂在5 d内即全部死亡,存活时间短,无法满足实际要求。7 d内试验组A蜜蜂死亡数量最少,延长室内饲养时间发现A组蜜蜂存活时间更长且蜜蜂生命体征更活跃,表明试验组A的饲粮更加适合蜜蜂,能够保证蜜蜂在无法排泄的特殊环境中正常存活,存活时间能够满足全国范围内的邮寄。Gregory[16]研究发现,用不同蛋白质水平的代用花粉对实验室笼养蜜蜂进行寿命测定,得出蛋白质水平较高的代用花粉能提高工蜂存活率,本试验结果与此相一致。
3.2 不同饲粮对蜜蜂咽下腺发育的影响
咽下腺是一对位于工蜂头部的外分泌腺体,是合成、分泌蜂王浆的主要腺体,其分泌物是饲喂蜂王和幼虫的主要食物,咽下腺的重量、颜色和饱满度是评价其发育的重要指标,一般认为颜色乳白色、咽下腺小体饱满是发育成熟的标识[17]。蜜蜂咽下腺的发育必须需要蛋白质,蜂王浆的多种生物活性成分也都与蛋白质有关。对能够长时间存活的对照组和试验组A蜜蜂,分别在食用饲粮第1、3、5、7天时进行咽下腺解剖称重和观察,咽下腺的重量在食用饲粮第7天时2组出现差异,试验组A蜜蜂的咽下腺重量显著大于对照组。咽下腺颜色在食用饲粮第3天时出现不同,试验组A少数咽下腺小体为乳白色,而对照组咽下腺小体全部为水白色;第7天时试验组A咽下腺小体全部为乳白色,对照组咽下腺小体只有少数乳白色。对照组和试验组A咽下腺小体,食用饲粮第1和3天后均呈不饱满状态,在食用饲粮第7天后A组咽下腺小体十分饱满,对照组咽下腺小体还不是十分饱满。通过对咽下腺称重和颜色、饱满度的观察,表明试验组A的蜜蜂在第7天时咽下腺基本发育成熟,试验组A饲粮比对照组饲粮更有助于蜜蜂咽下腺的发育。
3.3 不同饲粮对蜜蜂生理代谢的影响
3.3.1 氨基酸代谢
本研究结果显示,对照组和试验组A鉴定出7种氨基酸差异显著,其中4种氨基酸含量上升,3种氨基酸含量下降。试验组A脯氨酸含量比对照组上升。白小琼等[18]研究表明,脯氨酸在蜜蜂的生长发育中起重要作用,约占蜜蜂氨基酸总需求量的50%。试验组A牛磺酸含量比对照组上升,通过进一步对代谢通路分析发现牛磺酸和亚牛磺酸生物合成通路差异极显著。牛磺酸是一种含硫氨基酸,是重要的氨基酸,具有促进大脑发育、调节神经传导和参与胆盐代谢等功能[19],而且是蜂王浆中重要的氨基酸。牛磺酸含量上升表明试验组A的饲粮更加有利于蜜蜂咽下腺的发育,可能是咽下腺发育成熟导致分泌蜂王浆所致。试验组A赖磺酸含量比对照组下降,通过进一步对代谢通路分析发现赖氨酸降解通路出现差异。赖氨酸是蜜蜂体内的一种必需氨基酸,赖氨酸碳骨架分解后会形成乙酰-辅酶A(CoA),以调节体内的脂肪酸合成异常,为脂质的合成提供前体物质[20]。氨基酸代谢在蜜蜂生长发育、提高免疫力、脂肪代谢等方面起到重要作用。
3.3.2 维生素代谢
本试验中维生素检测出差异的有维生素B2、维生素B4和维生素B5,试验组A比对照组含量均上升。维生素B2是自然界广泛分布的维生素,它参与构成各种黄素酶的辅基,在生物氧化过程中作为递氢体,与糖、蛋白质和脂肪代谢密切相关。蜂粮中含有丰富的维生素,试验组A蜜蜂7 d内死亡数量最少,且寿命比对照组蜜蜂长。廖春华等[21]研究表明,维生素B2对中华蜜蜂工蜂的寿命有影响,工蜂的平均寿命随着维生素B2添加量的升高而增加。维生素B2参与了蜜蜂体内的生物氧化,提高蜜蜂体内糖、蛋白质和脂肪的代谢能力,有利于蜜蜂个体的生长发育和延长蜜蜂个体的寿命。维生素B4在体内代谢中参与形成多种重要的中间物质,如ATP、烟酰胺腺嘌呤二核苷酸磷酸(NADP)等,是DNA和RNA的重要组成部分。维生素B5主要以CoA形式参与糖、脂、蛋白质代谢。雷春红[22]研究表明,维生素B5可促进进蜜蜂的生长发育,增强机体抗氧化能力。
3.3.3 有毒物质代谢
差异代谢物中共鉴别指认出4种有毒代谢成分,分别是磷酸三乙酯、巴比妥酸、胡椒碱、野百合碱,这4种成分含量试验组A比对照组均下降。磷酸三乙酯在高剂量下产生一种麻醉现象和显著的肌肉松弛。胡椒碱属中毒类物质,大鼠的经口半致死剂量514 mg/kg。野百合碱属高毒类物质,大鼠的经口半致死剂量71 mg/kg。试验组A的有毒代谢产物含量比对照组均下降,可能是导致试验组A的蜜蜂寿命比对照组蜜蜂寿命长的原因,具体内部机理需要进一步研究。
3.3.4 能量代谢
试验组A比对照组的肌苷含量上升。肌苷是机体内ATP、CoA、DNA和RNA的组成部分,参与机体的物质代谢和能量代谢。张鑫蕊等[23]研究表明,肌苷能提高肉鸡体内ATP的水平,可转化为多种核苷酸,参与蛋白质的合成并能提高各种酶的活性,刺激机体产生抗体。肌苷对蜜蜂的生长发育及代谢的影响目前还未见报道。
4 结 论
① 由蔗糖、蜂粮、蜂蜜按照6∶5∶1比例制成的人工饲粮,在模拟邮寄环境中可提高蜜蜂存活率和寿命,而且有利于蜜蜂咽下腺的发育,因此在邮寄环境中可代替常用的炼糖饲料。
② 采用LC-MS检测饲喂试验组A和对照组饲粮的7日龄工蜂,共筛选鉴定23种差异代谢物,主要包括脯氨酸、牛磺酸、赖磺酸、维生素B2、肌苷等,主要涉及牛磺酸和亚牛磺酸生物合成通路、赖氨酸降解通路、能量代谢等通路。
