鹭鸶草组织培养再生体系的建立
2021-03-03朱恒星戴前莉黄飞逸雷光祥陈本文
朱恒星,戴前莉,卢 敏,黄飞逸,雷光祥,陈本文
(1.重庆市林业科学研究院,重庆市 400036;2.重庆市巴南区退耕还林管理中心,重庆市 401320)
鹭鸶草(Diuranthera major)又名鹭鸶兰,为我国特有的百合科(Liliaceae)鹭鸶草属多年生草本植物,有较高的观赏和药用价值。迄今,该属仅发现3个物种:鹭鸶草、小鹭鸶草(D.minor)和南川鹭鸶草(D. inarticulata)[1],根内均含鹭鸶兰甙A、B、C、D和E 等药用化学成分[2-4];其中,鹭鸶草在我国方剂产品中广泛应用。由于生境遭到破坏,鹭鸶草仅零星分布于我国四川、云南和贵州等野外地区[5],目前以野生采挖为主要来源,急需开展该濒危物种的保护,对于发展鹭鸶草民族医药产业意义重大。
近年来,百合科植物的组织培养技术已相对成熟,可实现工厂化育苗,多以鳞茎[6]和种子[7]等为外植体实现无性快繁[8-9]。鹭鸶草肉质根污染率高,种子后代分化较大,不宜进行优系繁育。 目前,已有花序轴成功建立组培再生体系的报道[10-11],鹭鸶草花量较大,便于取材繁殖,其相关研究未见报道,仅有少量与种子萌发有关的研究[12]。本研究通过鹭鸶草花序轴无菌离体培养,诱导不定芽,从而建立鹭鸶草组织培养再生体系,可以高效快速地繁殖种苗,缓解野生资源濒危的现状,为鹭鸶草产业大规模发展提供种苗以及技术支撑,对该物种的可持续利用具有重要意义。
1 材料与方法
1.1 材料
供试材料由重庆市林业科学研究院提供,鹭鸶草植株为从酉阳县引种至温室大棚驯化栽培的成熟植株。2019年7月上旬,选取健康植株的未开放花序轴为外植体(图1)。
1.2 方法
1.2.1 花序轴的无菌处理
以未开放花序轴为外植体,剥去花萼,1/1 000肥皂水溶液震荡清洗两遍后流水漂洗干净,放入75%的酒精溶液浸泡10 s,再以1/1 000 氯化汞(Hg⁃Cl2)溶液震荡消毒(表1)。无菌水清洗3 遍后沥干水分,切出新的接触面接种于MS 培养基。每个消毒处理50 段,每瓶接种1 段,重复3 次,1 800 lx 光照下(25±1)℃培养,光照时间为每天12 h,15 天后统计花序轴污染率、死亡率和成活率。

1.2.2 不定芽诱导
将获得的无菌花序轴段转接入诱导培养基(表2)。每瓶接种1段,每个配方60瓶,3个重复。置于1 800 lx 光照下,光照时间为每天12 h,(25±1)℃室温下培养25 ~40 天。统计出芽数和诱导周期,记录芽长势,计算诱导率。

图1 未开放花序轴Fig.1 Unopened rachis

1.2.3 不定芽的增殖培养
待不定芽长至1.5 ~2 cm 左右,切下转入增殖培养基(表3)。每瓶4 个芽,10 个重复。和不定芽诱导培养条件一致,培养25 ~35天。统计增殖的小芽个数及小苗长势,记录叶片颜色,计算增殖系数。

1.2.4 壮苗培养
增殖苗长至1.5 ~2 cm,即可转接入壮苗培养基(表4)。每瓶10 株,5 个重复。和不定芽诱导培养条件一致,培养20 天。观察对比小苗长势、叶色转绿程度、叶片健壮程度及舒展程度。
1.2.5 生根培养
挑选高度2 ~3 cm 的健壮小苗,切成单芽转接入生根培养基(表5)。每瓶10 株,5 个重复。置于1 800 lx 光照下,光照时间为每天12 h,(28 ± 1)℃下培养30 天。统计分析生根周期和生根率,观察根部生长状态(生根数量、粗细程度、整齐度)及小苗长势。生根周期为转接入生根培养基到开始出现白色根点的时间。

1.2.6 炼苗移栽
小苗根长至1.5 ~2.0 cm,即可炼苗移栽。洗净根部琼脂,用1/1 000多菌灵(50%可湿性粉剂)浸泡15 min,即可进行移栽。基质为草炭、珍珠岩和沙以3∶1∶0.5(体积比)的比例混合均匀,定植于32 孔穴盘中,浇透生根水(LS7,不添加卡拉胶和蔗糖),罩上塑料薄膜,置于(25 ± 1)℃室温下,通风半遮阴。3 天后每天半揭膜透气1 h,6 天后全揭膜,保持基质湿润,长出新根后喷施1/1 000 磷酸二氢钾溶液,小苗长高至10 ~15 cm,即可换盆移栽定植。统计移栽成活率。


图2 花序轴培养出的种子Fig.2 Seed cultured on rachis

图3 诱导的不定芽Fig.3 Induced adventitious shoots

图4 增殖丛芽Fig.4 Proliferative cluster shoots

图5 壮苗培养前Fig.5 Before strong seedling culture
1.3 数据处理
采用Excel 2007 和SPSS v17.0 软件进行统计分析和方差分析。
2 结果与分析
2.1 无菌材料的获得
在其他处理相同的情况下,随着流水冲洗和HgCl2消毒处理时间的增加,污染率下降,死亡率上升(表1)。 除了P1 处理,其他处理的污染率均在50%以下。在同样的流水冲洗时间下,增加HgCl2消毒时间,污染率显著下降(P<0.05),死亡率显著上升(P<0.05),成活率先增后降,在消毒8 min时达到最高,之后显著下降(P<0.05),因此HgCl2消毒时间不宜超过8 min;相比同一HgCl2消毒时间下增加流水处理时间,其污染率下降更显著,但死亡率大幅上升。P5 处理的污染率和死亡率较低,分别为15.33%和16.00%,成活率最高(68.67%)。

图6 壮苗培养后Fig.6 After strong seedling culture

图7 生根培养Fig.7 Rooting culture

图8 组培幼苗移栽20天后Fig.8 20 Days after transplanting of tissue culture seedlings

表1 不同消毒处理对鹭鸶草无菌培养的影响Tab.1 Effects of different sterilization treatments on aseptic culture of D.major
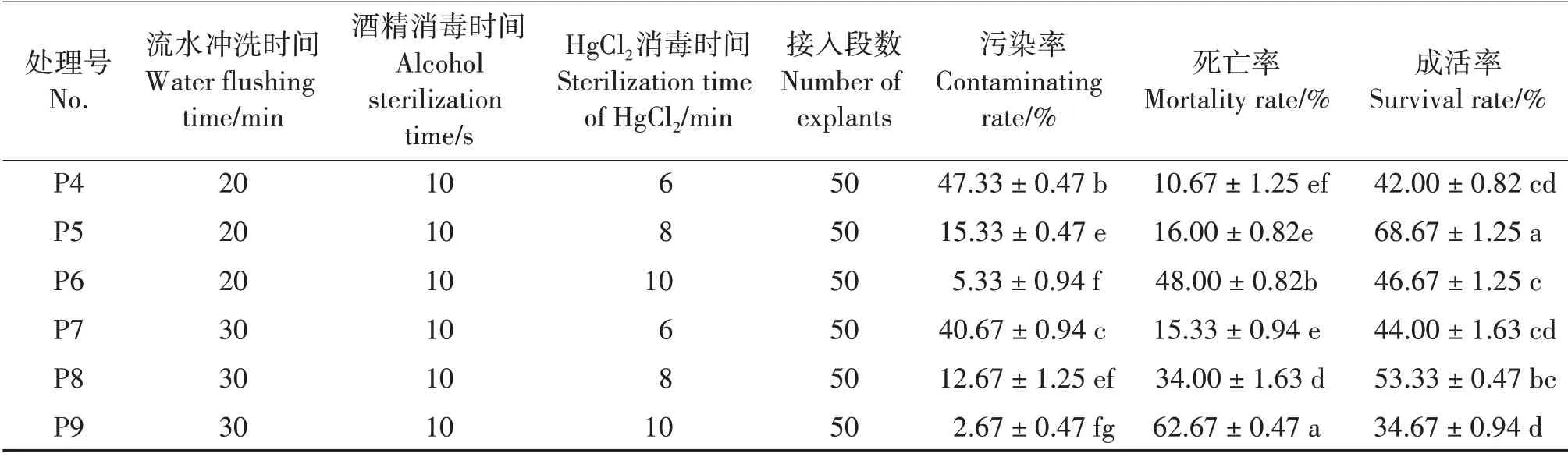
续表1 Continued
2.2 不定芽的诱导
MS 培养基附加一定量的6-BA 和NAA 处理均可诱导出不定芽(表2)。同时添加6-BA 和NAA 处理(L2、L3、L5、L6、L8和L9)的诱导率显著高于仅添加NAA 处理(L1、L4 和L7)(P<0.05)。L5 和L6 处理的诱导率最高(93.33%),不定芽长势较好。 同时添加6-BA 和NAA,当NAA 浓度相同时,随着6-BA 浓度的增加,诱导周期逐渐缩短;当6-BA 浓度达到2.5 mg/L 时,诱导出的不定芽长势较差,叶色黄白或黄绿。当6-BA 浓度相同时,随着NAA 浓度增加,诱导周期不断下降;除了2.0浓度外,其他浓度处理的诱导率均随着NAA 浓度增加呈先上升后下降的趋势;不添加NAA 时,不定芽均呈现黄白色,长势差或较差,随着NAA 浓度增加,长势好转,而当浓度达到0.50 mg/L 时,不定芽长势又转差。 L2、L3 和L5 处理在转接后结出了果实(图2)。综合考虑,最适宜的不定芽诱导配方为L5 处理(MS+2.0 mg/L 6-BA+0.25 mg/L NAA),诱导时间为31.97 天,诱导率为93.33%,不定芽长势良好,呈嫩绿色(图3)。

表2 不同培养基处理对鹭鸶草不定芽诱导的影响Tab.2 Effects of different culture medium treatments on adventitious shoot induction of D.major
2.3 不定芽的增殖培养
仅添加6-BA和NAA处理(LZ1 ~LZ9)的增殖系数为4.21 ~5.63;同时添加6-BA、NAA 和KT 处理(LZ10 ~LZ17),除LZ16 增殖系数稍低(5.60),其他处理的增殖系数均高于5.63,最高可达7.12(LZ13),表明添加KT对增殖有一定的促进效果(表3)。未添加KT时,在NAA浓度相同的情况下,随着6-BA浓度的上升,小苗的长势呈下降趋势;在6-AB 浓度相同的情况下,随着NAA 浓度的上升,增殖系数下降;当6-AB 浓度达到2.50 mg/L、NAA 浓度达到0.60 mg/L时,小苗出现一定程度的玻璃化。添加KT 的处理中,处理LZ10 ~LZ13 比处理LZ14 ~LZ17 增殖系数高,长势也相对较好,可见过高的激素浓度会抑制鹭鸶草的增殖和生长,NAA 浓度宜在0.20 mg/L 以下,6-BA 浓度不宜高于2.00 mg/L。最适宜的增殖培养配方为处理LZ12(MS 培养基+ 1.50 mg/L 6-BA +0.10 mg/L NAA+0.75 mg/L KT),增殖系数可达6.8,小苗较健壮,叶色嫩绿(图4)。

表3 不同培养基处理对鹭鸶草增殖培养的影响Tab.3 Effects of different culture medium treatments on multiplication culture of D.major
2.4 壮苗培养
增殖培养的小苗较弱,叶色整体偏黄绿色,叶片舒展度不高,直接转入生根培养基中会出现黄叶现象(图5)。 添加土豆汁和硝酸铵(NH4NO3)均可促进小苗叶色转绿及叶片舒展,加快长势(表4)。添加土豆汁对小苗健壮程度影响较大;添加NH4NO3则对叶色转绿及叶片舒展程度影响较大;两者共同作用,效果更佳。在MS培养基上同时添加20 g/L 土豆汁和NH4NO3为最佳壮苗培养配方,小苗长势良好,健壮,叶色翠绿且舒展度高(图6)。

表4 不同培养基处理对鹭鸶草苗生长的影响Tab.4 Effects of different culture medium treatments on growth of D.major seedlings
2.5 生根培养
转入生根培养基,15.30 ~25.09天即可生根(表5)。 仅添加NAA 或IBA 的处理中,添加NAA 处理(LS1 ~LS3)的生根率均高于添加IBA 处理(LS4 ~LS6),LS1 和LS2 处理的生根率显著高于LS4、LS5和LS6 处理。 对比LS1 ~LS3 和LS4 ~LS6,还可以发现仅添加IBA 的组别,须根更粗壮,根条数更多,根长势更整齐;而添加NAA 的组别小苗长势更快,根更长。 同时添加NAA 和IBA 处理(LS7 ~LS9)较单一激素处理的生根效果更好,生根周期短,根粗壮且长度适中,小苗长势快且粗壮。 LS7 处理(1/2 MS+ 0.50 mg/L IBA + 0.20 mg/L NAA)的效果最好,生根率高达100%,17.16 天即可生根,平均生根数为7.94条,根粗壮且整齐,小苗长势快(图7)。

表5 不同培养基处理对鹭鸶草生根的影响Tab.5 Effects of different culture medium treatments on rooting of D.major
2.6 炼苗移栽
将组培瓶苗洗净根部琼脂后,进行简单消毒即可直接移栽。种下后,约3天可长出新根,20 天左右可进行换盆移栽,移栽成活率达100%。 当生根苗根部长度过长时(2 ~3 cm 以上),会造成盘根现象,长出新根需要4 ~6 天,只需保持基质湿润,避免阳光直射,遮阴达到50%,严格掌握好揭膜时间,移栽成活率也可达到100%(图8)。
3 结论与讨论
无菌材料的获得是无性系繁殖成功至关重要的一步。鹭鸶草花序轴花朵与轴的连接处被花萼包裹,容易造成消毒不彻底,导致污染。本试验结果表明,适当增加流水冲洗时间,可在一定程度上降低污染率,可作为结构复杂、组织娇嫩、不耐受HgCl2材料的有效消毒预处理方式之一,也更加低碳环保。
在诱导过程中,L1、L2 和L3 处理均出现结实现象。李娜等[13]研究发现不同时期的花序轴再生能力与分化方向存在差异。本研究中的花序轴在诱导培养过程中出现结实和不定芽的不同结果,是否与激素种类和浓度配比有关[14],或是不同生长阶段差异造成,目前机制尚不明确。
Filippova 等[15]在继代培养中发现,较高浓度的KT(5 mg/L)有利于百合科植物的增殖,Tao 等[16]发现,添加KT 和NAA 后,岷江百合(Lilium regale)的不定芽诱导率达到100%,说明KT 对于百合科植物的增殖培养有良好效果,本研究也得到相同的结果。在整个组织培养过程中,当NAA 含量超过0.25 mg/L 时,小苗长势减弱,叶片出现黄化现象,与Johnson 等[17]的结论一致。较低浓度的生长激素更适合鹭鸶草组织培养,加入KT 后增殖效果更好。
在鹭鸶草生根培养阶段,单独添加NAA 处理比添加IBA 处理生根率高,与蒋瑶等[18]研究结果一致。同时使用NAA和IBA,生根效果更好。
本研究中,鹭鸶草的生根率较高,在移栽过程中浇透生根水后,无根的幼苗也陆续长出了新根,且长势良好。 瓶外生根可以有效地降低生产成本和生产周期[19],并在无性繁殖育苗中运用广泛[20-22],后期可开展鹭鸶草瓶外生根研究,进一步优化鹭鸶草无性高效快繁体系。
