不同工艺真空冷冻干燥桂花的品质比较分析
2021-03-02陈柏楠杨豪包韫辉赵斗陈洪国曾祥玲杨洁
陈柏楠,杨豪,包韫辉,赵斗,陈洪国,曾祥玲,,杨洁,
(1.湖北科技学院核技术与化学生物学院,湖北咸宁 437100)
(2.湖北省香花植物工程技术中心,湖北咸宁 437100)
桂花(Osmanthus fragransLour.)属木犀科木犀属常绿木本植物,为中国十大传统名花之一,因其浓郁的香气被列为中国重要的天然保健植物和特产经济香花植物,广泛用于园林、食用、药用及精油提取等领域。桂花在中国的栽培历史悠久,分布广泛,形成著名的湖北咸宁、四川成都、广西桂林、江苏苏州和浙江杭州五大桂花产区[1,2]。桂花花瓣中富含黄酮、氨基酸、矿质元素等营养物质,常用于制作桂花茶、桂花酒和桂花食品等[3,4];且其香味独特,从中提取的精油用于香水、护肤品、日用品等产品的开发,深受人们的喜爱[5-8]。但是,桂花开花时间短且花期集中,鲜花过夜放置容易褐变,因此储藏保鲜技术成为限制桂花产业发展的关键因素。目前常用的桂花保藏方法有糖腌或盐腌法以及烘干法[9],腌渍法在后期深加工过程中的脱糖或脱盐处理会造成营养及香气成分的损失严重;烘干法获得的干桂花往往颜色变褐、香味不足、外形欠佳,品质较差。
真空冷冻干燥技术是将含水物料冻结到共晶点温度以下,然后在真空条件下,使冰直接升华成水蒸气的形式除去物料中水分的一种干燥方法[10,11]。此法干燥的物料具有复水快、可保持原有色泽和活性成分等优点,已在中草药、食品、水果等干燥中得到广泛应用[12-15]。该技术在花卉中应用不多[16],不同物种花的外型及结构存在较大差异,需要根据物种特点探索合适的技术工艺。目前关于桂花低温冷冻干燥的相关研究和产品还未见报道。本实验以桂花为原料,探索了影响桂花低温冷冻干燥效率的因素;应用不同工艺参数的真空冷冻干燥技术对桂花进行处理,以热风干燥处理的桂花为对照,评价该方法对干燥桂花品质的影响,旨在为该技术在桂花加工上的应用和产业化发展提供借鉴。
1 材料与方法
1.1 材料与试剂
桂花盛花期鲜花采自湖北咸宁,“波叶银桂”品种。
正己烷(色谱纯)美国Mreda公司;乙醚(色谱纯)美国Mreda公司;环己酮美国Sigma公司;其余试剂均为国产分析纯。
1.2 仪器与设备
DP-1007DG真空冷冻干燥机,无锡德谱仪器制造有限公司;101-2AB电热鼓风干燥箱,天津市泰斯特仪器有限公司;MB27水分测定仪,常州奥豪斯仪器有限公司;NDK200-2N氮吹仪,杭州米欧仪器有限公司;紫外-可见分光光度计,上海元析仪器有限公司;扫描电子显微镜,中国Tescan公司;气质联用仪,美国Thermo公司。
1.3 方法
1.3.1 共晶点和共熔点的测定
参考崔清亮等[17]的电阻法测定,取盛花期桂花花朵100 g研磨成浆置于玻璃皿中,将玻璃皿放入真空冷冻干燥仪中,将温度测定仪探头和万用表探头分别插在玻璃皿中部,在真空冷冻干燥仪中设置降温和升温程序,测定温度范围为0~-24 ℃。
1.3.2 干燥方法
真空冷冻干燥:将新鲜桂花放入真空冷冻干燥仪中,设置冻干工艺参数(如表1),真空度约为30 Pa,冷阱温度-80 ℃。
热风干燥:将新鲜的桂花均匀铺于托盘内,厚度约20 mm,温度设定为45 ℃,烘干时间约为15 h。
1.3.3 失水率的测定
称取一定量的桂花进行干燥,干燥结束后立即进行称重,每个样品重复3次。失水率由式(1)计算。

式中:M0为鲜样质量/g;Mx为干燥后样品质量/g。
1.3.4 含水率的测定
采用水分测定仪测定,设定测定温度为105 ℃。
1.3.5 复水比的测定
参考陈冉静等[18]的方法,精确称取样品1 g,置于烧杯中,加入80 ℃水100 mL并略搅拌,复水30 min后捞出沥干,用吸水纸吸去表面水分后,准确称量,每个样品重复3次。复水比由式(2)计算。

式中:M1为原干样质量/g;M2为复水后质量/g。

表1 桂花真空冷冻干燥工艺参数Table 1 Vacuum freeze drying process parameters of O. fragrans
1.3.6 黄酮含量的测定
黄酮的提取方法参考蔡健和王薇[19],准确称取样品0.1 g,加入80%乙醇5 mL,于70 ℃浸提3 h,离心后取上清液1 mL,用80%乙醇稀释50倍。采用亚硝酸钠-硝酸铝比色法[20],取5 mL提取液进行黄酮含量测定,每个样品重复3次。
1.3.7 香味评审
取1 g样品置于一次性纸杯中,加入80 ℃水100 mL,5 min后,聘请30名人员对试验样品的香气进行评价。评价体系设置3个等级:香(+),较香(++),很香(+++)。以烘干样品为对照,设置为香(+)的等级,对其他试验样品进行评价。
1.3.8 香气成分的测定
香气物质的提取与测定参考Zeng等[21]的方法,取0.5 g干样粉末,加入10 mL戊烷/乙醚(1:1V/V)提取液,置于摇床150 r/min 25 ℃浸提30 min,5000 r/min离心10 min,收集提取液,向余下的沉淀中再次加入10 mL新的提取液,重复操作。将两次提取液混合,用氮吹浓缩仪浓缩至1 mL,向浓缩的提取液中加入40 ng/µL终浓度的环己酮作为内标,经0.22 µm滤膜过滤,进样1 µL进行GC-MS检测。
GC-MS分析采用30 m×0.25 mm×0.25 μm HP-5MS毛细管柱(J&W Scientific, Folsom,CA,USA)进行色谱分离,以高纯度氦气(99.999%)为载气,流速为1.2 mL/min。色谱分析的条件为:起始柱温40 ℃,维持3 min;以3 ℃/min的速度升至73 ℃,保持3 min;然后以5 ℃/min升至220 ℃,维持2 min。结合HP5975B四极质谱(Agilent Technologies)进行质谱分析。质谱条件为:传输线温度为250 ℃,离子源温度为220 ℃,EI电离模式,电子能量为70 eV,扫描的质谱范围45~450 u。目标物质利用ChromTOF软件进行初步预测,再结合目标分析物质的保留指数(RI)进一步确认。目标物质的含量由式(3)计算。
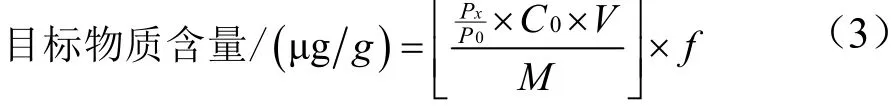
式中:Px为目标物质的峰面积;P0为内标物质的峰面积;C0为内标物质的终浓度(μg/mL);V为浓缩后的样品体积(mL);M为供试样品质量(g);f为各组分对内标物的校正因子,f=1。
1.3.9 微观结构观察
取一小块花瓣,用石墨双面胶粘在样品台上,对样品喷金后进行扫描电子显微镜观察,对花瓣中间部位进行拍照。
1.4 数据处理
采用Excel 2007软件对实验数据进行处理,采用SPSS 19.0软件对实验数据进行显著性分析,采用LSD最小显著差异法分析显著性水平,不同小写字母表示不同样品之间差异显著(p<0.05)。
2 结果与讨论
2.1 桂花共晶点和共熔点的测定

图1 降温(a)和升温(b)过程中桂花电阻的变化曲线Fig.1 Resistance curve of O. fragrans with decreasing (a) and increasing (b) temperatures
共晶点和共熔点是物料冻干的重要参数,共晶点是物料预冻温度设定的判断依据[22]。一般,预冻温度应低于共晶点5~10 ℃,才能保证物料完全冻结。由图1a可知,桂花在冻结降温初期,即温度处于0~-16 ℃时,此时为冰晶开始形成时期,物料中含有大量的水分,能够自由移动的离子较多,物料的电阻值缓慢增大,在0.5~10 MΩ之间;当温度处于-16~-19 ℃时,处于冰晶大量形成期,物料的电阻值逐渐增大,在10~30 MΩ之间;当温度处于-19~-24 ℃时,物料的电阻显著增大。在-19 ℃时,物料的电阻值陡然增加,说明此点温度即为桂花的共晶点。由图1b可知,在物料升温过程中,电阻值突变的温度范围为-17~-15 ℃,在-17 ℃时,电阻值陡然增加,此温度即为桂花的共熔点。赵丛枝等[23]测定无花果的共晶点-28 ℃,共熔点为-24 ℃;陈仪男[24]测定香蕉的共晶点和共熔点分别为-33.5 ℃和-22.0 ℃,可见,不同物种之间共晶点和共熔点确实存在较大差异。本实验测定‘波叶银桂’盛花期鲜花的共晶点为-19℃,因此预冻温度设为-24~-29℃可能较为合适。
2.2 预冻时间和温度对桂花干燥效率的影响
图2 预冻时间(a)和温度(b)对桂花干燥效率比较Fig.2 Comparison of pre-freezing time (a) and temperature (b)on the drying efficiency of O. fragrans
真空冷冻干燥分为3个阶段:预冻、升华干燥和解析干燥,详细工艺参数见表1。将预冻分为两个阶段:预冻1和预冻2,预冻1仅是为了仪器快速降温,预冻2才是为了保证物料达到预期的冷冻效果,因此主要分析预冻2的时间和温度对桂花干燥效率的影响(如图2)。由图2a可知,桂花在-30 ℃分别预冻3.5 h、2.5 h、1.5 h,最后失水率差异不大,物料厚度5 mm时的失水率为85%、10 mm时为70%、15 mm时为50%、20 mm时为40%。图2b反映了桂花分别在-30 ℃、-25 ℃、-20 ℃预冻2.5 h,最后的失水情况结果显示,-30 ℃与-25 ℃的失水率无明显差异;当物料厚度为15 mm和20 mm时,-20 ℃的失水率分别为46%和36%反而显著低于-25 ℃和-30 ℃的52%和44%,这可能是由于桂花中的水分未完全结晶导致的。可见,-25 ℃是能满足桂花预冻要求的最高温度,从效果和能耗两方面综合考虑,作为预冻温度比较理想,2.5 h基本能保证达到较好的预冻效果。
2.3 物料厚度和升温程序对桂花干燥效率的影响
在干燥阶段设置不同的隔板升温程序,干燥相同时间后,桂花失水率差异明显(图3)。结果表明,P6的失水率最低(5 mm 41%;10 mm 33%;15 mm 21%;20 mm 15%)、P7次之(5 mm 75%;10 mm 60%;15 mm 41%;20 mm 29%)、P1较高(5 mm 86%;10 mm 73%;15 mm 54%;20 mm 44%)、P8最高(5 mm 86%;10 mm 79%;15 mm 60%;20 mm 50%),温度是影响干燥效率的关键因素,较高温度有利于干燥效率的提高。此外,物料厚度也是影响干燥效率的关键因素,由图3可知,在相同的升温程序下,物料厚度5 mm的失水率均>10mm>15 mm>20 mm。张采琼等[25]进行山楂冷冻干燥工艺研究表明,对冷冻干燥工艺影响大小因素依次为物料厚度>升温速率>预冻时间>解析温度。以上结果说明,隔板温度和物料厚度是影响真空冷冻干燥效率的首要因素,在实践生产中要结合实际情况重点优化。

图3 物料厚度和升温程序对桂花干燥效率比较Fig.3 Comparison ofmaterial thickness and heating program on the drying efficiency of O. fragrans
2.4 桂花真空冷冻干燥曲线绘制
图4反映了在桂花真空冷冻干燥过程中隔板温度和物料温度变化情况。图4a展示了程序P9的温度变化趋势,0~180 min为预冻阶段,0~90 min为隔板温度与物料温度同时下降阶段,90~180 min为预冻温度保持恒定的彻底冻结阶段,预冻阶段物料温度与隔板温度保持一致的下降速率。在180 min时开启真空进入干燥阶段,此阶段开始时,物料温度有一定程度的下降,物料本身的含水量越高、物料厚度越厚及程序升温越慢,物料温度下降的越明显。桂花干花的物料温度与隔板温度基本保持一致的上升速率;物料厚度5 mm鲜花的物料温度上升速率明显慢于干花,180~330 min由-27 ℃呈直线上升至30 ℃,360 min之后保持35 ℃恒定;物料厚度10 mm鲜花的物料温度上升速率最慢,180~240 min由-32 ℃急速上升至-18 ℃,240~360 min缓慢上升至-10 ℃,360~570 min又急速上升至30 ℃,600 min之后保持35 ℃恒定。
图4b展示了程序P10的温度变化趋势,在干燥阶段,干花温度仍与隔板温度保持一致的梯度升温趋势;物料厚度5 mm鲜花的物料温度在180~420 min由-31 ℃缓慢上升至-15 ℃;420~570 min急速上升至10 ℃,570 min之后与干花温度和隔板温度保持一致;物料厚度10 mm鲜花的物料温度在180~600 min由-34 ℃缓慢上升至-17 ℃,在600~870 min急速上升至32 ℃,900 min之后保持35 ℃恒定。
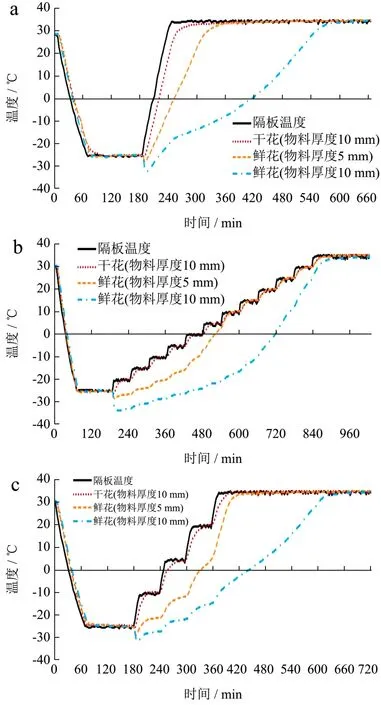
图4 桂花真空冷冻干燥曲线Fig.4 Vacuum freeze-drying curve of O. fragrans
图4c展示了程序P12的温度变化趋势,在干燥阶段,干花温度仍与隔板温度保持一致的梯度升温趋势;物料厚度5 mm鲜花的物料温度在180~360 min由-27 ℃缓慢上升至5 ℃;360~420 min急速上升至32 ℃,450 min之后与干花温度和隔板温度保持一致;物料厚度10 mm鲜花的物料温度在180~360 min由-31 ℃缓慢上升至-15 ℃,在360~630 min匀速上升至32 ℃,660 min之后保持35 ℃恒定。以上结果说明,升温程序、物料含水量和物料厚度均会影响冻干曲线及冻干时间。
2.5 不同工艺干燥桂花品质分析

表2 不同工艺干燥桂花品质比较Table 2 Comparison of the quality in O. fragrans dried by different methods
由表2可知,采用不同工艺将20 mm物料厚度的桂花干燥15 h,最后均可使桂花含水率低于5%。不同工艺干燥桂花含水率还是有一定差异的,由45 ℃烘干和P14冻干的含水率最低,分别为1.30%和1.21%;P10冻干的含水率最高,为3.54%。复水比可反映物料在干燥过程中的受损程度[26],由表2可知,烘干桂花的复水比最差,为2.98 g/g;P9冻干桂花的复水比显著高于烘干桂花,略低于其他5种程序冻干的桂花。黄酮是桂花花瓣中的重要活性物质,具有抗氧化、清除自由基、增强机体免疫力的保健功能[27-29],由表2可知,采用不同程序冻干的桂花总黄酮含量差异不显著,在35~38 mg/g·DW之间,显著高于烘干桂花26.93 mg/g·DW。另外,冻干桂花的香味也明显浓于烘干桂花;但不同程序冻干的桂花之间,香味差异不是很明显。可见,真空冷冻干燥工艺的干燥桂花品质均显著优于烘干,但采用不同升温程序真空冷冻干燥的桂花品质还是有差异的,采用慢速升温对花瓣的损伤程度较小,更利于花瓣固有外形的保持,对黄酮含量和香味的影响却不大。
2.6 不同工艺干燥桂花香气活性物质分析
前人研究从桂花中共鉴定出17种参与香味形成的活性物质[7,30],本实验利用GC-MS检测干燥桂花中香气活性物质含量(图5)。结果发现,在冻干和烘干的桂花样品中均只检测到4种香气活性物质成分,分别为顺式-芳樟醇氧化物(呋喃型)、反式-芳樟醇氧化物(呋喃型)、顺式-芳樟醇氧化物(吡喃型)和反式-β-紫罗兰酮。这四种物质在不同工艺冻干的桂花之间差异不显著,顺式-芳樟醇氧化物(呋喃型)含量为6.70~6.87 μg/g·DW、反式-芳樟醇氧化物(呋喃型)含量为8.13~8.84 μg/g·DW、顺式-芳樟醇氧化物(吡喃型)含量为4.41~5.07 μg/g·DW、反式-β-紫罗兰酮含量为18.87~21.74 μg/g·DW;但这四种物质在冻干桂花中的含量显著大于烘干桂花的2.27 μg/g·DW、0.98 μg/g·DW、3.42 μg/g·DW和7.47 μg/g·DW。由此说明,真空冷冻干燥更利于桂花香味的保留,不同真空冷冻干燥升温程序对香气活性物质含量的影响不大。

图5 不同方法干燥桂花香气活性物质含量比较Fig.5 Comparison of the content of aroma active compounds inO. fragrans dried by different methods
2.7 不同工艺干燥桂花微观结构分析
利用扫描电镜观察不同方法干燥桂花的花瓣表面细胞结构,结果显示(图6),程序P9冻干桂花的花瓣细胞发生萎缩,花瓣表面有明显的凹凸不平;程序P10冻干桂花的花瓣细胞大部分饱满,花瓣表面较平整;程序P12冻干桂花的花瓣细胞较饱满,花瓣正面平整,背面有较浅的凹凸;烘干桂花的花瓣细胞发生严重萎缩,花瓣表面崎岖不平。该结果进一步验证,真空冷冻干燥能较好保持桂花花瓣原有形态,缓慢的升温程序更有利于固有形态的保持,并提高复水性能。

图6 不同方法干燥桂花的扫描电镜图Fig.6 SEM of O. fragrans dried by different methods
3 结论
3.1 本实验通过电阻法测得桂花的共晶点为-19 ℃,共熔点为-17 ℃。预冻温度设置-25 ℃ 2.5 h能保证桂花中水分完全结晶,满足真空冷冻干燥的预冻要求。干燥阶段,物料厚度和隔板温度是影响真空冷冻干燥效率的重要因素。桂花真空冷冻干燥曲线随物料含水量、物料厚度及升温程序变化,大致为前期物料温度缓慢上升,中期物料温度急速上升,后期物料温度随隔板温度保持恒定三个阶段,实际生产应根据生产目的和成本适当调整。
3.2 研究发现,真空冷冻干燥和烘干桂花中的组织结构、复水性、活性成分和花香成分含量存在很大差异。真空冷冻干燥桂花的花瓣细胞萎缩程度低,花瓣表面平整,能够较好维持原有花瓣形色,复水比为4.16~4.56 g/g;而且缓慢的升温程序更利于花瓣固有形态的保持,也因此复水比更高,为4.56 g/g。真空冷冻干燥桂花中的总黄酮含量在35.90~38.42 mg/g·DW之间,不同升温程序冻干桂花间差异不显著,但均显著高于烘干桂花26.93 mg/g·DW。从真空冷冻干燥和烘干的桂花中均只检测到四种香气活性物质,分别为顺式-芳樟醇氧化物(呋喃型)、反式-芳樟醇氧化物(呋喃型)、顺式-芳樟醇氧化物(吡喃型)和反式-β-紫罗兰酮;这四种物质含量在不同升温程序冻干桂花中的差异不显著,但在真空冷冻干燥桂花中的含量均显著高于烘干桂花。
3.3 本研究为高品质桂花干燥产品及工业化生产提供理论基础。真空冷冻干燥后的桂花较好的保持了原有的形、色、香,即可直接用作桂花茶、又可复水后进一步加工,因此冻干桂花具有广阔的市场前景。
