全球变暖和海洋酸化背景下珊瑚礁生态响应的研究进展
2021-03-02李言达易亮
李言达,易亮
1. 北京大学生命科学学院,北京 100871
2. 中国科学院南京地质古生物研究所,现代古生物学和地层学国家重点实验室,南京 210008
3. 同济大学海洋地质国家重点实验室,上海 200092
自工业革命以来,人类活动所排放的大量CO2及其他温室气体进入大气圈后,对全球变暖产生了重大影响;就海洋而言,伴随海水温度和大气CO2浓度的升高,极端事件更加频繁且剧烈,海水水体也逐渐酸化[1]。作为海洋系统的重要组成,珊瑚礁具有巨大生态和经济价值,也是海洋生态系统中最脆弱的一环,不可避免的遭受到全球变暖和海洋酸化的全面影响[2-3]。近年来,大量学者从全球增温和海洋酸化背景下的珊瑚礁生态响应过程与机制等方面开展了十分深入的研究,取得了一批具有重大影响的认识。例如,有研究预示,受全球变暖和海洋酸化的严重干扰,21世纪生物礁生态系统中的珊瑚含量将大幅下降[4];虽然,应对这一不可逆过程并维持珊瑚礁的生态功能需要借助科学、社会和政府多方面的全力合作[5],但由于在过去珊瑚礁响应全球变化等重要细节不清晰,目前预测珊瑚礁的发展仍有许多不确定性[6]。这些认识不但为珊瑚礁的保护和预测提供了理论支持,也为揭示过去全球变化中珊瑚礁记录的古环境过程及其可能反馈奠定了基础。因此,本文将从全球变暖和海水酸化两个主要方面,对近年来获得的这些研究进行总结,尝试为珊瑚礁古环境研究中“将今论古”这一方法论提供支撑。
1 珊瑚对全球变暖的响应
伴随全球增温的显著,海洋极端高温事件(marine heatwaves, MHWs)也更加频繁和剧烈[7-8]。这一热胁迫可能会使造礁珊瑚的共生藻遗失,即珊瑚白化现象。近三十年以来,全球大多数地区的珊瑚礁均受到了较为严重的白化威胁[9];但不同地区的白化历史也有所不同:其中,大西洋的白化风险最高,太平洋其次,印度洋和澳大利亚周边则风险较低;不过在澳大利亚周边及中东地区,白化风险已经迅速增加(图1)。倘若热胁迫持续存在,白化的珊瑚最终将面临死亡,对珊瑚礁生态系统造成毁灭性打击[4-6]。因此,研究珊瑚白化对全球增温、海水变暖的响应特征与机制是预测未来珊瑚生存状况的基础。
1.1 高温胁迫引发珊瑚白化的生物学机制
对于热胁迫而言,珊瑚白化在分子及细胞层面的机制,目前研究还很不充分。一些研究认为活性氧(reactive oxygen species, ROS)可能在珊瑚白化中有重要影响[10-11]。根据这一活性氧假说,高温及强光导致共生藻叶绿体吸收更多能量,累积过量电子,生成更多氧气;高浓度的氧气产生活性氧,并向珊瑚细胞中扩散;珊瑚自身的线粒体也可在高温胁迫下产生活性氧。共生藻以及珊瑚中的活性氧在细胞层面造成的氧化损伤,可以最终诱导珊瑚白化。高温或强光胁迫下,共生藻主要是通过胞吐或类似机制被珊瑚宿主完整地排到珊瑚细胞外[12],其他可能还包括藻类的原位降解、藻类被珊瑚宿主释放到胞外、含有藻类的宿主细胞脱离珊瑚体,以及含有藻类的宿主细胞凋亡或自噬等[11]。不过,单细胞层面上的研究却表明活性氧可能并不是引发珊瑚白化的初始因素[13],当高温胁迫已经引起一定程度白化时,珊瑚内的活性氧浓度并无显著上升,且无明显的氧化损伤。

图1 2015—2016年白化事件中全球珊瑚礁的白化程度统计[9]Fig.1 Global coral bleaching in 2015 and 2016[9]
1.2 珊瑚对温度上升的适应性
按照适应白化假说,不同的共生藻类群对温度(或其他环境因子)有不同的适应能力,珊瑚也能调节其共生藻群落组成(如Tong等[14]):为适应环境,珊瑚通过白化失去共生藻,随后从外界获得新的共生藻。Baker[15]的移植实验中,从深水向浅水移植的珊瑚,在这种应激策略下,虽然短期白化率较高,但共生藻类随后发生的转变,促使珊瑚长期存活率也有提高;相反,从浅水向深水移植的珊瑚,虽然短期内没有经历白化,但其长期存活率较低。这些结果支持了珊瑚白化现象本身是一种高风险的适应机制。同时,野外观测也表明,在高温导致的严重白化和死亡事件后,珊瑚中耐热的共生藻更为丰富[16-17];并且至少在某些情况下,珊瑚白化后的耐热性增加是由共生藻群落组成的变化所导致,而不仅仅由于热胁迫引起的珊瑚自身变化[18]。
此外,珊瑚还可通过其他机制适应环境。例如,生活在温度更高且变率更大的潟湖环境中的风信子鹿角珊瑚(Acropora hyacinthus)对热应激白化的耐受能力更强[19],1~2年内就可获得对热应激的耐受能力,可能与其基因表达的变化有关[20]。通过短期热驯化(7~11天),细枝鹿角珊瑚(Acropora nana)表现出广泛的基因表达变化,表明这类珊瑚可能具有多级适应机制[21]。形态学方面也可观察到类似的热适应特征,如热驯化后的鹿角杯形珊瑚(Pocillopora damicornis)的胃层增厚,可能有利于保护共生藻[22]。
另一方面,全球变暖也可使一些珊瑚的抗白化机制失效。例如,Ainsworth等[23]发现过去30年间大堡礁75%的热应激事件都可归入“保护轨迹”:先有一个低于珊瑚白化阈值的亚高温,约10天的回落期后,温度再升高到白化阈值以上;这种情况下,前一个亚高温有助于珊瑚获得耐热性,降低珊瑚细胞的死亡及共生藻的损失。但0.5 ℃的全球变暖可能就足以使得“保护轨迹”转变为“单一/重复白化”轨迹[23]:亚高温的缺失导致抗白化机制的失效,造成珊瑚直接白化或死亡。
1.3 全球变暖抑制珊瑚的自我恢复
尽管小幅变暖可能会促使珊瑚钙化率升高,但安达曼海[24]和红海[25-26]的珊瑚钙化率下降可能与温度上升直接相关。这是因为珊瑚钙化中的pH调节过程通常依赖于共生藻的代谢活动,当温度超过阈值并叠加海水酸化的影响时,珊瑚的钙化过程将被抑制[27]。
同时,珊瑚幼虫的再定殖对于珊瑚白化后的恢复非常关键:白化事件后,成年珊瑚的死亡将直接导致新生珊瑚幼虫的数量减少;如果连续发生热胁迫,下一年珊瑚幼虫的存活率也会降低[28]。例如,2016年和2017年连续2次白化事件后,大堡礁的珊瑚幼虫定殖量仅为过去20年平均水平的11.3%,一些耐热性较差的种群下降幅度更大[29];倘若这种恶性循环得不到实质性缓解,整个珊瑚礁系统将最终崩溃。
1.4 温度上升改变珊瑚礁的群落结构
海水增温也将改变珊瑚礁的群落结构:某些珊瑚种类占比大为降低[30-31],这类以分支状珊瑚为主,如鹿角珊瑚(Acropora gemmifera、A. digitifera)、萼柱珊瑚(Stylophora pistillata)等;另一类以团块状及皮壳状珊瑚为主,种群占比相对增加,如横小星珊瑚 (Leptastrea transversa)、 澄 黄 滨 珊 瑚 (Porites lutea)、琉球扁脑珊瑚(Platygyra ryukyuensis)、海孔角蜂巢珊瑚(Favites halicora)等。同时,热胁迫下的珊瑚白化也会促使微生物群落发生改变[32]。如,有益细菌可能会减少,而珊瑚致病菌(pathogen)或机会致病菌(opportunistic pathogen)则可能增加[33]。此外,珊瑚群落结构的变化也可影响与珊瑚相关的其他动物的种群、多样性与行为模式等[34-36]。
例如,大堡礁2015—2016年白化事件中,珊瑚群落改变的程度与热胁迫呈正相关,严重白化(>60%)的珊瑚礁群落明显改变,未受白化影响的珊瑚礁则变化较小[37]。同时,珊瑚礁白化后,藻类覆盖率大幅增加,鱼类和无脊椎动物的空间分布格局也随之改变[38](图2)。从长期来看(10年以上),海水温度恢复正常后,虽然珊瑚礁群落的物种丰度可恢复到白化前的水平,但主要构成已转变为耐热种、能快速生长的本地残余种,及从附近迁移进入的新种[39]。在长期的生态系统修复中,塞舌尔的案例表明一部分严重白化(>90%)的珊瑚礁可以恢复到了由珊瑚主导的状态,另一部分则转变为了由肉质大型藻类主导的生态系统,Graham等[40]认为这种差异可能与珊瑚礁的群落复杂性或水深等要素有关。
2 珊瑚对海洋酸化的响应
珊瑚的钙化率由珊瑚的骨骼密度与生长速率两项参数决定。生长模拟[41]和野外观测[42-44]表明不同pH值影响下的珊瑚文石晶体结构没有明显区别,也没有溶解的迹象,因此,海水酸化并不会显著影响珊瑚骨骼的生长速率;但其形态结构却发生改变,即骨骼变薄、骨骼孔隙度增加、骨骼密度降低(图3)。此外,珊瑚幼体在酸化条件下的骨骼形态结构不但发生了变化,骨骼表面也出现溶解迹象,可能说明珊瑚幼体更加脆弱[45]。因此,海水酸化影响下珊瑚钙化率的变化并非只是简单的物理化学溶解过程,还与珊瑚发育机制有着密切联系。
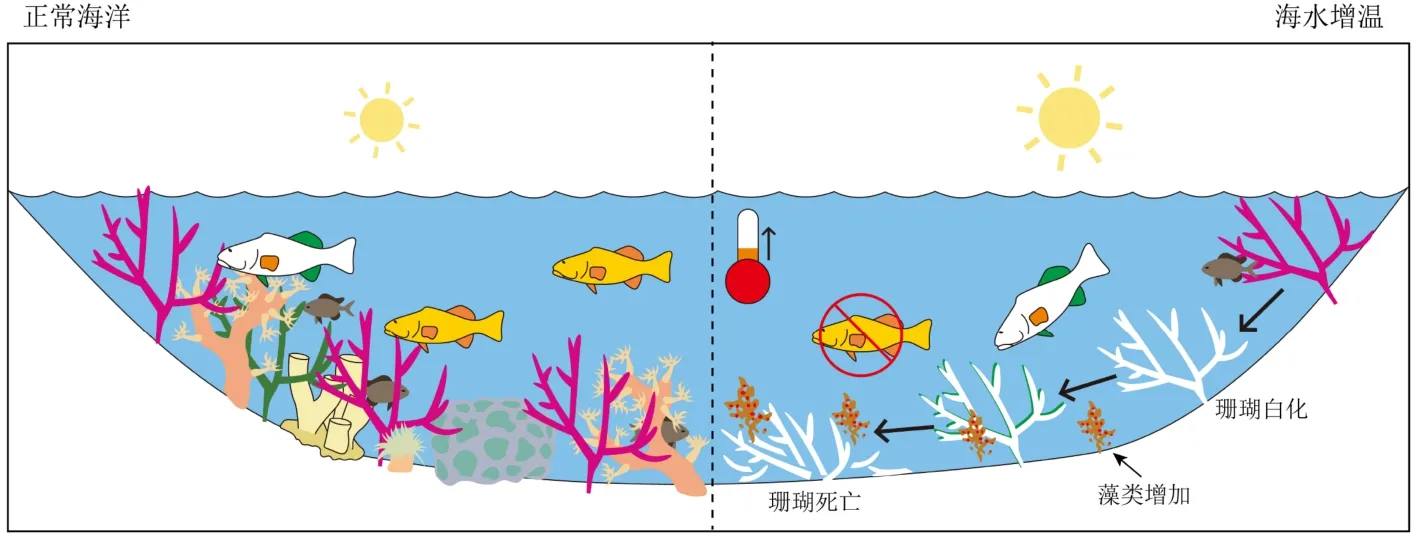
图2 海表温度上升对珊瑚礁群落的影响[3]Fig.2 Effects of sea surface temperature increases on coral reefs[3]
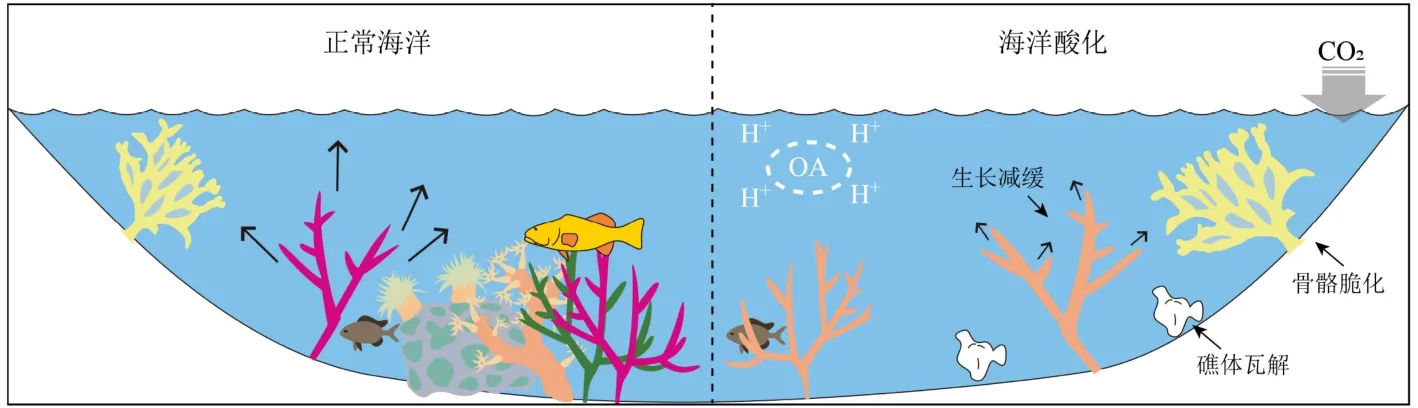
图3 海洋酸化对珊瑚礁的影响[3]Fig.3 Effects of ocean acidification on coral reefs[3]
2.1 珊瑚钙化对海水酸化的抵抗力
珊瑚骨骼钙化过程并非直接发生在海水中,而是在珊瑚体内的胞外钙化流体(extracellular calcifying fluid)与腔肠中的海水被反口面内胚层、中胶层和外胚层分隔开[46]。多种实验结果均表明,珊瑚钙化流体中的pH值要高于环境海水,原位微电极和pH敏感染料测得的pH值较日间瞬时钙化流体高约0.6~1.2[47-48],而硼同位素测得的pH值较长期平均值高约0.3~0.6[49]。当海水pH值下降时,钙化流体中的pH值下降幅度要小于环境海水[15],使得骨骼钙化实际发生处的文石饱和度维持在相对较高水平。珊瑚细胞膜上由ATP(adenosine triphosphate)驱动的Ca2+/H+反向转运泵应当参与了pH值的调节过程[46]。
McCulloch等[49]在考虑珊瑚的pH自我调节功能的基础上,建立了IpHRAC模型用以模拟不同要素影响下的珊瑚钙化响应。结果表明:假定温度恒定,CO2增加引起的海水酸化将导致珊瑚钙化率下降,但下降程度比其他没有pH调节能力的钙化生物低一半以上;若同时考虑水温和CO2的增加,珊瑚钙化率基本保持不变,对于部分珊瑚种类还可有小幅上升。同时,CO2增加可以促进珊瑚共生体的光合作用,协助抵消海水酸化的影响[50]。此外,澳大利亚西部珊瑚礁的野外研究表明,20世纪期间的滨珊瑚(Porites)钙化率非但没有下降,在一定程度上还升高了,表现为钙化率和海表温度距平的正相关关系[51]。
这些研究强调了当温度增加不太多时,珊瑚自身pH值调节功能在全球变暖背景下可以部分抵消海水酸化对珊瑚钙化率的影响。
2.2 海洋酸化抑制珊瑚幼虫发育
实验研究表明,珊瑚的精子活动[52-53]、受精过程[54-55]、幼虫代谢[56-57]、变态[57]、定殖与其后生长[54,56],特别是侧向生长[57],都受海水酸化的控制。野外观察证实酸化条件下的珊瑚幼虫定殖效率较低[58]。作为珊瑚幼虫的主要附着基质[59],壳状珊瑚藻因为高镁方解石含量较高而对海水pH值的变化非常敏感[60-64]。珊瑚生长的模拟实验也观察到海水酸化将导致的壳状珊瑚藻相关的微生物群落改变,并抑制珊瑚幼虫的附着[65-66];表明海洋酸化可能会对受损珊瑚礁的恢复产生负面影响。
因此,尽管成年珊瑚的顶端生长和整体的钙化率对海水酸化的响应并不显著,但其生活史的早期过程对酸化程度却十分敏感[67];在评估海洋酸化对珊瑚生长的影响时,不仅需要考虑珊瑚的整体钙化率,还需特别注意生长阶段的差异性。
2.3 海洋酸化引发珊瑚礁的溶解
虽然活体珊瑚对海水酸化有较强的抵抗力,但自然条件下,疏松的珊瑚骨骼将对溶蚀作用更为敏感[68]。礁相沉积也是珊瑚礁的重要组成部分,包括死亡珊瑚的骨骼、其他生物残体及各类碎屑组分。虽然活体珊瑚为应对海水酸化可以主动调节自身pH值,但珊瑚礁中没有生命的部分显然不具有此类功能;因而海水酸化对珊瑚礁的影响不仅反映在活珊瑚钙化率的变化上,也表现为礁相沉积的溶解过程[69]。
研究表明,对于活体珊瑚,即使在酸化水体中生长7个月至一年以上,文石晶体的形态也无明显变化[41,70];但死亡珊瑚的骨骼在酸化水体中仅放置3个月,其文石晶体就已经发生明显溶解[70]。模拟实验的结果也表明珊瑚礁中的活体珊瑚比例越低,礁体对于海水酸化越敏感[68]。
Eyre等[71]、Cyronak和 Eyre[72]分别在太平洋和大西洋的多个珊瑚礁中,向礁相沉积放置的有机玻璃腔通入CO2,通过控制局部海水pH值,获得了碳酸盐岩溶解程度与海水文石饱和度的负相关关系。按照这一认识,目前珊瑚礁沉积总量已比工业革命前有所下降,并在21世纪中期可能转为净溶解,由此导致整个珊瑚礁系统的彻底破坏[71-72]。
此外,Albright等[73]通过潟湖海水的CO2注入实验,进一步验证了海洋酸化会降低珊瑚礁系统的总体净钙化率。相反的,若加入NaOH使海水pH值恢复至工业革命前的水平,整个珊瑚礁系统的净钙化率显著升高[74]。这或许表明增加珊瑚礁周围海水的碱度是一种珊瑚礁保护的有效措施。
2.4 海洋酸化改变珊瑚礁的群落结构
总体而言,生长较快的珊瑚更容易受到海水酸化的影响[75-77],而在对海洋酸化有较强抵抗力的物种中,抵抗酸化的机制也不尽相同[78];因而,珊瑚对酸化的响应具有显著的物种特异性。在海洋酸化的背景下,珊瑚礁中对酸化敏感的物种会相对减少,抗酸性强的物种则会相对增多,生态系统内的多样性随之降低[79],而多样性的下降则可能进一步抑制珊瑚的生存和生长,形成恶性正反馈[80]。与珊瑚共生的微生物群落结构在这一过程中也可能发生改变,从而影响珊瑚的生理或健康状况[81]。
同时,通过研究与海底火山活动相关的CO2喷口或渗漏点附近的天然珊瑚礁群落特征(图4),人们发现随着海水pH值的降低,珊瑚礁生态系统将由珊瑚主导转变为大型藻类主导[82],珊瑚群落构成由造礁珊瑚转变为非造礁珊瑚[83],珊瑚的多样性显著降低[84],礁体发育停滞[84]、侵蚀增强[85]。此外,与珊瑚礁相关的大型底栖无脊椎动物[86-87]以及下层浮游动物[88]的数量以及多样性总体上也有减少。尽管这些研究反映的是与海水的空间pH值变化相关的群落差异,而非珊瑚礁群落在时间上的变化,但这一结果仍强烈暗示了全球海洋酸化可能导致珊瑚礁系统发生类似的群落结构变化。
3 珊瑚礁演变预测
珊瑚礁的预测主要基于耦合不同要素的环流模型(general circulation models, GCMs)[89-90],或基于详细观测的局地数值计算[91-92]。在这些预测中,早期通常简单地使用周热度指数衡量珊瑚的白化阈值[89-90],而未能考虑极端高温事件的频率、局地的水动力条件、海洋酸化的协同效应,以及珊瑚自身演化和适应。新近研究指出,局地的水动力条件复杂多变[93];海水酸化影响下的珊瑚更易受到生物侵蚀[68];珊瑚种群的恢复速率并非一成不变,也会受到白化影响[29]。与全球平均温度逐渐升高的趋势相比,珊瑚种群对极端高温事件的反应更为强烈,在极端高温事件频发的 RCP(representative concentration pathway,温室气体排放情景)8.5情景下,珊瑚不太可能从白化事件中恢复过来[91]。不过,Woesik等提出RCP 6.0情景下珊瑚覆盖率或许足以维持在可观水平[91];但Kubicek等[92]坚持认为只有能快速适应的珊瑚群落才能在RCP 6.0或更高情景下生存,适应慢的珊瑚群落即使在RCP 2.6情景下也令人堪忧。因此,对珊瑚礁未来变化的预测还存在很多不确定性[5],未来需要获得更多、更精确的约束条件等关键数据,具体包括珊瑚礁演化对过去全球变化的响应过程、珊瑚生态系统对现在全球变化响应的深层机制、珊瑚及其他藻礁生物的进化特性等。
4 结论与展望
伴随着海洋水体的增温和酸化,全球珊瑚礁系统均遭受较为严重的威胁。其中,对于高温强迫而言,海水温度上升诱发珊瑚白化、抑制珊瑚的自我修复,影响珊瑚礁的群落结构;另一方面,海洋酸化可以显著降低珊瑚钙化率、抑制珊瑚幼虫发育、引发珊瑚礁的溶解,也可改变珊瑚礁的群落结构。在这些过程中,珊瑚自身可以通过调控共生藻的种群转换与基因表达等手段在一定程度上抵抗高温胁迫,但对于高温诱导珊瑚白化的生物学机制目前还不清楚。此外,较低程度的升温也有助于提高珊瑚对酸化的抵抗能力,并最终影响珊瑚白化后的恢复。
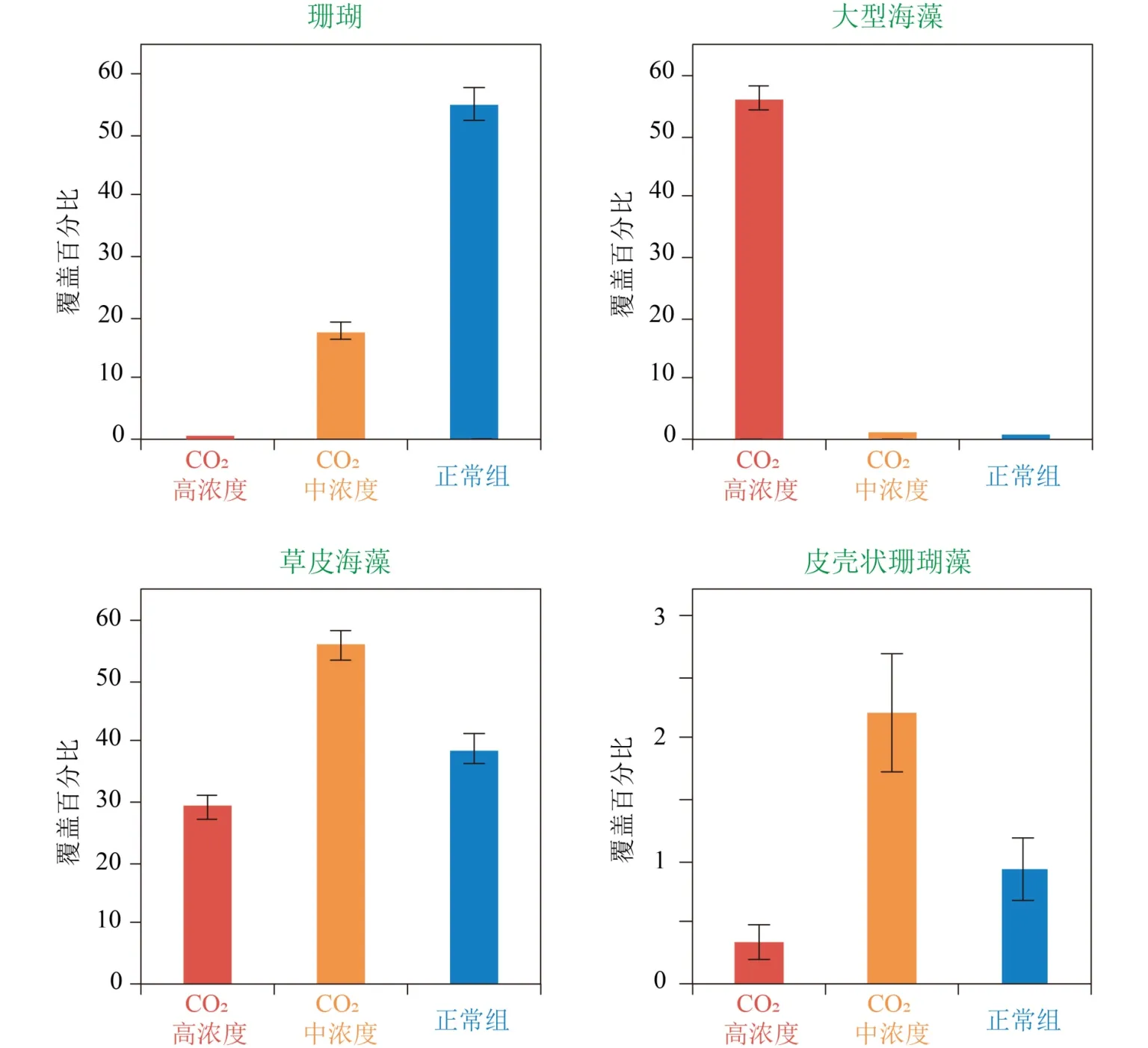
图4 海底火山通风口处CO2排放量对生物礁群落的影响[82]Fig.4 The influence of CO2 released from submarine volcanic vent on coral reef taxa[82]
在这些认识的基础上,目前已经建立了珊瑚白化事件与海洋变暖之间的半定量关系,并意识到随着全球变暖,珊瑚白化的频率与严重程度也在逐渐升高。根据模型结果推测,倘若温室气体的排放不受控制(RCP 8.5),绝大多数珊瑚礁到21世纪末都将遭受灾难性打击。为更好地应对珊瑚礁保护,构建未来不同场景下的珊瑚礁预测模型,阐明不同类别珊瑚礁对高温、酸化等关键因子的响应机制是此间要点之一。
然而,现代观测仅能覆盖过去数十年至一百年的区间,这些数据在有效约束模型方面仍存在极大的局限性。例如,过去数亿年间,海洋的水化学特征可能控制了珊瑚的骨架特征与种群进化[94];另一方面,中中新世(16.0~11.6 Ma)是全球气候的温暖期[95],但也是西太平洋珊瑚礁发育的极盛期[96-97]。由此推测不同地史时期内的珊瑚礁对全球变暖和海洋酸化可能具有完全不同的响应特征和机制。因此,加强珊瑚礁的长序列研究可以为珊瑚礁演化预测提供有益的关键补充,特别是在弥补现代观测的不足、刻画珊瑚礁长周期演化特征、揭示珊瑚礁响应全球变化的长期机制等方面展示更为精准的边界约束。
