二氧化碳在地层水中的溶解度测定及预测模型
2021-03-02林元华邓宽海宁华中石云升曾德智刘婉颖
林元华, 邓宽海, 宁华中, 石云升,3,曾德智, 刘婉颖
(1.西南石油大学油气藏地质及开发工程国家重点实验室,四川成都610500; 2.西南石油大学石油管工程重点实验室,四川成都 610500; 3.西南石油大学材料科学与工程学院,四川成都 610500)
酸性气藏是指产出的天然气中含有H2S、CO2等非烃类酸性气体的一类气藏,其广泛分布于世界各大气田,且在中国川渝地区的气田尤为突出[1-3]。酸性气体H2S、CO2体积分数超过2%则被定义为高酸性气藏。高酸性气藏中含有H2S、CO2等酸性气体,不仅具有强腐蚀性,而且具有剧毒性。高酸性气藏开发过程中应避免由H2S、CO2等酸性气体引起的油套管失效事故[4],贯彻“井筒完整性管理”理念[5-7]。H2S、CO2等酸性气体在地层水中的溶解度变化是导致高频率油套管腐蚀开裂(SSC)、氢脆(HIC)等环境断裂失效事故的重要原因[8-9]。科研人员开展广泛温度及压力下CO2在纯水中的溶解度研究[10-15],而关于CO2在NaCl水溶液的溶解度测试数据较为缺乏[12,14-19],并且只简单给出了单因素(温度、压力及矿化度)对CO2溶解度的影响规律[20-26],缺乏溶液体系下CO2溶解度的主控因素研究和简便有效的CO2溶解度预测模型。笔者研究CO2在油气井地层水中溶解度测定及计算模型。
1 实验装置及方法
1.1 实验材料及装置
测试CO2在纯水、去离子水及2种矿化度(0.07和0.7 mol/kg)地层水中的溶解度,测试温度为303.15~363.15 K,测试压力为5~30 MPa。其中CO2溶解度在纯水中的溶解度测试是用于验证测试装置及方法的准确性和可靠性,2种矿化度地层水均采用去离子制备,CO2气体纯度(物质的量分数)为99.99%,NaCl纯度(质量分数)为99.5%。实验材料及条件见表1。

表1 CO2溶解度测试条件
自主研发的CO2溶解度测试装置主要包括PVT反应筒、驱替泵、气液分离器、电磁加热器、干燥装置、减压阀、可移动特殊软管、密封活塞、移动驱替顶杆和气量计,测试过程见图1。装置主要特征是:①PVT反应筒由变体积圆筒、密封活塞、移动驱替顶杆和特殊软管组成,其中密封活塞在移动驱替顶杆作用下可在变体积圆筒内上下来回移动,从而很好地控制圆筒体积;②在密封活塞上下移动过程中,特殊软管能够始终位于PVT反应筒的底部,确保CO2气体可直接被注入到PVT反应筒底部,增大CO2气体与溶液之间的接触面积,显著降低气液平衡时间。
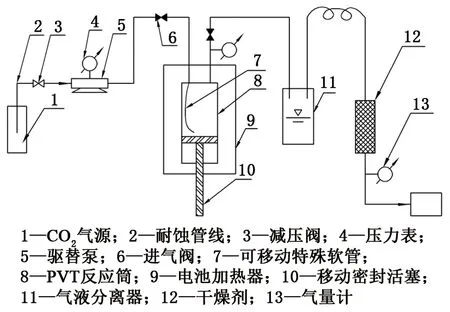
图1 CO2溶解度测试过程Fig.1 Experiment process of CO2 solubility
1.2 实验方法
提出一种模拟高温高压油气井环境的CO2溶解度测试方法:①装置试压测试,压力为0~40 MPa;②体积为V1的样品溶液装入PVT反应筒;③通过软管缓慢注入CO2气体,排出装置内部的空气;④开启温控箱,加热PVT反应筒到实验所需温度;⑤向PVT反应筒底部缓慢注入CO2气体,达到实验所需压力;⑥气液平衡后,释放未溶解气样;⑦气液分离,并计量气体体积V0及气液分离器内析出的液体体积V2;⑧计算溶解度V0/(V1-V2);⑨每组实验重复3次。
1.3 实验装置及方法的验证
为验证以上实验装置及方法的准确性及可靠性,利用上述实验装置及方法开展CO2在纯水中的溶解度测试,温度为323.15 K,压力范围5~15 MPa,将实验值与Drummond、Wang、Liu及Duan等[27-30]文献数据进行对比,如图2所示。由图2可知,本文中得到的试验数据与相同条件下的文献数据基本一致,所有文献数据与本文中试验数据之间的最大误差为6.92%,表明研发的测试装置及对应的测试方法是准确可靠的,可用于开展模拟油气井环境下CO2在地层水中溶解度的测试。

图2 实验值与文献数据之间的对比Fig.2 Comparison between experimental results and data from literature
2 CO2溶解度测试结果及分析
开展模拟油气井环境下CO2在去离子水和2种矿化度地层水的溶解度测试,温度为303.15~363.15 K,压力为5~30 MPa,结果如表2所示。由表2可知,CO2溶解度受温度、压力及矿化度的影响,其溶解度与温度、压力及矿化度密切相关。

表2 CO2在去离子水和两种矿化度地层水中的溶解度Table 2 CO2 solubility in deionized water and two kinds of NaCl solutions mol/kg
2.1 压力对CO2溶解度的影响
图3分别为2种矿化度(0.07和0.7 mol/kg)地层水中CO2溶解度与压力之间的关系。由图3可知,相同温度条件下,CO2在2种地层水中的溶解度随压力变化整体上呈非线性关系,然而在0~15 MPa和15~30 MPa两个范围内,CO2溶解度与压力基本呈线性关系。在压力低于15 MPa时,CO2溶解度随着压力的增加而快速增加,在压力高于15 MPa时,CO2溶解度随着压力增加而缓慢增加。对比曲线斜率可知,相同温度条件下,0~15 MPa范围内的增长斜率远远大于15~30 MPa范围内的增长斜率。由此可知,15 MPa为CO2溶解度变化的转折点(转变压力)。由图3可知,在相同矿化度地层水中,温度越高,达到相同CO2溶解度所需的压力越大。因此即使在相同油田区块的不同井或相同井的不同井段,CO2溶解度都会容易出现较大差异。
2.2 温度对CO2溶解度的影响
由于CO2溶解度在2种地层水中的溶解度变化规律完全相同,以CO2在0.7 mol/kg NaCl地层水中的溶解度为例,结果见图4。由图4可知,与压力对CO2溶解度影响规律相比,在相同压力条件下,CO2溶解度在不同温度下的变化规律较简单,即溶解度随着温度的增加而非线性降低;与压力高于10 MPa相比,当压力低于10 MPa时,CO2在地层水中溶解度随温度的增加而降低更快,表明较高的压力(大于15 MPa)在一定程度上可缓解或抑制温度对CO2溶解度的影响,以至于在更高的压力及温度下,这种现象会更加明显。文献数据[31]也显示,当压力高于30 MPa且温度高于373.15 K时,CO2溶解度出现随着温度的增加而非线性增加的趋势。因此有必要弄清具体温度、压力及矿化度条件下,影响CO2在地层水中溶解度的主控因素。与较高的压力(大于15 MPa)相比,较低的压力(小于15 MPa)对CO2溶解度的影响更强,进一步证明15 MPa为CO2在地层水中溶解度变化的转折点。同理,上述现象也有助于在相同油田区块的不同井或相同井的不同井段形成巨大的腐蚀差异[32]。
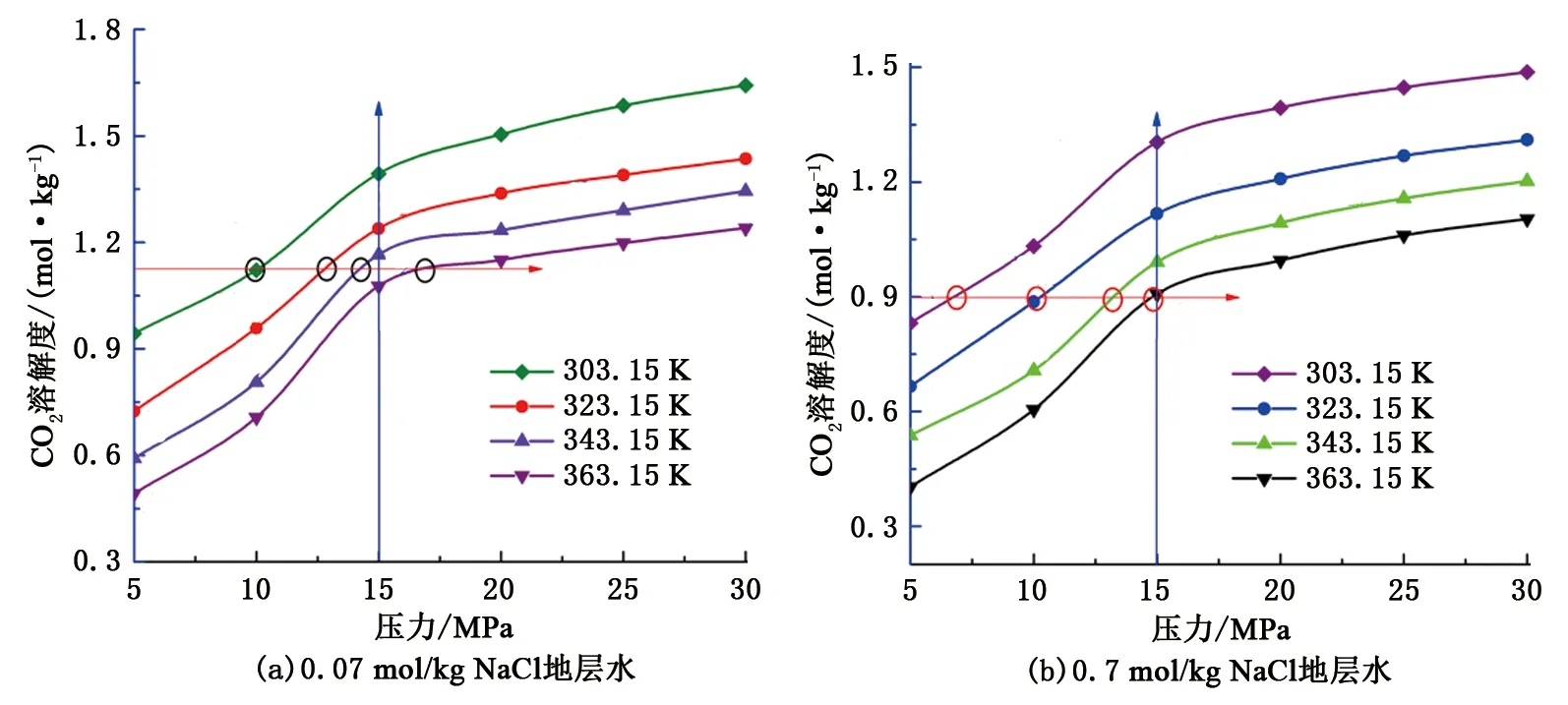
图3 CO2溶解度与压力之间的关系Fig.3 Relationship between CO2 solubility and pressure

图4 0.7 mol/kg NaCl地层水中CO2溶解度与温度之间的关系Fig.4 Relationship between CO2 solubility and temperature in 0.7 mol/kg NaCl solutions
2.3 矿化度对CO2溶解度的影响规律
图5为323.15 K下CO2溶解度与矿化度之间的关系,图6为10 MPa下CO2溶解度与矿化度之间的关系。由图5、6可知,CO2溶解度随着矿化度的增加而明显降低,其主要原因是NaCl的加入导致“盐析效应”,即当离子盐被加入到水中时,一方面降低水的活度系数,另一方面离子盐溶解形成复杂化合物将吸收水分子,即所谓的“溶剂效应”。因此CO2在水溶液中的溶解随着NaCl这种离子盐浓度的增加而变得更困难。此外,CO2在3种矿化度水溶液中溶解度随温度压力的变化趋势基本一致,表明矿化度对CO2溶解度的影响是独立的,基本不受温度及压力的影响,即温度和压力既不能加强也不能缓减“盐析效应”。

图5 在323.15K下CO2溶解度与矿化度之间的关系Fig.5 Relationship between CO2 solubility and salinity at 323.15 K
根据早期研究结果[33-34]及本实验数据可知,在合适的温度及压力条件下,通过增加NaCl矿化度来降低CO2在地层水中的溶解度可一定程度上减缓井下油套管的腐蚀。
2.4 基于灰色关联度法的CO2溶解度敏感性
CO2在地层水中的溶解度受到温度(T)、压力(p)及矿化度(C,即NaCl质量摩尔浓度)的共同影响。在实际油气井环境下,高温、高压及高矿化度常常同时存在。因此基于实验数据,采用灰色关联度法研究CO2溶解度与温度、压力及矿化度等3因素之间的相关性,得到CO2溶解度与3种因素之间的关联度。不同温度、压力及矿化度条件下的CO2溶解度被定义为系统行为并形成比较序列(X1-3),而温度、压力及矿化度被定义为系统因素并形成参考序列(Y1-4),关联度越大,表明系统行为(溶解度)与因素(T、p或C)之间的相关性越强,反之越弱[35]。

图6 在10 MPa下CO2溶解度与矿化度之间的关系Fig.6 Relationship between CO2 solubility and salinity at 10 MPa
基于灰色关联度法,0.07和0.7 mol/kg地层水在不同温度及压力下的实验数据被用来分析各因素与CO2溶解度之间的相关性,比较序列和参考序列公式为

(1)
比较序列和参考序列之间的关联度计算结果见图7。
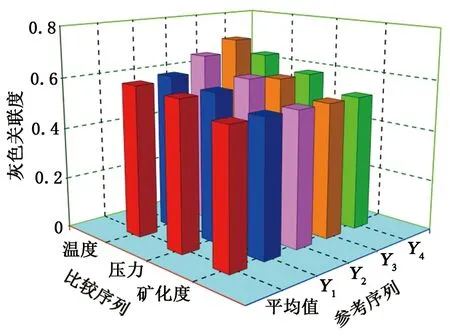
图7 T-p-C与CO2溶解度之间的灰色关联度对比分析Fig.7 Comparison and analysis of relational degree between CO2 solubility and T-p-C
由图7可知,参考序列(Y1-4)与温度(X1)之间的灰色关联度分别为0.59、0.60、0.67、0.72,平均关联度为0.64,即温度与CO2溶解度的关联度为0.64。同理,参考序列(Y1-4)与压力(X2)之间的灰色关联度分别为0.58、0.58、0.61、0.59,平均关联度为0.59,而参考序列(Y1、Y2、Y3、Y4)与矿化度(X3)之间的灰色关联度均为0.53。因此温度、压力、矿化度对溶解度影响由强到弱依次为温度、压力、矿化度。
3 CO2溶解度预测模型
3.1 模型的建立
传统的Peng-Robinson状态方程不适用于强极性物质水的活度计算,而Vander Waals混合规则不适用于高度非理想状态的气液平衡关联,不适用高含CO2体系高压近临界相平衡计算,不适合有极性水和高含CO2的高度非对称体系的相平衡计算。因此采用Huron等提出的逸度系数模型结合Peng-Robinson状态方程的方法来描述CO2-H2O体系的热力学性质[14],其状态方程如下:
(2)

在不限定压力的条件下,采用Huron和Vidal提出的表达式计算Gibbs自由能:

(3)
式中,gji为不同分子间作用的玻尔兹曼因子;gii相同分子间作用的玻尔兹曼因子;kij为组分i和组分j之间的相互作用系数;Gji和Gki为与温度有关的可调参数;αji为组分i、j之间的非随机参数,αki为组分i、k之间的非随机参数。
基于化工热力学原理可得以(T,p)为独立变量的组分i的逸度系数通式:

(4)
式中,φi为i组分的逸度系数;vt为体系总体积,cm3/mol;ni和nj分别为i和j组分的物质的量。
结合Peng-Robinson状态方程与Huron—Vidal混合规则可得到混合物逸度系数φm:
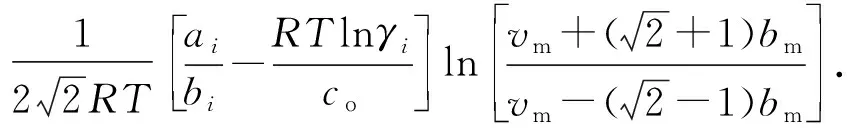
(5)
式中,φm为混合物逸度系数;Zm为混合物的偏差因子;vm为混合体系的摩尔体积,m3/mol;γi为混合物中i组分的活度系数。
3.2 模型参数修正及计算方法
3.2.1 基本物性参数
CO2溶解度预测模型的计算方法:①计算出基于已知条件的气相逸度系数;②采用气相逸度系数迭代求出液相逸度系数和液相中的CO2含量;③采用返算法得到溶解度的计算值。以预测CO2溶解在NaCl水溶液中的溶解度为例,给出H2O、NaCl和CO2的临界参数、偏心因子、标准沸点、摩尔质量等基本物性参数,如表3所示。

表3 模型中组分的临界参数
3.2.2 参数修正及计算过程
(1)相互作用系数计算。笔者将二元交互作用参数关联为CO2临界温度、偏心因子和绝对温度的函数,关联式如下:
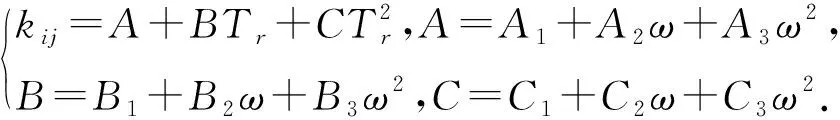
(6)
式中,Tr为对比温度,即绝对温度与物质临界温度之间的比值;A、B、C为偏心因子的函数。
基于本文中实验数据和文献[27]数据,采用MATLAB软件优化二元相互作用参数,降低计算值与实验值之间的平均误差,平均误差的计算如下:
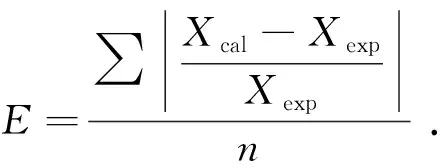
(7)
式中,Xcal和Xexp分别为溶解度的计算值与实验值;n为选取数据点。
采用MATLAB软件拟合得到关联式参数及二元交互作用参数kij见表4、5。

表4 关联式参数Table 4 Correlation parameter 103

表5 二元交互作用参数kij
(2)气相逸度系数计算。首先由PR方程计算出a1、a2、a3、b1、b2和b3。
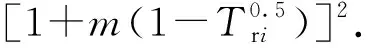
(8)
其次由混合规则计算出气相的am和bm:
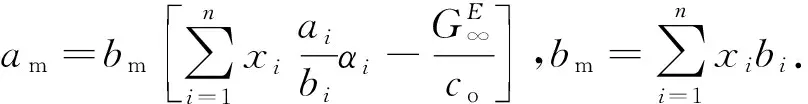
(9)

再次,通过压缩因子计算出H2O和CO2的压缩因子Z,Z(H2O)为0.229,Z(CO2)为0.274:

(10)
最后通过逸度系数求解公式并得到CO2的气相逸度系数:

(11)

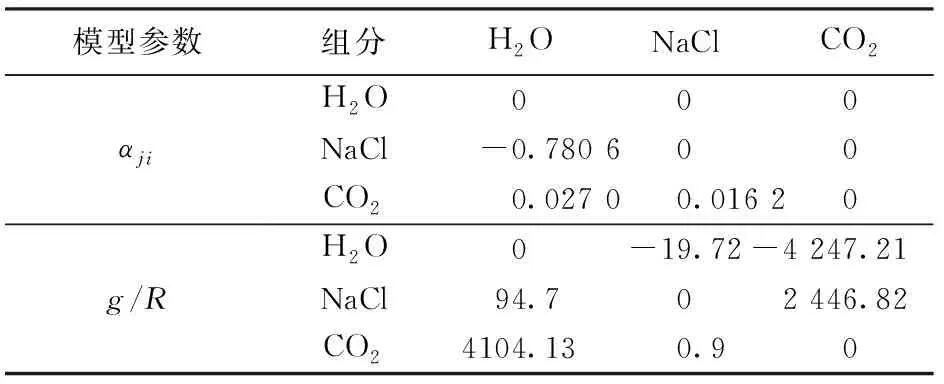
表6 模型中Gibbs自由能计算参数
(4)溶解度值计算。根据状态方程可知,CO2在两相体系中的逸度相等,故
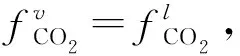
(12)
且任一相中CO2的逸度由逸度系数可得

(13)
因此由式(12)和式(13)可得CO2在液相中的溶解度:

(14)
3.3 模型的验证
3.3.1 计算结果
不同温度、压力、矿化度下的CO2溶解度计算结果见表7。
3.3.2 计算结果与实验数据对比
为验证本模型的准确性及可靠性,首先将本试验数据与相关文献数据及模型计算结果进行对比,由于相同实验条件(温度、压力、矿化度)下的文献数据极其缺乏,采用CO2在323.15 K、 0.7 mol/kg地层水中不同压力下的相似数据进行对比,其中Yan等[17]、Koschel等[24]和Sandrine等[31]的NaCl质量摩尔浓度为1.0 mol/kg,略高于本实验,Mao等[14]的NaCl质量摩尔浓度为0.7 mol/kg,实验条件完全相同,而Bando等[25]的NaCl质量摩尔浓度为0.54 mol/kg,略低于本实验,结果如图8所示。将本试验数据与给出的理论模型预测值进行对比(以0.7 mol/kg NaCl地层水溶解度为例),结果见图9。
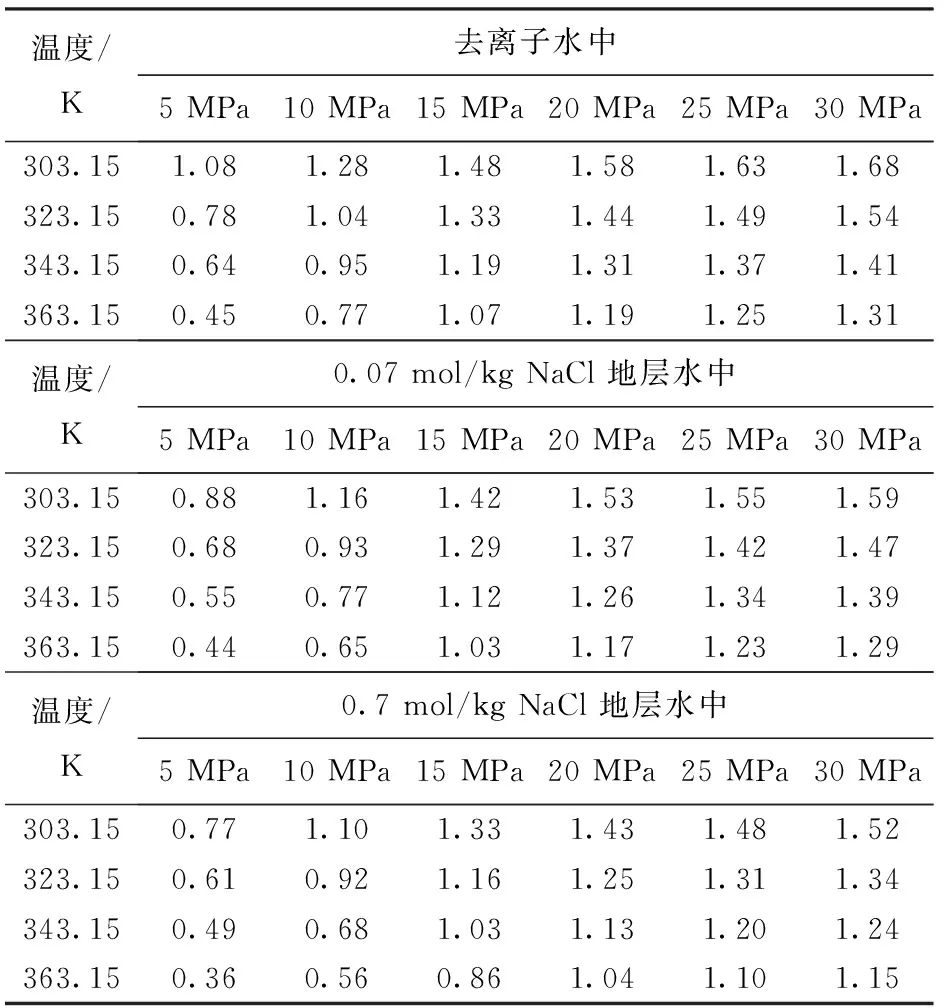
表7 CO2在去离子水及不同矿化度地层水中的溶解度Table 7 Calculation results of CO2 solubility in different formation water and deionized water mol/kg

图8 本试验数据与文献给出的实验值及预测值对比Fig.8 Comparison between experiment data and prediction results from model proposed by literature
由图8可知,在相同实验条件下,本试验数据与Mao等模型计算结果非常接近;在不同实验条件下,本试验数据大于Sandrine、Yan、Koschel等给出的试验及模型计算结果,而小于Bando等给出的试验数据。其主要原因是,在相同温度及压力条件下,本实验的NaCl质量摩尔浓度(0.7 mol/kg)小于Sandrine、Yan、Koschel等给出的NaCl质量摩尔浓度(1.0 mol/kg),而大于Bando等给出的NaCl质量摩尔浓度(0.54 mol/kg),上述现象表明本实验方法及装置是准确可靠的,同时进一步证明NaCl质量摩尔浓度及矿化度对CO2的溶解具有抑制作用,即NaCl产生的“盐析效应”能降低CO2溶解度。对比图9可知,不同温度及压力下CO2在0.7 mol/kg NaCl 地层水中的溶解度实验值与本文提出的理论模型预测值基本一致,大部分实验值略小于模型预测值,且误差均较小。综上可知,本文中提出的地层水中CO2溶解度预测模型是准确可靠的,可用于预测模拟油气井环境下不同井段的CO2溶解度。

图9 试验值与本理论预测值对比Fig.9 Comparison between experiment data and prediction results from model proposed
4 结 论
(1)提出的可模拟油气井环境下地层水中CO2溶解度的方法,其准确性及可靠性得到文献数据的验证。
(2)溶解度随压力变化最复杂,存在转变压力(本实验中的转变压力为15 MPa),即在转变压力以下,CO2溶解度随压力增加更快。
(3)温度为CO2溶解度的主控因素,压力次之,矿化度最小。
(4)CO2溶解过程受温度、压力及矿化度3种因素的混合控制,其溶解度的变化趋势主要依赖于CO2气体分子在水溶液中的溶解速度和逃逸速度。
