北方地区黄芪根系发育、成分积累及表观生长种间差异
2021-03-02徐海军程薪宇王晓飞
徐海军 姚 琴 程薪宇 王晓飞
(1. 东北林业大学森林植物生态学教育部重点实验室,哈尔滨 150040;2. 黑龙江省科学院大庆分院,大庆 163319;3. 大庆油田矿区事业服务部园林绿化公司,大庆 163711;4. 上饶师范学院生命科学学院,上饶 334001)
膜荚黄芪(Astragalus membranaceus)或蒙古黄芪(Astragalus membranaceusvar.mongholicus)的干燥根可入药[1~2](《中华人民共和国药典》2015 版),其味甘、性微温,归脾、肺经,具有补气升阳,益卫固表,利水消肿,生津养血,行滞通痹,托毒排脓,敛疮生肌之功效,在临床、膳食、保健、饲用等方面都有广泛的应用[3~6]。
近些年,黄芪野生资源储量不断减少,加之市场需求逐年增加,促使黄芪人工种植产业迅猛发展。黄芪种植多以蒙古黄芪为主,膜荚黄芪较少,随着黄芪产区逐渐“北移”,膜荚黄芪的种植面积逐渐增加,但生产过程中蒙古黄芪和膜荚黄芪生长及药用成分差异仍未受到关注。经典分类学主要依据子房有毛与否,小叶大小和数目特征,确定蒙古黄芪为膜荚黄芪的变种;后来,许多学者又分别从物候节律,地上部分发育形态学、开花生物学、染色体差异[7]、种子形态[8~9]、叶片结构[10]、分子标记[11~12]等多个方面提供了分类依据,阐述蒙古黄芪为独立的种。因此,蒙古黄芪与膜荚黄芪种间分类学识别特征较为明确,但二者之间在栽培种植中与经济性状相关的生物学特征差异还需在生产中进一步了解。北方地区气候寒冷,蒙古黄芪和膜荚黄芪的根系品质、物质积累二者间有较大差异,差异变化如何还未见报道。本文从根系结构发育、根系形态、药用成分、表观生长量等生物学特征比较分析两个种在生产种植中的差异,以期为北方地区黄芪种植在品种筛选、种植管理方面提供基础数据和理论支持。
1 试验地概况
黑龙江省位于我国东北部,属温带大陆性季风气候,年平均气温在-5℃~5℃,≥10℃积温在1 800~2 800℃,年降水量400~650 mm,无霜期100~150 d,大部分地区初霜冻在9 月下旬出现,终霜冻在4 月下旬至5 月上旬结束,无霜期多为110 d左右。
本试验分别在第Ⅲ积温带和第Ⅵ积温带设置试验点(见图1),试验点具体位置和立地特征如下:试验点1:大兴安岭呼玛北园区中心苗圃(51°43′35″N,126°36′59E),开荒耕地、森林暗棕壤,面积7 亩;试验点2:大兴安岭呼玛三卡乡(51°06′20″N,126°52′35″E),试验地形为林缘坡地,面积15 亩,沙壤土;试验点3:拜泉县国富镇中药材种植示范基地(47°37′43″N,126°21′14″E),试验地形为丘陵坡地(耕地),黑钙土,面积30亩。
2 材料与方法
2.1 试验材料
膜荚黄芪(Astragalus membranaceus)和蒙古黄芪(Astragalus membranaceusvar.mongolicus),种子购于内蒙古赤峰。采用大田起垄直播种植,垄间距为60 cm;试验点1(简称“北园区”)、试验点2(简称“三卡”)、试验点3(简称“拜泉”)分别于2017年5月25日、5月27日和5月21日播种。
2.2 样品采集与制备
9 月中旬分别从3 个试验点调查、取样,蒙古黄芪和膜荚黄芪分开采集,在每个品种的试验区内随机布设20个样方(1 m×1 m),在每一个样方内选择3 株标准植株进行测量,测量指标包括株高、地径、根长、根粗、地上鲜重/地下鲜重(A/U 值);同时,采集根系带回实验室低温烘干(60℃)至恒重后、粉碎,低温保存,待成分(毛蕊异黄酮苷、刺芒柄花苷、毛蕊异黄酮、多糖)测定。
根系形态结构发育观测自出苗开始30、45、60、110 d 分别进行取样,根据植株长势,选择具有代表性的植株采集根部、洗净后,截取主根中上部根段用FAA固定,带回做半薄切片。
2.3 测定方法
表观生长量测定:黄芪株高、地径、根长、根粗(距主根上端1 cm,10 cm 处直径粗度,分别记为R0,R1)用卷尺和游标卡尺测量;根系形态利用根形指数(Root shape coefficient,RS1)表示,计算如下:
式中:RS1 为根形指数平均值,i表示第i株黄芪样品,Ri0为第i株根系上端径粗,Ri1第i株根系中端径粗,n表示样本数量。
根系结构观测:利用GMA半薄切片法[13~14]。
药效成分指标:黄芪多糖采用硫酸—苯酚比色法;毛蕊异黄酮苷、刺芒柄花苷、毛蕊异黄酮用高效液相色谱法测量[15~19]。
2.4 数据处理
用SPSS(16.0)对数据进行单因素方差分析(One-Way ANOVA),数据分析前进行正态性检验(Shapiro-Wilk test),未符合正态性分布的数据进行了对数转化后符合正态性再进行分析,借助photoshop7.0 图版排列、Excel 软件制表,数据为平均值±标准差(Mean±SD)。
3 结果与分析
3.1 蒙古黄芪与膜荚黄芪根系结构发育差异性
蒙古黄芪与膜荚黄芪播种60 d 之内根系结构无明显的差异,其中播种约30 d 时,根表皮及大部分皮层细胞已经脱落(见图2A,箭头所示),根表通常仅残留1 层细胞。中柱鞘细胞分裂形成由3~5 层细胞组成的周皮(见图2A)。周皮内侧由薄壁细胞和壁较薄的纤维组成。原靠近周皮的部分薄壁细胞破裂形成空隙(见图2B,箭头所示)。再向内依次为韧皮部、形成层和木质部。木质部中央除了导管和薄壁细胞外,还存在很多较细的纤维(见图2C)。播种45 d 时,根韧皮束间的薄壁细胞随着根直径的增大而撕裂,形成与韧皮束相间排列的较大空隙(见图2D),韧皮部厚度及木质部直径约为播种30 d 时的2 倍。韧皮部周围薄壁细胞无淀粉或产生少量淀粉(见图2D)。木质部中导管完全由纤维包裹,并与木射线呈辐射状相间排列(见图2E)。根部中央偶有撕裂形成空隙(见图2F,箭头所示)。
播种60 d 后,黄芪根的周皮已增厚至5~6 层细胞厚(见图3A),韧皮束外纤维已较为发达,此时韧皮射线和木射线中的多数薄壁细胞中已有淀粉开始积累(见图3B)。此后,蒙古黄芪和膜荚黄芪在细胞内含物方面逐渐出现明显的差异(见图3C)。待播种110 d 左右后,可以看到蒙古黄芪的木射线和韧皮射线薄壁细胞几乎完全被淀粉粒填满(见图3D)。膜荚黄芪韧皮射线中淀粉量情况与蒙古黄芪相似,但木射线薄壁细胞却并未被淀粉粒填满(见图3E,箭头所示)。而除了淀粉量多少外,蒙古黄芪与膜荚黄芪最大的不同即其木质部束、韧皮部束与射线的宽度比(见图3F)明显要小于相同培养环境下的膜荚黄芪(见图3G)。
3.2 蒙古黄芪与膜荚黄芪根系药用成分差异性
蒙古黄芪与膜荚黄芪除了毛蕊异黄酮含量无显著差异外(P>0.05),毛蕊异黄酮葡萄糖苷、刺芒柄花苷、多糖含量方面蒙古黄芪均显著高于膜荚黄芪(P<0.05),其中,毛蕊异黄酮葡萄糖苷、刺芒柄花苷和多糖含量蒙古黄芪分别是膜荚黄芪的1.8倍、1.6倍、1.3倍(见图5)。
3.3 蒙古黄芪与膜荚黄芪根系形态差异性
在田间调查中,凡是出现分叉根或测根较多且主根不明显的均记为“分叉根”,相对于直根而言,分叉根被视为畸变根进行数据统计。采样观测结果显示,膜荚黄芪根系畸变率远高于蒙古黄芪,前者畸变率高达70%(见图6a),后者畸变率为53.1%(见图6b)。
黄芪根系直径在分叉或侧根增多后,其主根直径粗度会随之变小。对于1年生黄芪,根形指数(RS1)可以很好地反映根系形状。膜荚黄芪和蒙古黄芪直根的根形指数分别为0.798、0.764,95%置信区间分别为0.77~0.82、0.74~0.79;而分叉根的根形指数均值分别为0.589 和0.614,置信区间分别为0.56~0.61、0.59~0.64;可见,根形指数大于0.75多为直根,而小于0.6多为分叉根或爪根(见图6c)。总体上,蒙古黄芪和膜荚黄芪无论直根和爪根在根形系数上均表现为差异不显著,主要差异在于蒙古黄芪根形系数变化区间要高于膜荚黄芪,这可能与蒙古黄芪根系畸变率低于膜荚黄芪有关。
3.4 蒙古黄芪与膜荚黄芪表观生长量差异性
从表观生长量差异分析可知(见表1),膜荚黄芪在株高、根长、地径、A/U值方面与蒙古黄芪有显著性差异(P<0.05),而根粗(R0、R1)方面则二者差异不显著(P>0.05)。根长方面膜荚黄芪显著低于蒙古黄芪,前者是后者的0.78~0.88 倍,而株高、地径、A/U 值方面膜荚黄芪则显著高于蒙古黄芪(P<0.05),且前者分别是后者的1.14~1.22 倍、1.13~1.46 倍、1.21~1.80 倍。可见,在膜荚黄芪植株生长状况要较蒙古黄芪旺盛,尤其是地上植株生长量及物质分配比例膜荚黄芪显著高于蒙古黄芪。
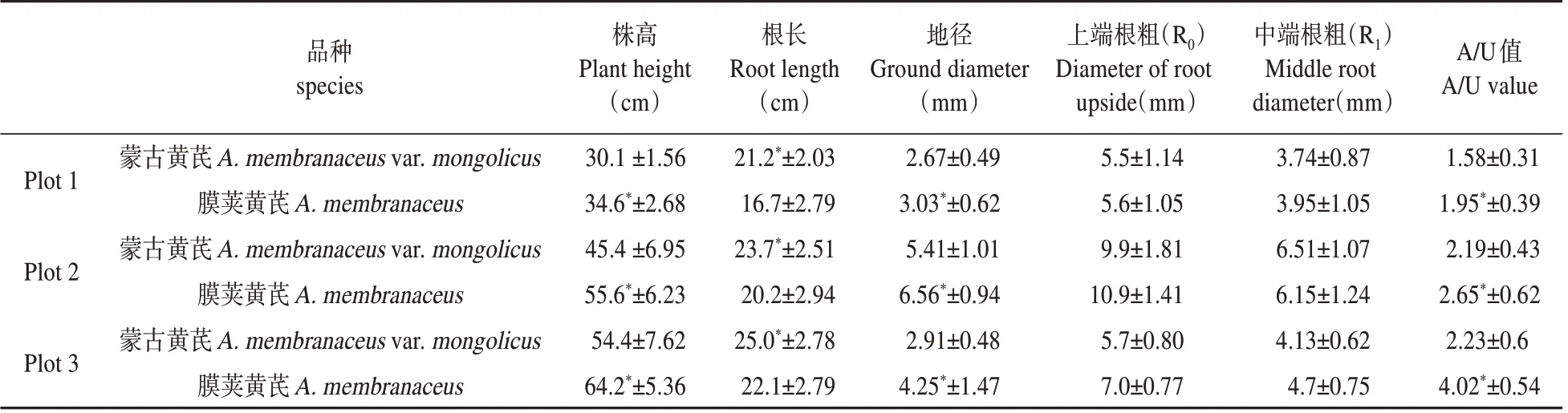
表1 蒙古黄芪与膜荚黄芪生长差异性分析Table1 Analysis of growth difference between A.mongolicus and A.membranaceus
4 讨论
根系形态解剖可以很好地反映根系发育变化和分析种间特性差异。试验结果表明,蒙古黄芪和膜荚黄芪在前期发育阶段(60 d),根系结构发育并未表现出明显的差异,但其发育速度很快。在播种30 d 时,根已进入次生生长阶段,表皮及大部分皮层细胞已经脱落,中柱鞘细胞恢复分裂能力,形成由3~5 层细胞组成的周皮;播种45 d 时,韧皮部厚度及木质部直径约为播种30 d 时的2 倍。此结果与王尔彤[7]和燕玲等[20]解剖观测发现基本相一致。随着根系生长,木质部束、韧皮部束及射线的形成,韧皮射线和木射线中的多数薄壁细胞中已有淀粉开始积累,自此蒙古黄芪和膜荚黄芪在细胞内含物方面逐渐出现明显的差异,待播种110 d 左右后,蒙古黄芪的淀粉含量要明显高于膜荚黄芪。可见,蒙古黄芪和膜荚黄芪根系特征差异自生长中后期开始逐渐体现,且主要表现在细胞内含物数量方面。此外,由于黄芪侧根原基起源于中柱鞘细胞,为典型的内起源方式,在次生生长过程,侧根在主根上发生的位置及其数目不确定[7],而侧根的发生直接影响着根系形态,试验中蒙古黄芪根系在发育后期畸变率要显著低于膜荚黄芪,这可能与物种的遗传特性相关。
蒙古黄芪和膜荚黄芪亲源关系相近[21],试验表明在北方地区均可进行人工种植,但生物学性状却相差较大。北方地区膜荚黄芪地上植株生长要明显大于蒙古黄芪,主要表现在株高、地径以及地上生物量分配方面。膜荚黄芪株高显著高于蒙古黄芪,茎干粗壮挺实,地上部分生物量积累较大,这可能与两个种的生物学特性差异有关[10,20],膜荚黄芪叶大、枝干硬实粗壮更有利于获取地上空间资源、更有利于光合作用,从而可以较多地积累碳水化合物。不过从地下部分生长发育、物质分配量来看,蒙古黄芪反而呈现明显的优势,主要表现在根系内含物的变化、根形态变化、地下生物量分配比例及根系功能性成分含量方面。
根系药用成分方面,毛蕊异黄酮葡萄糖苷、刺芒柄花苷和多糖含量蒙古黄芪分别是膜荚黄芪的1.8倍、1.6倍、1.3倍;物质分配比例数据显示,膜荚黄芪地上/地下生物量分配比例要远高于蒙古黄芪,可见,蒙古黄芪虽然地上部分生物量积累弱于膜荚黄芪,但地下根系的物质积累量和经济性状要明显好于膜荚黄芪。因此,建议北方高寒地区黄芪种植的品种选择应根据实际生产需要。
