基于细胞集群效应的高浓度燃料乙醇发酵研究
2021-03-02刘庆国
汪 虎,刘庆国,陈 勇*,李 义
(1.安徽省宿州中粮生物化学有限公司,安徽 宿州234000;2.南京高新工大生物技术研究院有限公司,江苏 南京210032;3.吉林中粮生化有限公司,吉林 长春 130033)
乙醇作为一种特殊的化学品被广泛应用于化工、食品及医疗行业,也被用作于燃料添加剂和汽油增强剂[1],甚至被视为未来的能源替代品。目前燃料乙醇主要依赖于生物发酵法生产,然而传统生物发酵法存在天然缺陷,如机械性损伤及不适的液体环境导致的酵母细胞生长稳定性和耐受性较差、易发生显著的细胞衰亡和自溶现象以及时空效率低等[2,3]。另外,大接种量发酵导致碳源流向菌体生长代谢,降低了淀粉糖利用效果,从而表现为较低的糖醇转化率。生物发酵的低时空效率和低产物得率使得燃料乙醇发酵技术的成熟度偏低,生产成本偏高[4]。
与传统游离细胞发酵相比,固定化酵母细胞发酵具有许多优势,如细胞浓度高、对产物抗性强、催化剂重复使用等[5-6]。酵母细胞固定化主要有两种方法:吸附法和包埋法。包埋载体一般会存在载体降解和传质受限的问题,如琼脂、凝胶、卡拉胶和海藻酸钙等。吸收材料是一种简单廉价的固定化细胞的载体,传质效果明显优于包埋材料[7],如高粱甘蔗渣[8]、硅藻土[9]、玉米秸秆[10]、多孔陶瓷[11]、海绵[12]和蚕茧[7]等。然而这些载体多存在发酵空间利用率低、生物抗降解性能差以及对原料来源要求高等缺陷。
本研究首次以改良纤维为吸附载体,进行高浓度产物耐受性试验,并以陈化粮(水稻)为原料,进行高浓度燃料乙醇发酵研究,为乙醇高浓度工业化生产应用提供参考。
1 材料及方法
1.1 菌种
安琪耐高温酿酒酵母。
1.2 培养基及培养条件
1.2.1 培养基 活化培养基:麦芽汁固体培养基(麦芽250 g/L磨碎过滤,加琼脂20 g/L,121 ℃灭菌20 min,备用)。
种子培养基:酵母膏10 g/L、蛋白胨20 g/L、葡萄糖20 g/L、磷酸二氢钾1.5 g/L、硫酸铵4 g/L、硫酸镁0.5 g/L;115 ℃灭菌15 min,备用。
发酵培养基:酵母膏3 g/L、蛋白胨4 g/L、葡萄糖20 g/L、磷酸二氢钾 3 g/L、硫酸铵 4 g/L、硫酸镁0.5 g/L、7水合硫酸亚铁0.05 g/L、7水合硫酸锌0.05 g/L;115 ℃灭菌15 min,备用。
1.2.2 培养条件 (1)种子培养:挑取一环经麦芽汁活化的斜面种子于200 mL的种子液中,并置于温度30 ℃、转速150 r/min的摇床培养18 h。
(2)菌种扩大培养及固定:将装有6 g毛巾的500 mL的锥形瓶加入200 mL新鲜种子培养基,115 ℃灭菌15 min。冷却至室温后,量取10%(体积分数)的种子液加到锥形瓶中。再置于温度30 ℃、转速100 r/min的摇床上固定36 h。
(3)固定化细胞发酵:将固定结束后的废液倒出,加入含有不同葡萄糖浓度和乙醇浓度的新鲜发酵培养基,于温度33 ℃、转速100 r/min的摇床上培养若干时间。该实验为破坏性实验,每个时间点设3个平行摇瓶,每隔3 h取一次样,共取9次。
(4)游离细胞发酵:向500 mL的锥形瓶加入200 mL新鲜种子培养基,115 ℃灭菌15 min。冷却至室温后,量取10%(体积分数)的种子液加到锥形瓶中。再置于温度33 ℃、转速100 r/min的摇床培养,培养时间与固定化细胞扩大及固定阶段的时间相同;再以4000 r/min,离心5 min。离心后的酵母重新溶在200 mL的含有不同乙醇浓度的新鲜培养基中。每个乙醇浓度做3个平行摇瓶,每隔3 h取一次样,共取9次。
(5)水稻发酵实验:固定化过程同耐受性试验过程。在正式发酵前,将种子培养基中的葡萄糖浓度替换成240 g/L(避免载体吸水稀释发酵过程中的乙醇浓度,对后面正式发酵产生影响),培养24 h。结束后进行正式发酵。发酵时,发酵培养基用水稻水解液替代。在单批发酵(游离和固定化)中,每个时间点设3个平行样,总共6个取样时间点,发酵时间48 h。在间歇式发酵过程中,发酵时间48 h下瓶取样分析,同时换液进行下一批发酵。以上发酵条件均为:转速150 r/min,温度34 ℃。
1.3 分析方法
OD测定:将游离酵母稀释一定倍数,通过可见分光光度计,在波长为660 nm的条件下检测;固定化酵母通过震荡从纤维床上解离下来,然后用上述方法测得OD值。细胞浓度与OD的标曲:1 OD=0.81 g DCW/L=1×107个/mL。
糖测定:葡萄糖测定用生物传感分析仪SBA。还原糖:采用DNS法[4]。总糖含量的测定:取适量的样品加入50 mL离心管中,然后加入5 mL浓硫酸和5 mL纯水,沸水浴10 min,使总糖完全水解。置于冰水中冷却后,加一滴酚酞指示剂,用6 mol/L的NaOH中和至微红色,最后定容至50 mL。之后按照上述DNS的测定方法测定水解后的还原糖的含量,即总糖含量。
酒度测定:取100 mL发酵液,加热蒸馏,定量到100 mL,用酒度计进行测量。
乙醇测定:采用气相色谱法,初始柱温70 ℃,升温速率20 ℃/min,终止温度为190 ℃;前进样口温度180 ℃,前检测器温度220 ℃;氢气流速30 mL/L,空气流速200 mL/L,氮气流速30 ml/L。
细胞数测定:采用血球计数法,取2.5 mL混匀样品放入100 mL容量瓶中,加1 mL次亚甲基蓝;定容、静置1 min,置于血球计数板上,用显微镜计量细胞个数,其中,死亡率=染色细胞数/总细胞数[4]。
酸度(酸碱滴定法)测定:于150 mL三角瓶中注入20 mL蒸馏水,加两滴酚酞指示剂,用0.1 mol/L氢氧化钠滴定至微红色,再吸取过滤醪液1 mL继续用0.1 mol/L氢氧化钠滴定至再次出现粉红色,在30 s内不消失为终点,第2次氢氧化钠滴定毫升数乘以10为酸度。
乙醇转化率/%=乙醇浓度/(总糖浓度×0.511)×100%。
扫描电镜(scanning electron microscope,SEM)观察:对纤维床固定化酵母先进行真空冷冻干燥,然后利用扫描电镜(model JSM-6010;JEOL Ltd.,Tokyo,Japan)观察细胞形态。游离细胞离心后加入3.5%的戊二醛,并在4 ℃下保存 15 h,用纯水洗2次。用初始浓度为20%、最终浓度为100%、梯度浓度为20%(体积分数)的乙醇进行脱水,再用六甲基二硅氮烷进一步处理[9],最后进行电镜扫描。
2 结果及分析
2.1 细胞耐受性分析
2.1.1 不同乙醇浓度对游离和固定化细胞培养的影响 游离和固定化细胞对不同乙醇压力下的响应如图1所示。当乙醇浓度在0~4%(体积分数)之间时,两者葡萄糖在3 h内均消耗彻底,糖消耗速率差别不明显;但固定化酵母细胞生长速率快于游离细胞,总细胞浓度显著高于后者。随乙醇浓度增加(8%~16%,体积分数),游离酵母细胞对葡萄糖的消耗速率逐渐下降。当乙醇浓度提高至16%(体积分数)时,游离细胞培养体系中葡萄糖消耗不完全,而固定化细胞体系虽然在后期葡萄糖转化速率有变慢现象,但不显著,且能消耗完全。固定化细胞生长速率和细胞浓度依然高于游离细胞水平。当乙醇浓度为16%(体积分数)时,两者菌体浓度在培养中后期都有明显的下降趋势,这可能是因为高乙醇浓度抑制和营养缺乏,使得酵母开始裂解。当初始乙醇浓度设定到20%(体积分数)时,游离细胞培养体系的葡萄糖几乎不被消耗,同时细胞浓度一直处于下降趋势,这说明菌体已趋于死亡;然而固定化细胞培养体系的葡萄糖呈下降趋势,虽于27 h时葡萄糖未被消耗彻底且菌体生长有明显的抑制现象,但依然能保持较高的酵母活性。结果表明,基于糖耗及菌体生长现象,固定化酵母细胞具有较强的乙醇耐受性,而且随着初始乙醇浓度的提高,两者的差距也越明显。

图1 乙醇对游离及固定化细胞培养的影响
2.1.2 细胞形态分析 图2为游离及固定化酵母细胞的扫描电镜图,其中图B、C、D显示了固定化细胞形成生物膜过程的3个时期:吸附、聚集、成膜。在固定化阶段,刚开始细胞成悬浮状态,只有少量细胞在静电、氢键和范德华等作用力下较弱地吸附在载体上(图2B);随着摇动培养,越来越多的细胞开始聚集(图2C);聚集的细胞形成细胞层,即所谓的生物膜。生物膜细胞靠自身产生一种透明的胶状物质,这种胶状物覆盖在生物膜之上,紧紧地将生物膜细胞结合在一起。不同于固定化细胞,游离细胞在电镜观察下都成分散状态。

A:游离;B:固定化酵母吸附过程;C:聚集过程;D:生物膜形成。
研究发现,生物膜能提供一种微环境,这种微环境有利于诱导抵抗有毒溶剂的基因表达。在本实验中,我们观察到载体上的细胞明显地被一层透明物质包埋,即胞外聚合物(extracellular polymeric substances,EPS)。这种EPS可能是由多糖、蛋白、核苷酸和磷脂等一种或多种物质组成[13]。当细胞处于高浓度条件下时,聚集的细胞之间通过信号传导,诱使与乙醇耐受性相关的基因表达,从而产生这种EPS。EPS覆盖在细胞表面,通过屏障作用抵抗乙醇的毒害,从而达到保护细胞的目的,同时也促进了细胞增长。当固定化的细胞从载体上释放出来时,因为生物膜被破坏而恢复成游离细胞的生理特性(图3)。这个现象也与文献报道的结果一致[14]。结果表明,固定化技术可以促进表面细胞形成生物膜,形成集群效应,从而提高对乙醇的耐受性。

F1:第1批的游离细胞培养;I1:第1批的固定化细胞培养;F2:第2批游离细胞培养;I2:第2批固定化细胞培养;R2:第2批释放出来的细胞培养。
2.2 高浓度乙醇发酵
2.2.1 单批发酵对比 由图4可知,相对于传统的燃料乙醇发酵,高浓度乙醇发酵具有明显的优势。首先,可以提高设备利用率。在产量相同的条件下,高浓度乙醇发酵所占发酵体积小,减少了对罐体的使用。其次,降低生产能耗。高浓度发酵中用水量较少,后期乙醇浓度高,降低了分离过程中蒸馏成本[15-16]。此外,高糖度产生的高乙醇浓度可以降低染菌概率,提高生产效率。
基于固定化细胞的集群效应,作者采用水稻液化醪进行高浓度乙醇发酵。如图4所示,在发酵初始阶段,相比于游离发酵,固定化发酵体系残总糖浓度下降较快。在游离发酵体系,残还原糖浓度有一个明显上升的过程,且残还原糖水平偏高,说明相比于固定化发酵,游离发酵前期耗糖速率较慢,且明显滞后于糖化速率。同时,在固定化发酵体系,乙醇产量相应上升较高。但整个过程,固定化体系中游离细胞浓度上升缓慢,总体浓度不高。发酵至终点时,游离发酵残糖总糖2.97 g/100 mL,残还原糖1.72 g/100 mL,酒度14.1%(体积分数);而固定化发酵残总糖1.58 g/100 mL,残还原糖0.20 g/100 mL,酒度15.2%(体积分数)。另外,从图5可以明显观察到,在固定化发酵体系中,游离酵母形态几乎呈圆形,且被染色的数量较少;而在游离发酵体系中,酵母形态呈拉长的椭圆形,死亡量较多;而且在发酵终点时,固定化发酵体系的游离细胞死亡率在30%左右,远远低于游离发酵体系(>78%),说明固定化发酵体系的细胞抗衰老能力明显增强。以上结果表明,固定化细胞具有较高的群体抗逆性,使得发酵能力显著高于游离发酵,这与我们之前的研究结果[17-18]较为一致。

A:15%种子的游离细胞发酵;B:固定化细胞发酵。
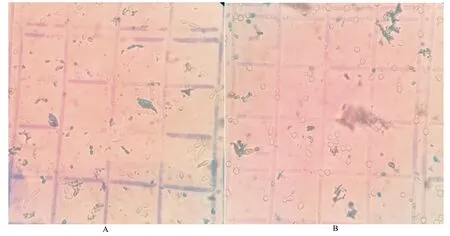
图5 发酵40 h,游离(A)和固定化细胞发酵(B)体系中游离细胞的形态
2.2.2 间歇式发酵的稳定性 为了评估间歇式发酵在高浓度条件下的稳定性,进行了9个批次的间隙式发酵。如表1所示,固定化发酵每批游离酵母数较为稳定,在0.7~1.0之间波动。残总糖和还原糖分别在1.74、0.25 g/100 mL左右,变化不显著。平均乙醇浓度为122.71 g/L,平均酒度达15.18%(体积分数);总糖平均转化率为93.47%。这些结果说明,以水稻液化液为发酵原料进行固定化酵母高浓度乙醇发酵的体系是稳定的,其发酵方式也是可行的。

表1 单批和间隙式发酵结果对比
3 结论
分析了游离和固定化酵母基于糖耗及菌体生长方面的抗乙醇特性,结果发现固定化酵母表现出较强的乙醇耐受性。游离酵母在乙醇浓度为16%(体积分数)时出现严重的抑制现象,而固定化酵母即使在20%(体积分数)的高乙醇浓度下依然可以进行代谢活动。
固定化技术可以促进表面细胞形成生物膜,形成集群效应,提高了对环境的抗逆性,增强了发酵能力。与传统游离发酵相比,固定化细胞发酵体系反应速率明显加快,且残总糖水平和细胞水平明显低于前者,从而表现为较高的乙醇转化率。
在间歇式发酵中,固定化发酵批次之间较为稳定,残总糖水平为1.74 g/100 mL,乙醇浓度为15.18%(体积分数),转化率达93.47%,比游离发酵高5.1个百分点,结果说明,以水稻液化液为发酵原料进行固定化酵母高浓度乙醇发酵具有可行性。
