银耳白霉病病原菌的分离鉴定及其生物学特性
2021-03-02袁宗胜严俊杰黄珊珊谢宝贵
刘 芳,袁宗胜,严俊杰,黄珊珊,谢宝贵*
(1.福建农林大学 菌物研究中心,福建 福州 350002;2.闽江学院 海洋研究院,福建 福州 350108)
银耳(TremellafuciformisBerk),又称白木耳、雪耳,其在真菌的分类学地位中归属于担子菌门、伞形亚门、银耳纲、银耳目、银耳科、银耳属[1,2]。银耳富含胶质、膳食纤维和钙,可降低血液和肝脏中的胆固醇,有助于体内废物排除、肝脏解毒[3,4]。在银耳蛋白质中富含17种氨基酸,这些氨基酸和酸性异多糖、有机磷、有机铁等化合物能增强人体的免疫能力[5-8]。
新鲜的银耳子实体颜色是洁白色或乳白色的,有许多薄而波卷状褶的瓣片,丛集成牡丹花状,瓣片不分叉或在顶部分叉,表面光滑,富有弹性,直径8~16 cm[9]。从广义上来说,银耳菌丝包括银耳纯菌丝(纯白菌丝,俗称白毛团,属担子菌)和香灰菌丝(羽毛状菌丝,属子囊菌)[10]。由于银耳纯菌丝和香灰菌丝在生态条件上存在差异性,再加上银耳菌丝体本身具有生理特殊性[11],所以在银耳制种上以及在银耳生长发育过程中很容易发生病害。
2017年我们在福建省三明市尤溪县银耳生产菇房内发现了白霉菌感染的病害,该病害发展迅速,在发现该病害的菇房内约有10%的银耳受到了白霉菌的影响,并且发病后的银耳已不适合食用,该病害的发生对银耳生产造成了极其严重的经济损失(此前尚未见相关文献报道),为此本文对其病原菌进行了分离鉴定,并分析了其生物学特性,旨在为后续病害防控提供理论依据。
1 材料与方法
1.1 培养基与主要试剂
病原真菌的分离培养采用PDA培养基,其配方为:新鲜马铃薯200 g、葡萄糖20 g、琼脂20 g、水1000 mL。PDB培养基配方:新鲜马铃薯200 g、葡萄糖20 g、水1000 mL。
病原真菌DNA提取和ITS片段扩增所用的引物、Marker、dNTPs、Buffer、溶菌酶等试剂为生工生物工程(上海)股份有限公司产品, 其余试剂均为国产分析纯。
1.2 病原菌的分离纯化
在无菌条件下,将受感染的银耳子实体发病部位切下一个小组织块,接种于添加1倍氨苄的PDA抗性平板上,用封口膜封口后正置于25 ℃的恒温培养箱中进行培养。在培养5~6 d后,在PDA抗性平板上观察到生长受限和不规则边缘的小型乳白色真菌菌落,在长出菌落后进行单孢分离纯化,直到分离出纯培养物。
1.3 病原菌的致病性测定
从纯化的平板上挑取一小块菌丝,将其转移到PDB培养基中,置于150 r/min的摇床上30 ℃恒温培养10 d。然后用过滤法将菌丝体与PDB分离,用滤液制成孢子悬浮液(1×107conidia/mL)。用浓度为1×107conidia/mL的孢子悬浮液喷洒于正常生长的银耳子实体上,以喷洒无菌蒸馏水为对照,确保供试的银耳菌体的每一个子实体都被喷上孢子悬浮液。银耳子实体培养室的温度控制在23 ℃,相对湿度控制在95%。
在参加病原物致病性实验的银耳子实体产生病害现象后,按照1.2中的方法重新分离病原菌,同样以无菌水喷洒健康银耳子实体为对照。观察所产生的症状,以确定是否为同一病原菌。
1.4 病原菌形态观察与ITS序列鉴定
1.4.1 病原菌形态观察 平板观察:将得到的纯化培养物在PDA平板上25 ℃恒温培养15 d左右,观察PDA平板上病原菌菌丝的生长发育情况。
显微镜观察:在洁净的载玻片上滴加10 μL的蒸馏水,用解剖针挑取在PDA平板上25 ℃恒温培养15 d左右的病原菌单个菌落到载玻片上,盖上盖玻片并滴加棉兰染色液,吸去多余的染色液;在静置染色1 min后用普通光学显微镜进行观察。另外还通过扫描电子显微镜进行观察。
1.4.2 病原菌rDNA ITS序列的测定与分析 采用CTAB法提取病原菌的DNA,并对提取的DNA进行下一步的PCR扩增,PCR扩增选用的引物是真菌通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′);将PCR扩增得到的产物经过质量分数为1%的琼脂糖凝胶电泳检测后,送至生工生物工程(上海)股份有限公司进行专业测序。将测序结果在GenBank(NCBI, http://www.ncbi.nlm.gov)中进行BLAST同源性分析。用MEGA 5.0软件采用最大似然法(maximum likelihood)构建系统发育树,Bootstrap检验的重复次数为1000次。
1.5 病原菌生物学特性的测定
1.5.1 温度对病原菌菌丝体生长的影响 将病原菌在PDA平板上培养12 d,然后用直径为6 mm的打孔器打取菌落圆片,用接种针将菌落圆片接种至PDA平板中心,置于不同温度下恒温培养,温度设置35、30、25、20、15、10、5 ℃共7个处理,每个处理3次重复,定期观察菌落的生长情况,测量菌落直径,计算菌丝体的生长速度。
1.5.2 pH值对病原菌菌丝体生长的影响 在无菌条件下,将融化好的PDA培养基用1 mol/L的NaOH和1 mol/L的HCl调节pH值,pH值设置10.0、9.5、9.0、8.5、8.0、7.5、7.0、6.5、6.0、5.5、5.0、4.5共12个处理。用接种针将病原菌菌落圆片接种到不同pH值的PDA平板中心,置于25 ℃下恒温培养,每个处理3次重复。定期观察平板上的菌落生长情况,测量菌落直径,计算菌丝体的生长速度。
1.5.3 碳源对病原菌菌丝体生长的影响 以葡萄糖为碳源的基础培养基为对照组,采用蔗糖、麦芽糖、淀粉作为碳源来替代葡萄糖作为处理组。用接种针将病原菌菌落圆片接种到以上不同碳源的PDA平板中心,置于25 ℃下恒温培养,每个处理3次重复。定期观察平板上的菌落生长情况,测量菌落直径,计算菌丝体的生长速度。
1.5.4 氮源对病原菌菌丝体生长的影响 以蛋白胨为氮源的基础培养基为对照组,分别用酵母粉、硫酸铵、尿素、硝酸钠来代替蛋白胨作为处理组。用接种针将病原菌菌落圆片接种到以上不同氮源的PDA平板中心,置于25 ℃下恒温培养,每个处理3次重复。定期观察平板上的菌落生长情况,测量菌落直径,计算菌丝体的生长速度。
2 结果与分析
2.1 病原菌的分离纯化与致病性
银耳白霉病在发病初期出现针状小白点,与银耳耳片颜色相近,不易被肉眼察觉。随着菇房内温度和湿度的逐渐升高,这些白色的针状小点迅速生长成为肉眼可见的白色真菌物质,扩散成一层白色绒毛状的真菌物质,覆盖在银耳耳片的表面(图1B)。随着病害的进一步发展,整个银耳子实体腐烂,耳片胶化,整朵银耳腐坏变成浅黄色的胶状物质。病原菌在25 ℃的恒温培养箱中培养5~6 d后,在PDA抗性平板上生长至一定程度后不再扩散,并形成不规则边缘的小型乳白色真菌菌落;在长出菌落后进行单孢分离纯化,直到分离出纯培养物。
在供试银耳子实体上喷洒孢子悬浮液1 d后,在每个子实体的表面观察到白色真菌菌落(图1C、图1D);在继续培养后会产生浅黄色胶状物质(图1E);所产生的症状与原始样本中发现的症状完全一样,而对照组则无症状。从接种发病病斑上再次分离的病原菌与接种病原菌相同,证明所接病原菌为银耳白霉病的致病菌。

A:正常银耳子实体。B:发病银耳子实体。C:回接1 d后的银耳耳片。D:回接后的整个银耳子实体。E:回接发病最后的银耳子实体。
2.2 病原菌的形态观察与鉴定
2.2.1 病原菌平板观察 病原菌在PDA平板上25 ℃恒温培养15 d左右,观察发现菌丝为纯白色,菌丝之间通过相互交叉分支进行生长,逐渐生长成为肉眼可见的菌落并产生分生孢子。该病原菌是通过掷孢子进行生长繁殖的(图2A)。
2.2.2 显微镜观察 普通光学显微镜观察结果表明,病原菌菌丝细,有分支,无隔膜的菌丝宽度约为2.5 μm;在菌丝尖端或周围有许多分生孢子,分生孢子的长度约为10 μm,宽度约为5 μm,呈现一个弯弯月亮的形态。该病原菌的分生孢子着生方式为顶端着生,在孢子成熟后直接掉落在菌丝周围或者以掷孢子进行扩散生长(图2B)。
扫描电镜显微观察结果(图2C)显示:孢子的着生方式为顶端着生;未成熟将要掉落的孢子没有明显的弯月亮形状;成熟的孢子与菌丝之间的连接梗越来越细,直到孢子成熟后掷出去。
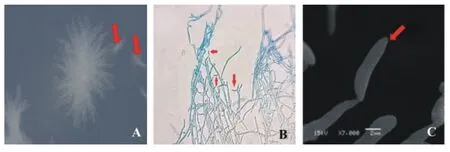
A:在PDA培养基表面的掷孢子菌落。B:普通光学显微镜400倍下顶端着生的分生孢子。C:扫描电子显微镜7000倍下的分生孢子。
2.3 病原菌rDNA ITS序列的分析
对经过PCR扩增和琼脂糖凝胶电泳检测的ITS片段的测序结果进行分析,显示该病原菌的rDNA ITS片段长度为1184 bp。将该序列提交给NCBI基因库,所得到的登录号为MG806985。在NCBI上进行BLAST同源性分析,结果表明,该病原菌与Melanotaeniumendogenum和Melanotaeniumcingens的序列重复性为49%,最为接近。通过建立系统发育树(图3),发现该病原菌与Melanotaeniumendogenum在同一个分支上,确定该病原菌属于黑粉菌属(Melanotaenium)。

括号中的序号表示菌株的GenBank登录号;各分支点显示的数字代表通过1000次重复运算得到的置信值。
2.4 病原菌的生物学特性
2.4.1 温度对菌丝体生长的影响 病原菌菌丝平均生长速度计算结果(图4)表明,该病原菌在不同的温度条件下菌丝生长速度存在很明显的差异。该病原菌在15~30 ℃的PDA平板上均可以生长;当培养温度为25 ℃时菌丝生长速度最快,达3.18 mm/d,远远高于在其它温度下的生长速度;当温度低于15 ℃或者超过35 ℃时菌丝停止生长。因此,确定该病原物菌丝生长的最适温度为25 ℃。
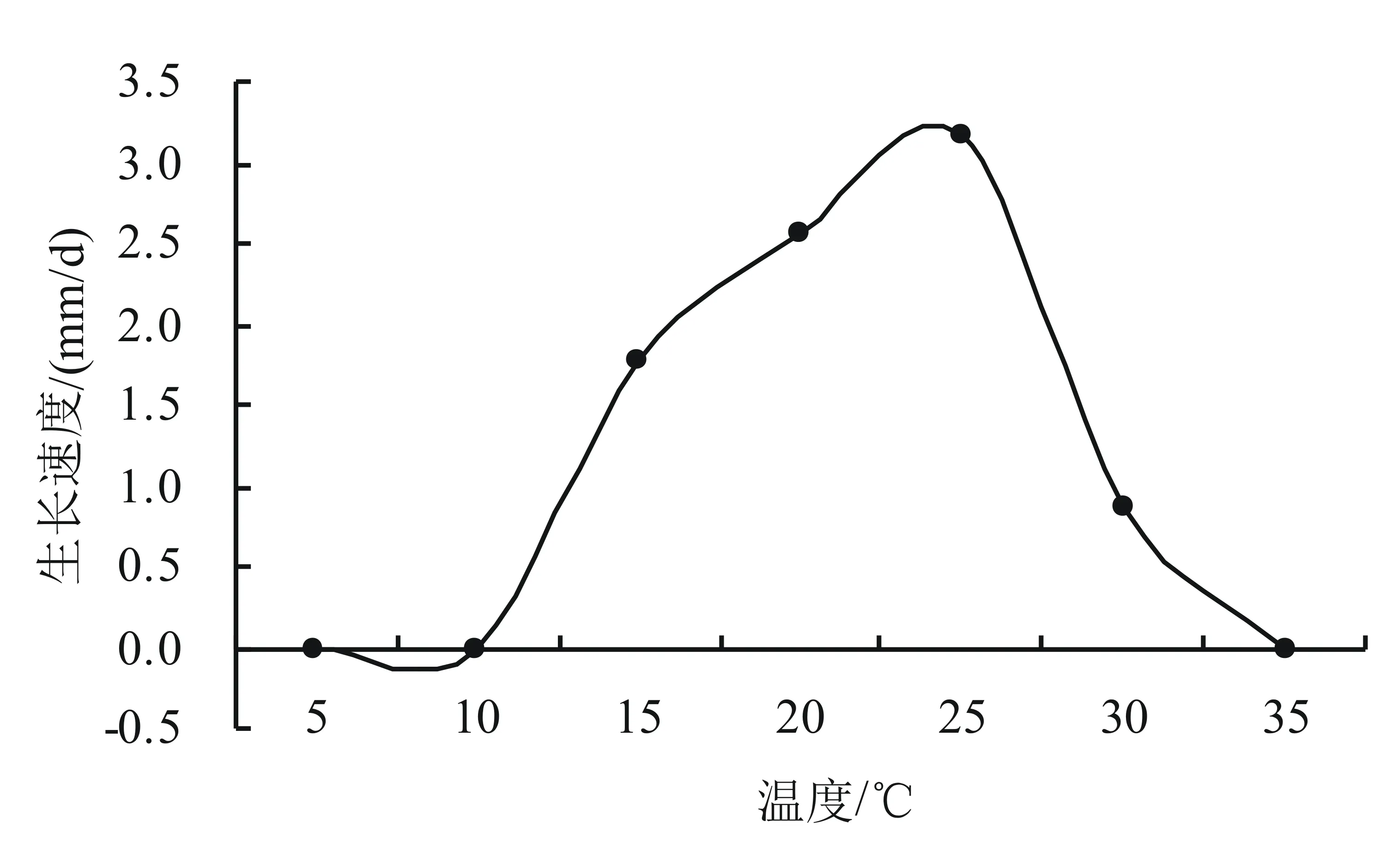
图4 温度对菌丝体生长的影响
2.4.2 pH值对菌丝体生长的影响 病原菌菌丝平均生长速度计算结果(图5)表明,该病原菌在所设定的12个pH值下均可以生长,其中生长速度最快即最适的pH值为4.5。另外,病菌菌丝体在偏酸性和偏碱性的条件下均生长良好,并且酸性越大和碱性越大菌丝生长越好,说明该病原菌的菌丝生长对pH的要求呈现两极化。
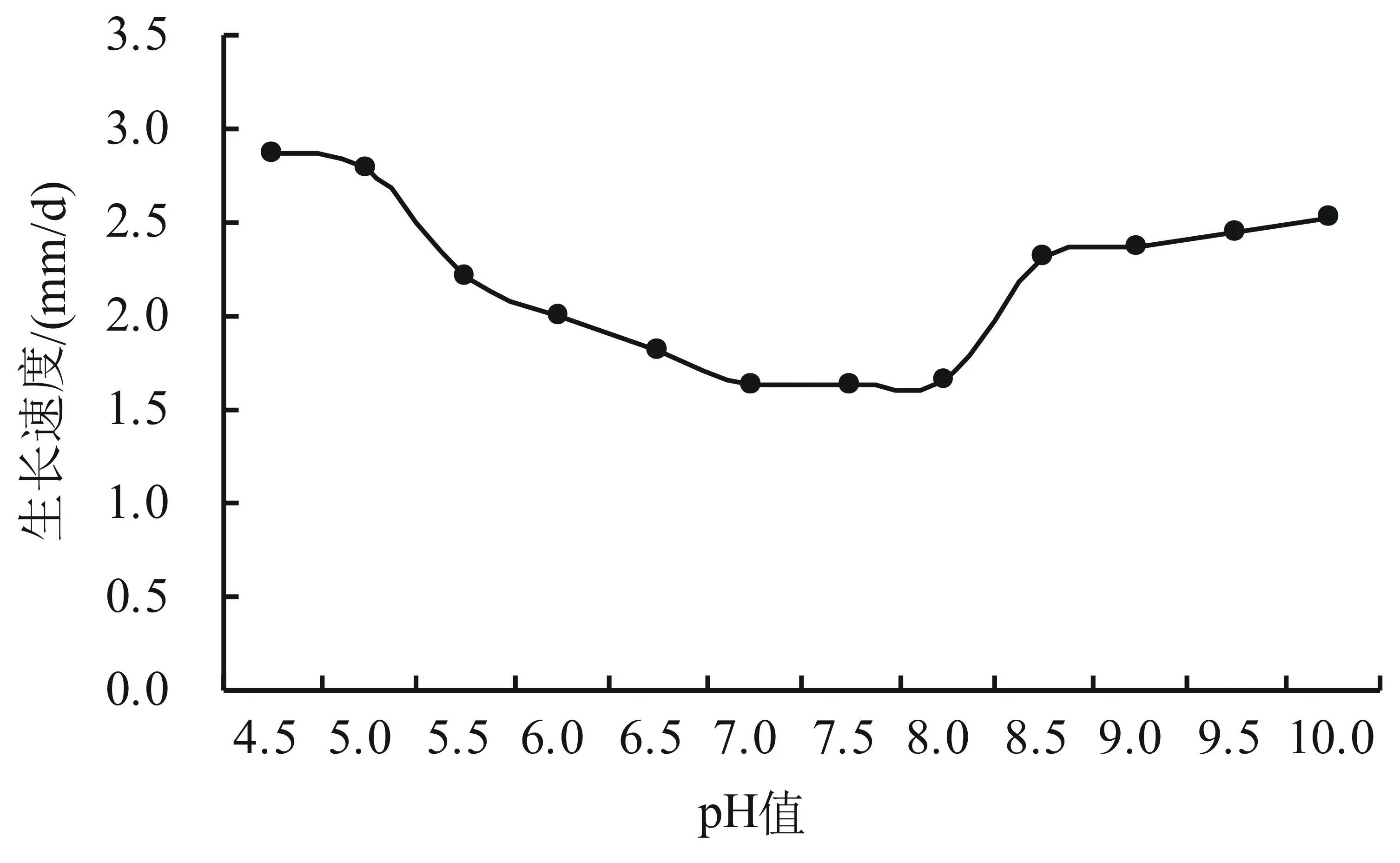
图5 pH值对菌丝体生长的影响
2.4.3 碳源对菌丝体生长的影响 图6的结果表明,该病原菌对葡萄糖、蔗糖、麦芽糖、淀粉4种碳源均能加以利用,其中对淀粉的利用率最高,其次是葡萄糖,而对麦芽糖和蔗糖的利用率较低。

图6 碳源对菌丝体生长的影响
2.4.4 氮源对菌丝体生长的影响 病原菌菌丝平均生长速度计算结果表明,该病原菌对蛋白胨、酵母粉、硫酸铵、尿素、硝酸钠5种氮源均可加以利用,其中对硝酸钠的利用率最高,其次是蛋白胨和尿素,而对酵母粉和硫酸钠的利用率较低(图7)。

图7 氮源对菌丝体生长的影响
3 结论与讨论
本研究结果表明:银耳白霉病的病原菌属于黑粉菌属(Melanotaenium),该病原菌与Melanotaeniumendogenum和Melanotaeniumcingens的序列重复性仅为49%,说明该病原菌极有可能为一个新的物种;该病原物菌丝生长的最适温度为25 ℃,这与寄主银耳菌丝的最适生长温度(22~25 ℃)及子实体的最适生长温度(20~25 ℃)吻合,故不能通过温度控制来抑制该病害的发生;该病原菌对酸碱度的适应能力很强,在pH 4.5~10.0范围内均能生长良好,但菌丝生长的最适pH值为4.5;该病原菌对多种氮源、碳源均可吸收利用,是一种生长能力很强的真菌。
银耳病害的发生是由多种因素决定的,除病原菌外,环境条件和寄主也极为重要[12]。每种病原菌均有一定的寄主范围,只能侵染某种或几种食用菌;即使对于同一种食用菌,不同品种、品系或个体在发病程度上也有一定的差距。该病原菌对其它的食用菌会不会造成同样的危害,以及该病害的致病机制等还有待进一步研究。
