1,25(OH)2D3对关节滑膜蛋白聚糖-4基因表达及分泌的影响
2021-03-02王志强关超玲李贤慧
王志强,关超玲,朱 辉,李贤慧
骨性关节炎(Osteoarthritis,OA)是中老年常见的关节疾病,而且目前国内外尚缺乏疗效确切的药物[1]。骨性关节炎病程进展非常缓慢,在核磁共振或X线放射照相能检出半月板或关节软骨损伤之前,病理损伤仅仅是韧带退化、滑膜炎等早期症状[2]。这种缓慢退化时间可长达4年以上[3],这是非常重要的预防保健窗口期,如能采取有效措施或许可以恢复健康[4]。研究表明骨性关节炎最早的病理改变是关节液中重要润滑分子透明质酸和蛋白聚糖-4分泌减少,但分泌减少的原因目前尚不清楚[5]。笔者前期研究表明1,25(OH)2D3对关节滑膜的分泌功能有调节作用,能促进透明质酸的分泌[6]。蛋白聚糖4(proteoglycan 4, PRG4)和透明质酸均是关节滑液中的重要分子,对保持关节滑液的边界润滑功能起决定作用。本研究旨在探讨1,25(OH)2D3对关节滑膜PRG4基因表达及分泌的影响。
1 材料与方法
1.1 主要仪器试剂 EL311SX 酶联免疫检测仪;7700型定量PCR仪,美国ABI公司;兔蛋白聚糖-4 ELISA试剂盒为美国Abcam公司产品;1,25(OH)2D3为Sigma公司产品;TrizolTM试剂为Invitrogen公司产品。
1.2 兔膝关节滑膜组织分离培养 健康7月龄新西兰大白兔,体重(3.3±0.2)kg,常规技术取滑膜,放入6孔培养板中培养。
1.3 1,25(OH)2D3对关节滑膜PRG4基因表达和滑膜分泌PRG4影响的时间谱分析 根据笔者前期获得的实验数据,选择1,25-(OH)2D3终浓度为10 nM进行时间谱分析。新分离滑膜普通培养24 h后,滑膜培养液中加入1,25-(OH)2D3进行实验。滑膜PRG4基因表达量和滑膜分泌PRG4进入培养液的量可同时分析。按作用时间分为七组,分别为0 h(对照),12、24、36、48、60、72 h组。在指定时间分别收取滑膜培养液和滑膜。滑膜培养液直接进行ELISA实验,检测培养液中PRG4分泌量的变化。滑膜进行总RNA提取,后续进行 Real time-PCR分析PRG4基因表达量。
1.4 1,25(OH)2D3浓度对关节滑膜PRG4基因表达和滑膜分泌PRG4的影响分析 根据时间谱分析结果选择最佳时间,分析不同1,25-(OH)2D3作用浓度对关节滑膜PRG4基因表达和滑膜分泌PRG4的影响。按1,25(OH)2D3作用浓度分为六组:0 nM(对照),0.1、1、10、50、100 nM。在指定时间分别收取滑膜培养液和滑膜,滑膜培养液直接进行ELISA实验,检测培养液中PRG4分泌量的变化。滑膜进行总RNA提取,再进行Real time-PCR分析PRG4基因表达量。
1.5 Real time-PCR分析PRG4基因表达 利用Invitrogen公司的Trizol试剂按说明书步骤进行滑膜总RNA的提取。实验中所用离心管及移液器枪头均为Axygen无RNA酶产品。反转录反应合成cDNA,将2 μg总RNA与2 μl随机引物(0.5 g/L)混合,加DEPC水补足至终体积12.5 μl。70 ℃水浴变性5 min,然后立刻置冰上5 min;每管中再加入下列试剂:M-MLV 5×Reaction buffer 4 μl,dNTP(10 mM)2 μl,RNasin(40 U/μl)0.5 μl,M-MLV(200 U/μl)1 μl。混匀,瞬时离心,37 ℃反应1 h。70 ℃灭活5 min,离心1 min,保存于-70 ℃备用。
Realtime-PCR反应体系:PRG4基因引物序列,Forward 5′ CAGGCTTGGAAGATGGTGGT3′,Reverse 5′CTTTTTGGCTAGATTCGGCCC 3′,产物长度167 bp;内参基因GAPDH的引物序列,Forward 5′CCAGCCTCGTCCCGTAGACA 3′,Reverse 5′CCGTTGAATTTGCCGTGAGT3′,产物长度189 bp。
1.6 ELISA检测培养液中PRG4分泌量的变化 用包被缓冲液(pH9.6 0.05 M碳酸盐缓冲液)将抗兔PRG4抗体稀释至1 μg/ml,在96孔酶标板每孔加100 μl,4 ℃过夜。次日,弃去孔内溶液,用洗涤缓冲液洗3次,每次3 min。加样:加入收取的滑膜培养液100 μl,37 ℃孵育2 h,洗涤缓冲液洗3次。加酶标抗体:加1X生物素化PRG4抗体、1X HRP酶亲和素各100 μl,37 ℃孵育2 h,洗涤3次。加入显色底物(TMB)100 μl,37 ℃孵育30 min,反应终止液50 μl。450 nm波长处测OD值,PRG4浓度与OD450值之间呈正比,通过绘制标准曲线计算出样品中PRG4的浓度。
2 结 果
2.1 1,25(OH)2D3对关节滑膜PRG4基因表达影响的时间谱分析 Real time-PCR分析结果显示,1,25(OH)2D3作用6 h后PRG4 mRNA表达水平开始上调,12 h时PRG4 mRNA表达水平继续升高,24 h时PRG4 mRNA表达水平达峰值,48 h后PRG4 mRNA水平开始降低(表1)。
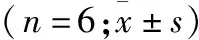
表1 1,25(OH)2D3作用不同时间PRG4 mRNA表达水平
2.2 1,25(OH)2D3对关节滑膜分泌PRG4蛋白影响的时间谱分析 ELISA法PRG4蛋白定量分析表明,1,25(OH)2D3作用6 h后滑膜培养液中PRG4蛋白含量与对照组相比差异无统计学意义;12 h时滑膜培养液中PRG4蛋白含量明显升高,差异有统计学意义;24 h时滑膜培养液中PRG4蛋白含量继续升高,48~72 h滑膜培养液中PRG4蛋白含量达高峰平台期,见表2。
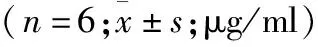
表2 1,25(OH)2D3作用不同时间PRG4蛋白分泌变化
2.3 1,25(OH)2D3浓度对关节滑膜PRG4基因表达的影响 Real time-PCR分析结果显示,0.1~100 nM浓度的1,25(OH)2D3均明显促进关节滑膜PRG4基因表达,与空白对照相比差异有统计学意义。在0.1~100 nM浓度范围内,PRG4基因表达上调幅度与1,25(OH)2D3的浓度正相关(表3)。
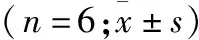
表3 不同浓度1,25(OH)2D3对PRG4 mRNA表达水平的影响
2.4 1,25(OH)2D3浓度对关节滑膜分泌PRG4蛋白的影响 根据实验结果,1,25(OH)2D3作用48 h后滑膜培养液中PRG4蛋白分泌量达高峰,因此选为最佳时间点。ELISA检测滑膜培养液中PRG4蛋白含量结果显示,0.1~100 nM 浓度的1,25(OH)2D3均明显促进关节滑膜PRG4蛋白分泌,并且在0.1~100 nM浓度范围内,PRG4蛋白分泌上调幅度与1,25(OH)2D3的浓度正相关(表4)。
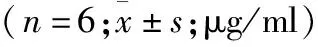
表4 不同浓度1,25(OH)2D3对PRG4蛋白表达水平的影响
3 讨 论
滑膜是一层紧贴关节囊内衬面的膜状结构,主要的功能是分泌滑液。滑膜通过分泌关节滑液(synovial fluid,SF)营养关节软骨,润滑关节面,减少关节运动时摩擦。充足的关节液是保护关节软骨和关节面不受磨损和冲击的关键[7]。在关节滑液中起润滑和缓冲作用的重要分子是透明质酸(hyaluronic acid,HA)和PRG4。透明质酸是滑液流变性能的基础分子,而蛋白聚糖是关节滑液边界润滑功能的关键分子[8]。PRG4 是一种大分子蛋白多糖,是关节液的重要组成部分,具有介导边界润滑、缓冲关节负荷、降低摩擦力等作用。PRG4中间段有丰富的O连接,可以结合丰富的糖基。在关节滑液中,PRG4、HA和表面活性磷脂通过分子间相互作用从而使关节滑液既黏稠又有良好的弹性和抗压性。
多项研究表明,维生素D缺乏与严重骨关节炎密切相关,特别是中老年人[9];维生素D缺乏也与骨关节炎进展相关[10]。1,25(OH)2D3主要通过核受体VDR(vitamin D receptor, VDR)和膜受体Pdia-3转导实现[11]。本研究中,1,25(OH)2D3分别在作用6 h和12 h后检测到PRG4 mRNA表达和滑膜培养液中PRG4蛋白上调,说明不是膜受体Pdia-3瞬时转导效应,笔者推测1,25(OH)2D3调节PRG4基因表达及蛋白分泌的机制可能主要是通过核受体VDR实现。
流行病学研究表明,维生素D缺乏与骨关节炎相关性很高,而且补充维生素D可缓解骨性关节炎病情[9,10],但分子机制不清楚。骨性关节炎最早的病理改变是关节液中重要润滑分子透明质酸和PRG4分泌减少,本实验数据表明,1,25(OH)2D3不仅能增加关节滑膜分泌透明质酸的能力[6],也能增加关节滑膜分泌PRG4的能力,这提示1,25-(OH)2D3可能是调节关节滑膜分泌的重要因素。这也提示缺乏1,25(OH)2D3是骨性关节炎可能的重要因素之一,早期补充维生素D可能对预防骨性关节炎有重要作用。
