鉴别非洲猪瘟病毒和猪瘟病毒野毒株二重TaqMan MGB实时荧光定量PCR检测方法的建立及初步应用
2021-03-01王淑娟班付国王东方赵雪丽谢彩华马震原杨海波闫若潜
王淑娟,班付国,王东方,刘 影,赵雪丽,谢彩华,王 翠,马震原,杨海波,柴 茂,闫若潜
(河南省动物疫病预防控制中心, 郑州 450008)
非洲猪瘟(African swine fever, ASF) 是由非洲猪瘟病毒(ASFV)引起的一种急性、高度接触性传染疫病[1],可引起猪高热、精神沉郁、皮肤发绀、食欲废绝、出血性病变和共济失调,并伴有严重的血小板和淋巴细胞减少,感染动物通常在感染后10~14 d内死亡,病死率可达100%[2]。ASFV基因组为双链DNA,大小170~194 kb[3]。病毒基因可编码200多种蛋白质,其中,结构蛋白有54种,P72是一种结构蛋白,是病毒衣壳的主要组成部分,P72基因序列保守,不同毒株之间都有相同的保守序列[4]。
猪瘟(classical swine fever, CSF)是由猪瘟病毒(CSFV) 引起的一种高致死性、烈性传染病[5],以稽留高热、出血、母猪流产为主要特征。该病主要通过呼吸道和消化道传染,传播速度快,发病率和死亡率都很高,给全球养猪业带来巨大的经济损失[6-7]。CSFV 属于黄病毒科(Flaviviridae)瘟病毒属(Pestivirus),为单股正链RNA病毒。CSFV基因组全长12.3 kb,主要由5′非编码区(5′UTR)、开放阅读框(ORF)和 3′非编码区(3′UTR)3部分组成,5′UTR 由360~374个碱基组成,具有很高的保守性,能够形成复杂稳定的二级结构[8]。
非洲猪瘟和猪瘟引起的临床症状极为相似,必须借助实验室检测进行鉴别诊断。目前,非洲猪瘟病毒的检测方法很多,血清学方法有间接 ELISA、阻断 ELISA和间接荧光抗体试验;病原学方法有病毒的细胞培养和分离、直接免疫荧光、双抗体夹心ELISA、普通PCR和荧光定量PCR (FQ-PCR) 等,其中,OIE 推荐的普通PCR和荧光定量 PCR 是最为常用的实验室检测方法[9]。现有的CSFV诊断方法有免疫荧光、ELISA、病毒分离、RT-PCR等,但这些方法都存在敏感性、特异性低及耗时等不足,且不能区分野毒株和疫苗株[10-12]。
在已有的研究基础上,作者根据ASFV的P72基因和CSFV的5′UTR非编码区序列保守的特点,分别设计1对特异性引物和1条TaqMan MGB探针,可在一个反应体系内同时检测ASFV和CSFV野毒株,为ASFV和CSFV野毒株的鉴别诊断提供了快速、敏感、特异的临床检测方法。
1 材料与方法
1.1 阳性物质和毒(菌)株
ASFV目的基因由宝生物工程(大连)有限公司合成;猪瘟活疫苗购自广东永顺生物制药股份有限公司;灭活的猪繁殖与呼吸综合征病毒(PRRSV)、猪伪狂犬病病毒(PRV)、猪圆环病毒2型(PCV2)、猪细小病毒(PPV)、猪乙型脑炎病毒(JEV)、副猪嗜血杆菌(HPS)等均由河南省动物疫病预防控制中心实验室提供。
1.2 仪器设备与主要试剂
全自动核酸提取仪,美国Thermo公司产品;荧光PCR仪,美国ABI公司产品;PCR扩增仪,德国Biometra公司产品;凝胶成像分析系统,美国Alpha Innotech公司产品;台式高速冷冻离心机,美国Heraeus公司产品;核酸提取试剂盒购自西安天隆科技有限公司;PrimeScript RT Master Mix、ExTaqDNA聚合酶、dNTPs、酶抑制剂等均购自宝生物工程(大连)有限公司;M-MLV反转录酶、pGEM-T Easy载体等购自Promega公司。
1.3 标准品的制备
利用全自动核酸提取仪从ASFV人工合成片段中提取核酸,即为ASFV DNA,-20 ℃冻存备用。利用全自动核酸提取仪从CSFV野毒株阳性样品中提取核酸,并用随机引物反转录成为cDNA,-20 ℃冻存备用。采用PCR方法分别扩增ASFV的P72基因和CSFV野毒株的5′UTR非编码区目的基因,并将阳性扩增产物分别克隆入pGEM-T Easy载体中,筛选阳性重组质粒送宝生物工程(大连)有限公司,采用T7和SP6引物进行测序。测序正确的ASFV的P72基因和CSFV的5′UTR非编码区基因的阳性重组质粒(分别命名为pGEM-ASFV、pGEM-CSFV),应用分光光度计测定其OD260 nm和OD280 nm值及OD260 nm/OD280 nm值,共重复5次,参考Kim等[13]介绍的方法计算其浓度,获得ASFV和CSFV阳性标准品,-20 ℃保存备用。
1.4 引物和探针的设计和合成
根据ASFV的P72基因和CSFV的5′UTR非编码区序列保守的特点,分别比对GenBank中ASFV的P72基因和CSFV的5′UTR非编码区序列,应用Primer Premier6.0基因分析软件,设计两对特异性引物对和两条TaqMan MGB探针,分别命名为ASFV-P1、ASFV-P2、ASFV-Probe-P3、CSFV-P4、CSFV-P5、CSFV-Probe-P6,引物序列见表1。引物和探针均由Invitrogen公司合成。
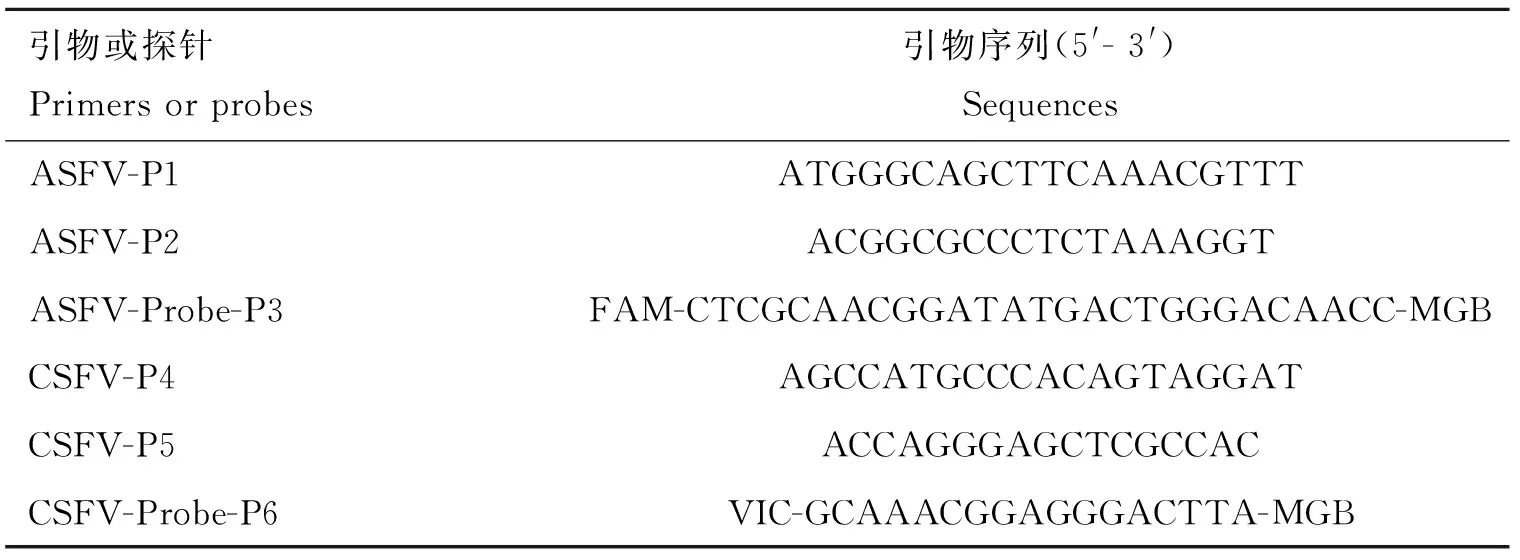
表1 二重TaqMan MGB FQ-PCR引物和探针序列Table 1 The primers and probes sequences of duplex TaqMan MGB FQ-PCR
1.5 反应体系与条件的优化
pGEM-ASFV、pGEM-CSFV重组质粒分别稀释至终浓度1.0×105拷贝·μL-1作为检测模板,P1/P2、P4/P5引物对分别稀释至终浓度0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8和1.0 μmol·L-1,Probe-P3、Probe-P6探针分别稀释到终浓度为0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8和1.0 μmol·L-1,应用荧光PCR仪采用矩阵法筛选不同浓度的针对pGEM-ASFV和pGEM-CSFV扩增的引物/探针组合;在56、57、58、59、60、61和62 ℃的退火温度下进行扩增。筛选鉴别ASFV、CSFV二重TaqMan MGB FQ-PCR最佳引物浓度、探针浓度和最佳反应条件。
1.6 敏感性试验和标准曲线的建立
将pGEM-ASFV和pGEM-CSFV阳性重组质粒分别进行10倍系列稀释,2种质粒按1∶1比例混合,每种质粒终浓度调整为1.0×106~1.0×100拷贝·μL-1, 共7个稀释度,以纯水为阴性对照,按优化好的FQ-PCR反应条件进行ASFV、CSFV二重TaqMan MGB FQ-PCR敏感性试验。分别以pGEM-ASFV和pGEM-CSFV阳性重组质粒起始模板浓度的对数为X轴,以FQ-PCR循环次数Ct值为Y轴作回归曲线,建立ASFV、CSFV二重TaqMan MGB FQ-PCR方法的标准曲线。
1.7 特异性试验
对猪瘟病毒疫苗株(CSFV-Vac)、猪繁殖与呼吸综合征病毒(PRRSV)、猪伪狂犬病病毒(PRV)、猪圆环病毒2型(PCV2)、猪细小病毒(PPV)、猪乙型脑炎病毒(JEV)、副猪嗜血杆菌(HPS)、阴性对照等提取核酸并将CSFV-Vac、PRRSV、JEV核酸进行反转录,同时,以ASFV和CSFV阳性标准品为阳性对照,按优化好的反应条件进行二重FQ-PCR扩增以验证该方法的特异性。
1.8 重复性试验
分别将3个浓度的10倍系列稀释的pGEM-ASFV和pGEM-CSFV阳性重组质粒等量混合物(每种质粒终浓度1.0×105~1.0×103)按照优化的FQ-PCR反应条件进行扩增,每个系列设定3个重复,分成3个批次进行验证该方法的重复性。
1.9 应用试验
对20份疑似CSFV感染样品(样品编号:1~20)、10份临床疑似ASFV感染样品(样品编号:21~30)和20份健康猪样品(样品编号:31~50)分别采用本研究建立的鉴别ASFV、CSFV二重TaqMan MGB FQ-PCR方法和猪瘟国标方法及OIE推荐的非洲猪瘟检测方法检测进行实验室检测,同时,以ASFV和CSFV阳性标准品为阳性对照,以纯水为阴性对照。对这些方法的检测结果进行比较分析。
2 结 果
2.1 标准品浓度测定
计算pGEM-ASFV、pGEM-CSFV质粒DNA溶液的浓度分别为8.75×1010、7.96×1010拷贝·μL-1,分别定量稀释至1.0×100~1.0×106拷贝·μL-1。
2.2 鉴别ASFV、CSFV二重TaqMan MGB FQ-PCR方法反应体系与反应条件的优化
本研究对引物与探针浓度进行优化,以提高反应的扩增效率与敏感度。优化出25 μL反应体系:ASFV-P1、ASFV-P2、CSFV-P4、CSFV-P5终浓度各为0.4 μmol·L-1,探针ASFV-Probe-P3终浓度为0.4 μmol·L-1,探针CSFV-Probe-P6终浓度为0.6 μmol·L-1,2.5 mmol·L-1dNTPs 2 μL,10×ExTaq酶缓冲液2.5 μL,5 U·μL-1ExTaqDNA聚合酶0.3 μL,1.0×105拷贝·μL-1的质粒模板各2 μL,去离子水补足至总体积25 μL。最佳反应程序:94 ℃预变性5 min;94 ℃变性15 s,60 ℃退火30 s,40个循环。最佳反应条件下的二重FQ-PCR结果见图1。

1.ASFV重组质粒; 2. CSFV重组质粒; 3. 阴性对照; 4~10. CSFV-Vac、PRRSV、PRV、PCV2、PPV、JEV和HPS1. Recombinant plasmid of ASFV; 2. Recombinant plasmid of CSFV; 3. Negative control; 4-10. CSFV-Vac, PRRSV, PRV, PCV2, PPV, JEV and HPS图1 鉴别ASFV、CSFV二重TaqMan MGB FQ-PCR方法建立及特异性试验结果Fig.1 Establishment and specificity analysis of duplex TaqMan MGB FQ-PCR
2.3 标准曲线的建立、敏感性试验和判定标准的初步确定
二重FQ-PCR对pGEM-ASFV和pGEM-CSFV阳性重组质粒的最低检出限均为1.0×101拷贝·μL-1(图2)。由敏感性检测结果建立ASFV标准曲线,相关系数R2为0.996,斜率为-4.161, 截距为39.17,从而得出拷贝数(x)与Ct值之间的线性关系表达式:y=-4.161lgx+39.17(图3A);由敏感性检测结果建立CSFV型标准曲线,相关系数R2为0.997,斜率为-3.582,截距为37.87,从而得出拷贝数(x)与Ct值之间的线性关系表达式:y=-3.582lgx+37.87(图3B)。
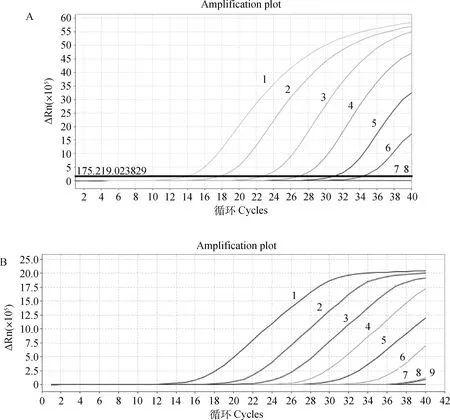
A. ASFV;B. CSFV;1~7. 分别对应的质粒浓度1.0×106、1.0×105、1.0×104、1.0×103、1.0×102、1.0×101、1.0×100拷贝·μL-1;8、9.阴性对照A. ASFV; B. CSFV; 1-7. The plasmid concentrations is 1.0×106, 1.0×105, 1.0×104, 1.0×103, 1.0×102, 1.0×101, 1.0×100copies·μL-1, respectively; 8, 9. Negative control图2 ASFV、CSFV FQ-PCR方法的敏感性试验Fig.2 Sensitivity tests of ASFV, CSFV FQ-PCR
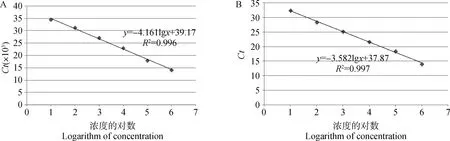
A. ASFV;B. CSFV; x为拷贝数A. ASFV; B. CSFV; x. Copies number图3 ASFV、CSFV FQ-PCR方法标准曲线Fig.3 The standard curve of ASFV, CSFV FQ-PCR
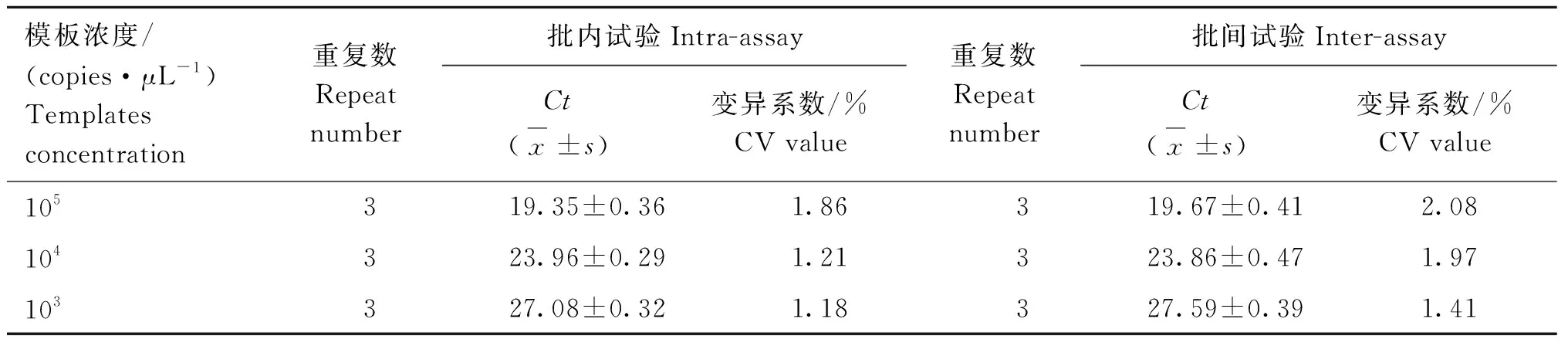
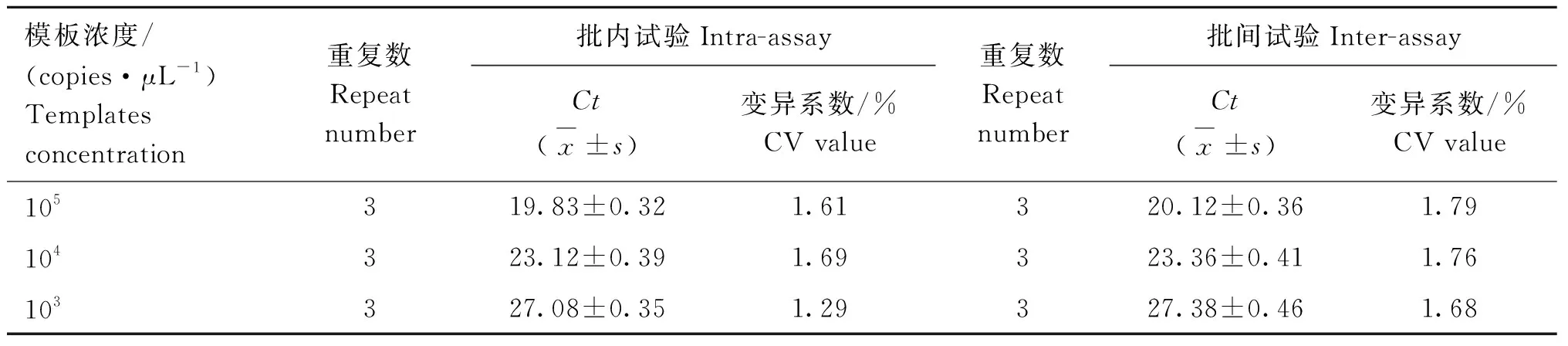
根据标准曲线,初步将判定标准定为如果被检样本的PCR反应体系通道出现2条特定的扩增曲线,且Ct值≤33.0,则可判定为非洲猪瘟病毒及猪瘟野毒株核酸阳性;如果被检样本的PCR反应体系通道无特定的扩增曲线,且Ct值>35.0或无,则判定为非洲猪瘟病毒及猪瘟野毒株核酸阴性;如果被检样本的PCR反应体系通道出现特定的扩增曲线,且33.0 ASFV、CSFV阳性标准品FQ-PCR扩增Ct值分别为17.02和19.87且出现特定的扩增曲线;阴性对照和CSFV-Vac、PRRSV、PRV、PCV2、PPV、JEV、HPS等均未出现特定的扩增曲线(图1),说明本方法特异性良好。 ASFV FQ-PCR方法和CSFV FQ-PCR方法批内重复和批间重复试验变异系数(CV值)均在3%以下,扩增效率稳定,表明建立的鉴别ASFV、CSFV二重TaqMan MGB FQ-PCR方法具有很好的稳定性和重复性。 表2 ASFV FQ-PCR方法稳定性和重复性试验Table 2 The results of ASFV FQ-PCR stability and repeatability 表3 CSFV FQ-PCR方法稳定性和重复性试验Table 3 The results of CSFV FQ-PCR stability and repeatability 采用本研究建立的鉴别ASFV、CSFV野毒株二重TaqMan MGB FQ-PCR方法对50份临床样品进行检测,共检测出17份CSFV阳性、3份ASFV阳性,检测结果与猪瘟国标方法及OIE推荐的非洲猪瘟检测方法检测结果完全一致,表明本研究建立的鉴别ASFV、CSFV野毒株二重TaqMan MGB FQ-PCR方法具有较高的特异性和敏感性,可用于临床ASFV和CSFV野毒株的鉴别诊断。 ASF最早于1921年在肯尼亚暴发,随后相继扩散至欧洲、中美洲、非洲和亚洲的多个国家[14],该病病程短、发病率和死亡率几乎达100%,中国首例非洲猪瘟疫情于2018年8月在辽宁沈阳暴发[15], 随后疫情持续在我国迅速蔓延开来,严重威胁着我国养猪业的发展。CSF传播速度快,发病率和死亡率都很高,给全球养猪业带来巨大的经济损失。这两种疫病都被世界动物卫生组织(OIE)列为法定报告的动物疫病,也是中国动物病原微生物名录中规定的一类动物传染病[16-19]。 虽然距首次发现ASFV至今已将近百年,但目前世界上仍没有可有效预防ASFV感染的疫苗,也无有效的治疗药物,仅能依赖有限的抗原检测方法对ASFV感染开展早期诊断,进而通过扑杀感染动物来实现对ASF疫情的控制。目前,我国也有针对猪瘟的疫苗,但疫苗生产企业众多,疫苗质量参差不齐,免疫失败时有发生,且CSF的临床表现趋于复杂化,典型性病例减少[20],单凭临床症状很难确诊。且由于 ASF 与CSF等其他出血性猪病的发病症状非常相似,很难通过临床诊断的方法进行区分,只能依靠实验室方法进行鉴别诊断。因此,建立对 ASFV和CSFV野毒株快速、特异、敏感的鉴别诊断方法对疫情防控尤为重要。 国内外很多学者建立了ASFV和CSFV的PCR或荧光定量PCR方法,Aguero等[21]根据ASFVVP72 基因设计引物,建立了用于ASFV早期感染的快速诊断方法;Basto等[22]建立了可用于检测蜱虫体内ASFV的套氏PCR方法;崔尚金等[23]建立了ASFV的高效纳米PCR检测方法;King等[24]、黄萍等[25]、Tignon等[26]多个研究团队先后以ASFVVP72基因为靶基因建立基于TaqMan的ASFV实时荧光定量PCR检测方法;Mckillen等[27]根据9GL基因建立MGB探针实时荧光定量PCR检测方法。Risatti等[28]首次建立了CSFV的FQ-PCR方法;Liu 等[29]将CSFV检测一步RT-PCR方法与FQ-PCR方法进行了比较,认为前者适合低成本检测,后者能实现高通量; Ciglenecki等[30]对染料法和MGB探针法进行了比较,认为MGB 探针法定量优于前者。但是这些PCR检测方法的灵敏度和特异性均相对偏低,且不能实现ASFV和CSFV的鉴别检测。 本研究建立的鉴别ASFV、CSFV野毒株二重TaqMan MGB FQ-PCR方法是在同一反应体系中进行ASFV和CSFV的扩增反应,同时收集不同的荧光信号,对扩增产物进行实时检测,从而实现ASFV和CSFV野毒株的鉴别检测。本研究建立的FQ-PCR方法采用TaqMan MGB探针,与传统的TaqMan探针相比,TaqMan MGB探针缩短了探针的长度,大大提高了探针的Tm值,也降低了探针的合成成本,TaqMan MGB探针的淬灭基团采用非荧光淬灭基团,其本身不产生荧光信号,可大大降低本底信号的强度,使扩增结果更加特异、敏感。本研究建立的方法操作简便、速度快,可在1 h内完成ASFV和CSFV野毒株的鉴别检测。 本研究建立的鉴别ASFV、CSFV野毒株二重TaqMan MGB FQ-PCR方法是根据ASFV和CSFV野毒株基因序列保守区设计引物和探针,方法对ASFV和CSFV野毒株的最低检测模板浓度均为10 拷贝·μL-1,特异性强,稳定性和重复性良好;对50份临床样品进行检测,检测结果与猪瘟国标方法及OIE推荐的非洲猪瘟检测方法结果完全一致。因此,本研究建立的鉴别ASFV、CSFV野毒株二重TaqMan MGB FQ-PCR方法为ASFV和CSFV野毒株的鉴别诊断提供了快速、敏感、特异且能满足临床检测需求的新方法。 成功建立了可对非洲猪瘟病毒和猪瘟病毒野毒株鉴别检测的二重TaqMan MGB实时荧光定量PCR检测方法,该方法敏感性高、特异性强、重复性好,对临床样品的检测结果与猪瘟国标方法及OIE推荐的非洲猪瘟检测方法结果完全一致。该方法的建立为ASFV和CSFV野毒株的鉴别诊断提供了新的检测方法。2.4 特异性试验
2.5 稳定性和重复性试验
2.6 应用试验
3 讨 论
4 结 论
