性控奶山羊精液X和Y精子分离比例检测方法的建立
2021-03-01何琪富王宇飞权富生
何琪富,王宇飞,张 康,康 健,张 涌*,权富生*
(1. 西北农林科技大学动物医学院,杨凌 712100; 2. 农业部动物生物技术重点实验室,杨凌 712100;3. 陕西省动物胚胎工程技术研究中心,杨凌 712100)
性别控制对畜牧业生产有着重大意义,畜牧生产中很多重要的经济性状都与性别有关,如肉、蛋、乳、毛、茸等都需要特定性别的动物进行生产[1-2]。奶山羊以产奶为主,通过X、Y精子分离以后配种可提高母羊所占比例,加快母羊群体的扩繁,提高奶山羊饲养经济效益,在生产中具有重要意义[2]。X、Y精子分离是性别控制技术最常用的手段,而对于精子分离,无论是新方法的建立,还是原有方法的优化都离不开性控精液纯度的评价[3-4]。
国内外科研人员对 X、Y精子之间的差异进行了研究,包括X、Y精子质量大小不同、所带电荷不同、所含DNA含量差异以及所包含受体种类不同,利用这些差异来分离不同染色体的精子[5-9]。目前,公开报道的精液分离方法有沉降法、密度梯度离心法、电泳法、流式细胞分离法、H-Y抗原抗体结合法等[3,10-11],但是除了确认X、Y精子的DNA含量具有差异之外,其他方面的差异尚难以进行准确的量化区分,导致对分离的精液纯度存在争议[12-13]。分析分离精液中X、Y精子纯度的常用方法有实时荧光定量PCR法和分选型流式细胞仪重分析法[3, 14-17]。Parati等[14]以及侯胜奎等[15]以牛X和Y染色体特异基因PLP与SRY为靶基因,分别建立了可以计算精液中X和Y精子数量和纯度的实时荧光定量PCR探针法,以及可以评估性控精液纯度的实时荧光定量PCR染料法。流式细胞仪重分析法是当前公认的最佳评价精液分离纯度的方法[16-17],奶山羊X精子DNA含量比Y精子DNA含量多4.2%,理论上可以用流式细胞术进行分选及纯度分析[3],但是目前关于奶山羊精液的X、Y精子分选体系还不完善,没有一套成熟的分选参数系统可供参考,鉴于设备昂贵且需要专业人员操作,只有少数单位配置,无法满足一般科研院所的试验需求[2]。因此迫切需要建立可以准确、迅速、简便地对分离的性控精液纯度进行检测的技术方法,以满足性控精液新方法的研究和技术创新。
本研究的目的是建立一种可以计算奶山羊性控精液X和Y精子数量和比例的real-time PCR定量方法,有助于评价不同X和Y精子分离方法的效果,开发简化的、成本较低的、有利于生产应用的技术方法。
1 材料与方法
1.1 主要材料、试剂及仪器
奶山羊商品化性控精液购自内蒙古赛科星生物技术有限公司,由本试验室保存;DNA Marker、DH5ɑ感受态细胞、质粒提取试剂盒、PMD19-T克隆载体等购自TaKaRa公司;AxyPrep DNA凝胶回收试剂盒购自Axygen公司。紫外分光光度计Cary50Probe (Vatian,美国);凝胶成像系统Doc2000(Bio-Rad,美国);高速冷冻离心机(Eppendorf,德国);实时荧光定量仪(Thermal Cycler CFX96 Real-Time System,美国)。
1.2 引物设计
对GenBank中奶山羊X、Y染色体序列进行生物信息学分析,利用DNAMAN引物设计软件设计引物,针对X染色体选择特异基因F9设计检测引物,探针5′端用HEX发光基团,3′端用TAMRA淬灭基团;针对 Y染色体选择特异基因ZFY设计检测引物,探针5′端用FAM发光基团,3′端用BHQ淬灭基团,引物序列见表1,由生工生物工程有限公司合成。
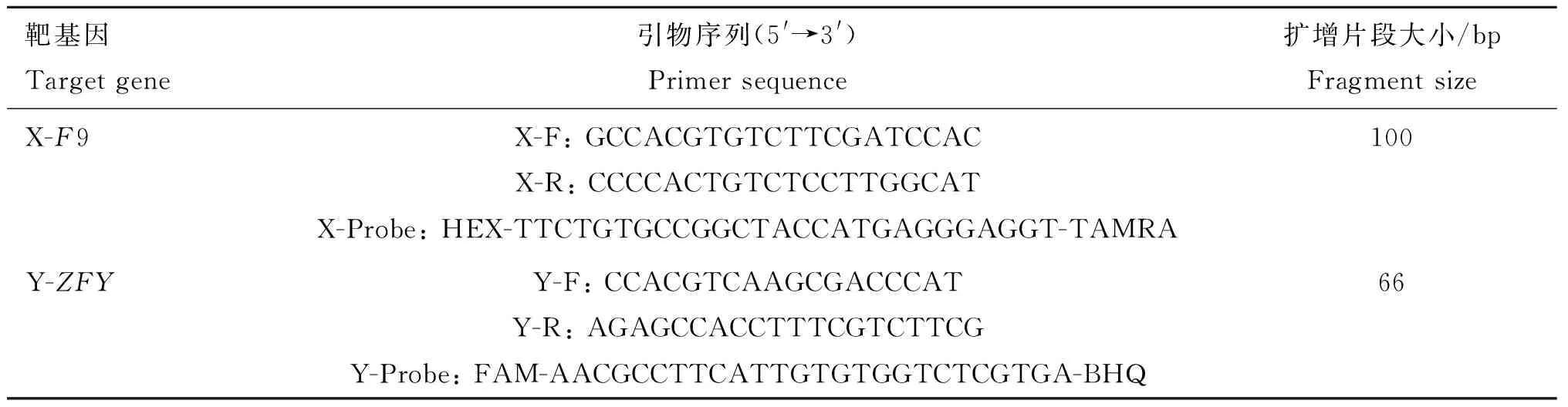
表1 real-time PCR检测方法的引物信息Table 1 Primers information for real-time PCR assay
1.3 商品化性控精液核酸提取
将购买的商品化性控精液从冻存管中取出,加入10倍体积的生理盐水进行稀释混匀,4 000×g离心10 min弃上清,利用TIANGEN有限公司的快速DNA提取检测试剂盒(KG203)提取精液DNA,保存于-20 ℃。
1.4 F9、ZFY基因阳性标准品制备
以X、Y精子基因组DNA为模板,分别用设计的检测引物进行PCR扩增,PCR产物经3%琼脂糖凝胶电泳鉴定,将与目的片段大小相近的条带进行胶回收,克隆转化并送生工生物工程有限公司测序。测序正确的阳性质粒分别作为F9、ZFY基因的阳性标准品,利用核酸蛋白检测仪测定其浓度,利用公式:(6.02 × 1023copies·mol-1) × (阳性标准品核酸浓度,g·mL-1) / (阳性标准品平均分子量MW,g·mol-1) = copies·mL-1,换算成拷贝数。
1.5 荧光定量PCR反应体系及条件的优化
qPCR反应体系为20 μL:F9、ZFY基因的阳性标准品各1 μL,对应的上、下游引物各0.5 μL,探针各0.5 μL,预混酶10 μL,ddH2O 5 μL。qPCR反应参数设置:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,40个循环扩增。用方阵法对引物、探针浓度、退火温度(58~62 ℃)及循环次数等反应条件进行优化。
1.6 荧光定量PCR方法标准曲线的建立
将已知拷贝数的F9、ZFY基因的阳性标准品分别进行10倍连续梯度稀释,进行荧光定量 PCR,同时设置阴性对照,以起始模板浓度的对数为横坐标,以循环中的Ct值为纵坐标,建立标准曲线。
1.7 荧光定量PCR方法特异性评价
对已知纯度的商品化X、Y性控精液进行双重TaqMan荧光定量 PCR检测,同时设置阴性对照,验证该方法的特异性。
1.8 荧光定量PCR方法敏感性评价
以10倍连续梯度稀释的F9、ZFY基因的阳性标准品(1×101~1×1010)作为模板,同时设置阴性对照,进行双重 TaqMan 荧光定量 PCR扩增,每个浓度做3个重复,确定检测方法的敏感性。
1.9 荧光定量PCR方法稳定性评价
对不同稀释度(1×102、1×104、1×106)的F9、ZFY基因的阳性标准品混合物(相同稀释度混合)进行双重TaqMan荧光定量 PCR检测,3次重复,用以评价方法的组内重复性;将上述不同稀释度的阳性标准品混合物在3 d 后进行双重TaqMan荧光定量 PCR检测, 3次重复,用以评价方法的组间重复性。
1.10 荧光定量PCR方法准确性评价
利用本试验建立的双重TaqMan荧光定量 PCR方法对60支已知纯度的商品化性控精液进行分析(X、Y精液各30管),3次重复试验,计算X、Y精子数量以及比例,与所注明纯度进行显著性检验(利用SPSS统计分析软件),评估方法的准确性。
2 结 果
2.1 荧光定量PCR引物的特异性
用设计的两对引物分别以奶山羊精液DNA为模板进行PCR扩增(图1),凝胶电泳出现单一条带且大小与预期结果相符,产物回收后连接转化测序,证明扩增的ZFY和F9基因片段长度分别为66 和100 bp,与GenBank中ZFY和F9基因片段的相似性为100%,为Y染色体ZFY基因和X染色体F9基因的特异序列。

M. DNA相对分子质量标准;1~3. ZFY基因扩增条带66 bp;4~6. F9基因扩增条带100 bpM. DNA Marker 500; 1-3. ZFY gene amplified band 66 bp; 4-6. F9 gene amplified band 100 bp图1 引物扩增片段电泳鉴定Fig.1 Gel electrophoresis identification of amplified fragments by specific primers
2.2 荧光定量PCR反应体系及条件的优化
将表1中的上、下游引物和探针采用矩阵法优化后,再优化Tm值,筛选最佳的双重TaqMan荧光定量 PCR反应体系及条件。优化的20 μL反应体系:F9、ZFY基因的阳性标准品各1 μL,相应的上下游引物各0.5 μL,探针各0.4 μL,预混酶10 μL,ddH2O 补足20 μL。反应条件:95 ℃ 30 s;95 ℃ 10 s, 58 ℃ 30 s,40个循环扩增。
2.3 荧光定量PCR方法标准曲线的建立
紫外分光光度计测得F9、ZFY基因的阳性标准品浓度分别为140和150 ng·μL-1,换算成拷贝数分别为4.7×1010和5.1×1010copies·μL-1。参照上述优化的反应条件进行扩增,检测F9基因阳性标准品浓度在4.7×101~4.7×109copies·μL-1之间,呈现良好的线性关系(图2A),标准曲线为y=-3.206 8x+39.843,决定系数R2值为0.993 2,扩增效率为105%;检测ZFY基因阳性标准品浓度在5.1×101~5.1×109copies·μL-1之间,呈现良好的线性关系(图2B),标准曲线为y=-3.124 5x+40.056,决定系数R2值为0.996 7,扩增效率为108%。说明检测X和Y精子的方法线性关系良好、扩增效率高。

A. F9基因标准曲线;B.ZFY基因标准曲线A. The standard curve of F9 gene; B. The standard curve of ZFY gene图2 real-time PCR方法的标准曲线Fig.2 The standard curve of real-time PCR method
2.4 荧光定量PCR方法的特异性
用所建立的双重TaqMan荧光定量 PCR方法对已知纯度的商品化X(纯度为95.0%)和Y精液(纯度为92.0%)进行DNA检测。结果显示,在X精液DNA检测中出现两条扩增曲线,利用标准曲线计算F9和ZFY基因的拷贝数,F9与ZFY基因所占比例分别为94.8%和5.2%(图3A),F9基因所占比例与X精子纯度极接近;在Y精液DNA检测中出现两条扩增曲线,利用标准曲线计算F9和ZFY基因的拷贝数,F9与ZFY基因所占比例分别为5.1%和94.9%(图3B),ZFY基因所占比例与Y精子纯度极接近,由此可以看出,两对引物只特异性扩增了F9和ZFY基因,证明该方法具有良好的特异性。

A.检测X精子的特异性;B. 检测Y精子的特异性A. The specificity of detection of X sperm; B. The specificity of detection of Y sperm图3 real-time PCR方法的特异性Fig.3 The specificity of real-time PCR method
2.5 荧光定量PCR方法的敏感性
将F9、ZFY基因的阳性标准品经 10 倍梯度稀释,每个稀释度取 1 μL 混匀作为模板,进行荧光定量PCR扩增。根据建立的标准曲线计算,F9和ZFY基因的最小检出量分别为47和 51 copies·μL-1(图4A、4B),证明该方法敏感性高。

A. 检测F9基因的敏感性:1~10. 4.7×109~4.7×100copies·μL-1;B. 检测ZFY基因的敏感性:1~10. 5.1×109~5.1×100 copies·μL-1;N. 阴性对照A. The sensitivity of F9 gene: 1-10. 4.7×109-4.7×100copies·μL-1; B. The sensitivity of ZFY gene: 1-10. 5.1×109-5.1×100copies·μL-1; N. Negative control图4 real-time PCR方法的敏感性Fig.4 The sensitivity of real-time PCR method
2.6 荧光定量PCR方法的稳定性
所建立的双重TaqMan荧光定量 PCR方法的批内变异系数CV为0.48%~1.94%,批间变异系数为0.52%~2.34%(表2),表明该方法具有良好的稳定性。

表2 重复性试验Table 2 Crossing test of the experimental results
2.7 荧光定量PCR方法的准确性
利用本试验所建立的双重TaqMan荧光定量 PCR方法对商品化的X和Y精液纯度进行分析,每个样本重复3次,将试验测得精液纯度与购买的商品化性控精液标签注明纯度利用SPSS软件进行差异显著性分析,所得P值均大于0.05,表明无显著差异(表3),证明本试验建立的检测方法结果可靠。

表3 准确性试验Table 3 Significance test of the accuracy results
3 讨 论
目前,在自然状态下的奶山羊养殖中,雄性羔羊的价值远小于雌性羔羊[2, 18]。按照常规的生产方式,繁殖得到后代雌、雄比例各占50%,过多公羊的养殖会增加生产成本,降低饲养奶山羊的经济效益[19-20]。近年来,我国奶山羊养殖业得到快速发展,陕西省将奶山羊产业列为千亿元农业工程产业,繁殖母羊和产奶母羊的需求量大增,奶山羊数量不足,阻碍了该产业的发展[7, 21-23],快速增加奶山羊母羊的数量和比例,对于奶山羊产业的迅速发展具有重要意义。
为达到人为控制繁殖母畜后代的性别比例的目的,研究者们开发了较多分离X、Y精子的技术方法,如沉降法、密度梯度离心法、电泳法、流式细胞分离法、H-Y抗原抗体结合法等[3,10-11],但是在生产中除了流式细胞分离技术外均未被广泛应用。目前,除了确认X、Y精子的DNA含量具有差异之外,其他方面的差异难以进行准确的量化区分,致使对分离的X、Y精子纯度存在争议[12-13]。目前,精子分离纯度的鉴定方法主要有实时荧光定量PCR方法和分选型流式细胞仪重分析法[3, 14-17]。Parati等[14]利用牛X和Y染色体特异基因PLP与SRY,通过条件优化成功建立了可以计算精液中X和Y精子数量和纯度的实时荧光定量PCR探针法;侯胜奎等[15]选择牛X、Y染色体特异基因PLP与SRY,通过标准曲线的建立以及不同质粒浓度的样本对方法进行验证,成功建立了可用于评估性控精液纯度的实时荧光定量PCR染料法。流式细胞仪通过对已经分选完成的精子进行第二次分选,用来计算其分离纯度的方法称为重分析法,是当前公认的最佳评价精液分离纯度的方法[13],动物X和Y精子DNA含量差异超过3%就可以进行纯度分析[3],奶山羊X精子DNA含量比Y精子DNA含量多4.2%,理论上可以用流式细胞术分选,但是目前关于奶山羊精液的X、Y精子分选体系还不完善,没有成熟的分选参数系统可供参考,仅有的研究报道,奶山羊精液分选速度为4 500个·s-1,无法满足每次输精剂量在千万级的输精要求,且精子活力经过染色及分选后均有下降趋势[2],鉴于设备昂贵且需要专业人员操作,只有少数单位配置,无法满足一般科研院所的试验需求。另外,当精液量少的情况下,采用流式细胞技术方法分离X、Y精子很难实现,同时对精子的损伤较大。开发一种新的成本低、对精子损伤小、简易的Y、Y精子分离方法具有重要的生产应用价值。因此建立一种方便且准确的实验室检测X和Y精子分离纯度的方法,为开发新的性控技术以及为生产应用提供了技术支撑。
本试验对奶山羊X和Y染色体上F9和ZFY基因进行生物信息学分析,选择X染色体上特异基因F9和Y染色体上特异基因ZFY的编码区设计了两对引物[24-25],分别扩增单一条带,经连接转化后测序为X染色体F9基因和Y染色体ZFY基因的特异序列,说明设计的引物特异性好;由于使用的是双重荧光定量PCR方法,因此需要采用矩阵法对上、下游引物和探针进行优化,通过对Tm值和循环数的优化;通过阳性标准品10倍稀释建立标准曲线,证明该方法线性关系良好、扩增效率高[26-28]。因为目前商品化的性控精液纯度不能达到100%,验证本试验所建立方法的特异性选择了商品化的已知纯度的性控X精子和Y精子进行定量分析,测得X精子、Y精子纯度与商品化性控精液注明纯度极接近[14-15, 29-30],表明本试验所建立的方法特异性良好;梯度稀释阳性标准品后进行扩增,测得该方法对F9和ZFY基因的最小检出量分别为47 和 51 copies·μL-1,平行试验测得批内变异系数CV<2%,批间变异系数CV<3%,表明该方法灵敏度高且稳定性好;对已知纯度的性控精液进行纯度检测,3次重复试验计算结果与已知纯度无显著性差异(P>0.05),说明该方法准确性高,结果可靠。由此可见,本试验成功建立了一种可以定量计算奶山羊精液中X、Y精子性别比的real-time PCR方法,有助于新的X、Y精子分离方法的开发,优化精子分离技术,降低奶山羊性别控制的生产成本和准确性,便于生产应用和普及,提高奶山羊的饲养效益,促进奶山羊产业的快速发展[31]。
4 结 论
本研究成功建立了基于TaqMan Probe的计算奶山羊精液中X、Y精子数量的real-time PCR方法,特异性和重复性好,灵敏度高,结果可靠,为检测分离的奶山羊精液X和Y精子纯度提供了可靠的方法,为新性控精液方法的开发提供了有力的技术支撑。
