miR-21-5p靶向TGF-β1调节大鼠心肌细胞增殖和凋亡
2021-03-01史东东高刚利李娇娇
史东东,张 栋,高刚利,李娇娇
(榆林市第一医院心内科一病区,陕西 榆林 719000)
急性心肌梗死(Acute myocardial infarction,AMI)会诱发心肌细胞凋亡水平,随后发生的缺血性再灌注和氧化应激也将进一步促进心肌细胞凋亡[1],从而导致心血管疾病加重并增加其病死率[2]。miRNA是一种非编码单链RNA分子,由约21~23个核糖核苷酸组成,对转录后的基因表达具有重要的调控作用[3]。大量研究表明,miRNA参与调控心肌细胞的增殖和凋亡[4]。如miR-21-5p通过抑制FASLG的表达水平,从而促进大鼠心肌细胞增殖并抑制其凋亡[5]。此外,大量研究表明[6],转化生长因子-β1(transforming growth factor-β1,TGF-β1)在心肌细胞成纤维化中起到重要的调控作用,但TGF-β1对心肌细胞增殖和凋亡的调控尚未见文献报道。故本文探讨miR-21-5p通过TGF-β1对大鼠心肌细胞增殖和凋亡的影响机制。
1 材料与方法
1.1 细胞株和主要试剂
大鼠心肌细胞H9c2购于美国典型培养物保藏中心(American type culture collection,ATCC)。RPMI-1640、胎牛血清、青霉素、链霉素和脂质体(lipofectamine)2000和免疫印迹一抗、二抗及蛋白提取试剂盒和SDS-PAGE凝胶快速制备试剂盒均购于上海优宁维有限公司。miR-21-5p inhibitor/mimic和pcDNA-TGF-β1构建于柏业贸易(上海)有限公司。RNA提取试剂盒和逆转录试剂盒均购于中国ambion公司。CCK-8试剂盒和Annexin V-FITC/PI双染细胞凋亡检测试剂盒购于日本同仁公司。
1.2 方法
1.2.1 细胞培养 大鼠心肌细胞H9c2培养于RPMI-1640完全培养基(含10%的胎牛血清)中,在培养箱(37 ℃,5% CO2)中常规培养,每3 d传代1次。
1.2.2 细胞转染 胰酶消化对数期H9c2细胞(浓度为1×105个/孔)接种于24孔板。按照Lipofectamine 2000转染试剂盒说明书将miR-21-5p inhibitor、pcDNA-TGF-β1及miR-21-5p mimic+pcDNA-TGF-β1转染至H9c2细胞中,加入RPMI-1640完全培养基中,放入培养箱(37 ℃、5% CO2、1% O2、94% N2)中培养,检测报告基因活性,在开始转染1 d后将细胞传代至新鲜培养基中,2 d后加入筛选抗生素,转染后24 h,将细胞以≥1∶10的比例传至新鲜培养基,次日加入选择培养基。
1.2.3 RT-qPCR检测miR-21-5p的表达 TRIZOL试剂盒提取对照组,miR-21-5p inhibitor组及miR-21-5p mimic+pcDNA-TGF-β1组中H9c2细胞总RNA,并用逆转录试剂盒将总RNA反转录成cDNA,并用荧光定量PCR试剂盒进行cDNA扩增。引物序列见表1。内参为U6,采用2-ΔΔCt法计算H9c2细胞中miR-21-5p的表达水平。反应体系: 10 μL SYBR Green Mix、2 μL反转录产物、上下游引物各0.5 μL、去离子水补充至20 μL。反应参数:95 ℃变性5 min后,再94 ℃变性30 s,最后60℃退火30 s,总共40个循环。
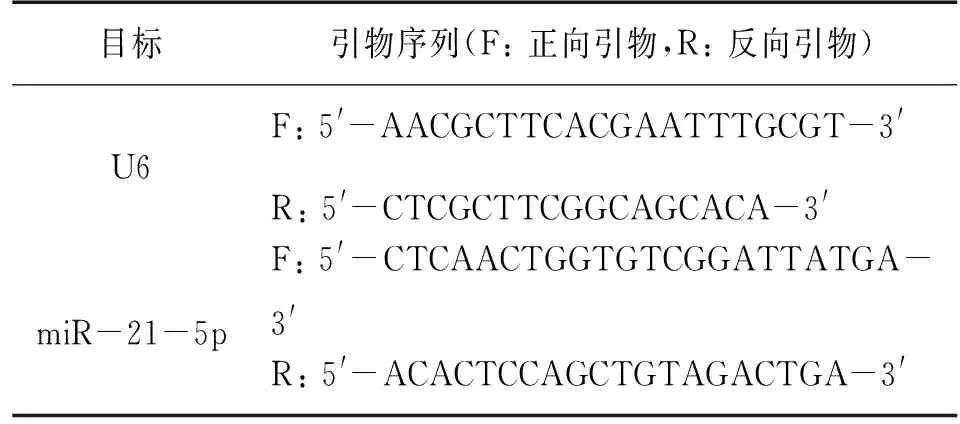
表1 引物序列
1.2.4 Western blotting检测TGF-β1的表达 收集对照组(NC组)、pcDNA-TGF-β1组及miR-21-5p mimic+pcDNA-TGF-β1组中H9c2细胞,参考蛋白提取试剂盒说明书提取H9c2细胞总蛋白,用BCA试剂盒进行定量。取等量蛋白与上样缓冲液混匀,95 ℃变性10 min后,采用10% SDS-PAGE分离蛋白,并转至PVDF膜上,封闭1 h后,4 ℃,一抗(1∶1 000)孵育过夜。次日去除一抗,TBST漂洗3次,加入二抗(1∶2 000),室温摇床孵育1 h,去除二抗,TBST漂洗3次。最后加入化学发光底物,在凝胶成像系统中显影,用Image J进行条带灰度值分析。
1.2.5 双荧光素酶报告基因实验验证miR-21-5p和TGF-β1的靶向关系 首先采用TargetScan数据库预测miR-21-5p的潜在靶向蛋白。将野生型和突变型TGF-β1-3′-UTR靶向区域构建至pGLO-basic载体中,然后分别与miR-21-5p mimic和miR-NC共转染至293T细胞。参考双荧光素酶试剂盒说明书,以海肾荧光值作为内参,采用酶标仪检测荧光素酶活性。每个样品中会有3个数值;RLU1-萤火虫荧光酶素酶反应强度;RLU2-内参海肾荧光素酶反应强度,计算2组数据比值,即RLU1/ RLU2。
1.2.6 CCK-8检测H9c2细胞增殖情况 取对照组、miR-21-5p inhibitor组、pcDNA-TGF-β1组及miR-21-5p mimic+pcDNA-TGF-β1组H9c2细胞,96孔板中每孔接种5×103个细胞,设置三个复孔,加入含有10%胎牛血清的培养基90 μL培养。分别于24、48、72、96 h行CCK8检测,参考说明书每孔加入10 μL CCK8,37 ℃,孵育2 h。使用酶标仪检测450 nm处的吸光度(OD值),并利用各时间点的吸光度绘制细胞增殖曲线。
1.2.7 Annexin V-FITC/PI双染检测H9c2细胞凋亡水平 取对照组、miR-21-5p inhibitor组、pcDNA-TGF-β1组及miR-21-5p mimic+pcDNA-TGF-β1组H9c2细胞,并用预冷的PBS重悬细胞一次,2 000 rpm离心10 min。加入300 μL去离子水稀释的Binding Buffer(1×Binding Buffer)悬浮细胞后,加入5 μL Annexin V-FITC,避光室温孵育15 min,然后加入5 μL PI进行染色,补加200 μL 1×Binding Buffer上机检测细胞凋亡情况。
1.3 统计学方法
SPSS20.0统计学软件进行实验数据分析。t检验进行组间比较,单因素方差分析进行多组间比较。以P<0.05为差异具有统计学意义。所有实验重复3次。
2 结果
2.1 miR-21-5p表达抑制对H9c2细胞的影响
RT-qPCR检测结果显示,与对照组相比,miR-21-5p inhibitor组H9c2细胞中miR-21-5p的表达水平显著下降(P<0.01,图1A)。CCK-8检测结果显示,miR-21-5p inhibitor组中H9c2细胞活力显著低于NC组(P<0.05,图1B)。Annexin V-FITC/PI双染检测结果显示,miR-21-5p inhibitor组中H9c2细胞的凋亡水平显著高于NC组(P<0.01,图1C)。由此可知,miR-21-5p表达抑制后使H9c2细胞增殖受到抑制并诱导其凋亡。
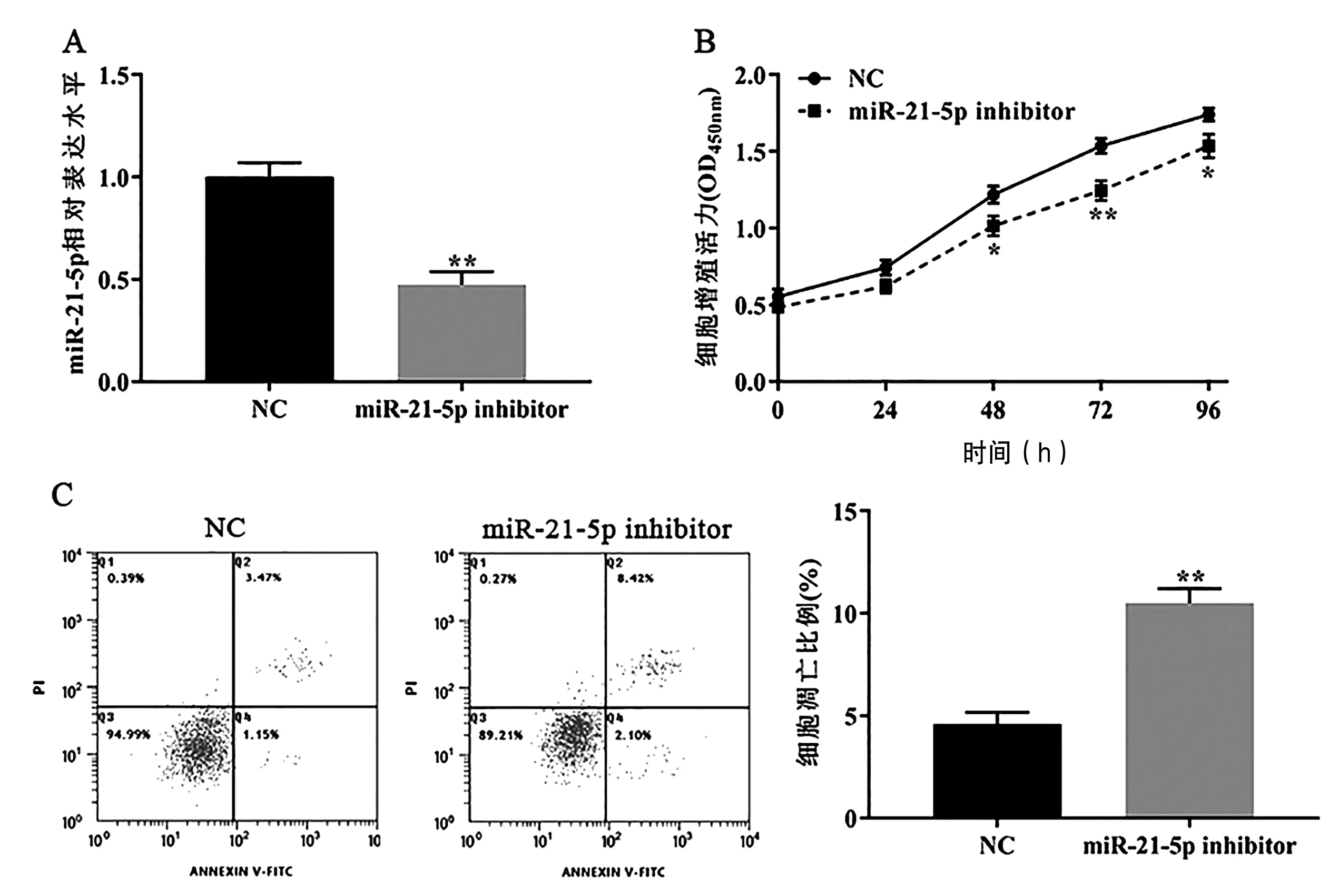
图1 miR-21-5p对H9c2细胞增殖和凋亡的影响
2.2 miR-21-5p靶向负调控TGF-β1的表达水平
TargetScan数据库预测结果显示,TGF-β1是miR-21-5p的潜在靶基因(图2A)。双荧光素酶实验结果显示,过表达miR-21-5p显著抑制野生型TGF-β1的表达水平(P<0.05,图2B),且miR-21-5p组中突变型TGF-β1的表达水平差异无统计学意义(P>0.05,图2B)。Western blotting检测结果显示,过表达miR-21-5p显著抑制H9c2细胞中TGF-β1的表达水平(P<0.05,图2C)。由此可知,TGF-β1是miR-21-5p的靶基因,且抑制TGF-β1的表达水平。
2.3 miR-21-5p通过TGF-β1促进H9c2细胞增殖并抑制其凋亡
Western blotting检测结果显示,pcDNA-TGF-β1组中TGF-β1表达水平显著高于NC组(P<0.05,图3A),且pcDNA-TGF-β1+miR-21-5p mimics组中TGF-β1表达水平低于pcDNA-TGF-β1组(P<0.05,图3A)。CCK-8试剂盒检测结果显示,pcDNA-TGF-β1组中H9c2细胞活力显著低于NC组(P<0.05,图3B),且pcDNA-TGF-β1+miR-21-5p mimics组中H9c2细胞活力高于pcDNA-TGF-β1组(P<0.05,图3B)。Annexin V-FITC/PI双染检测结果显示,pcDNA-TGF-β1组中H9c2细胞凋亡水平显著高于NC组(P<0.01,图3C),且pcDNA-TGF-β1+miR-21-5p mimics组中H9c2细胞凋亡水平低于pcDNA-TGF-β1组(P<0.05,图3C)。由此可知,过表达TGF-β1显著抑制H9c2细胞增殖并诱导其凋亡。
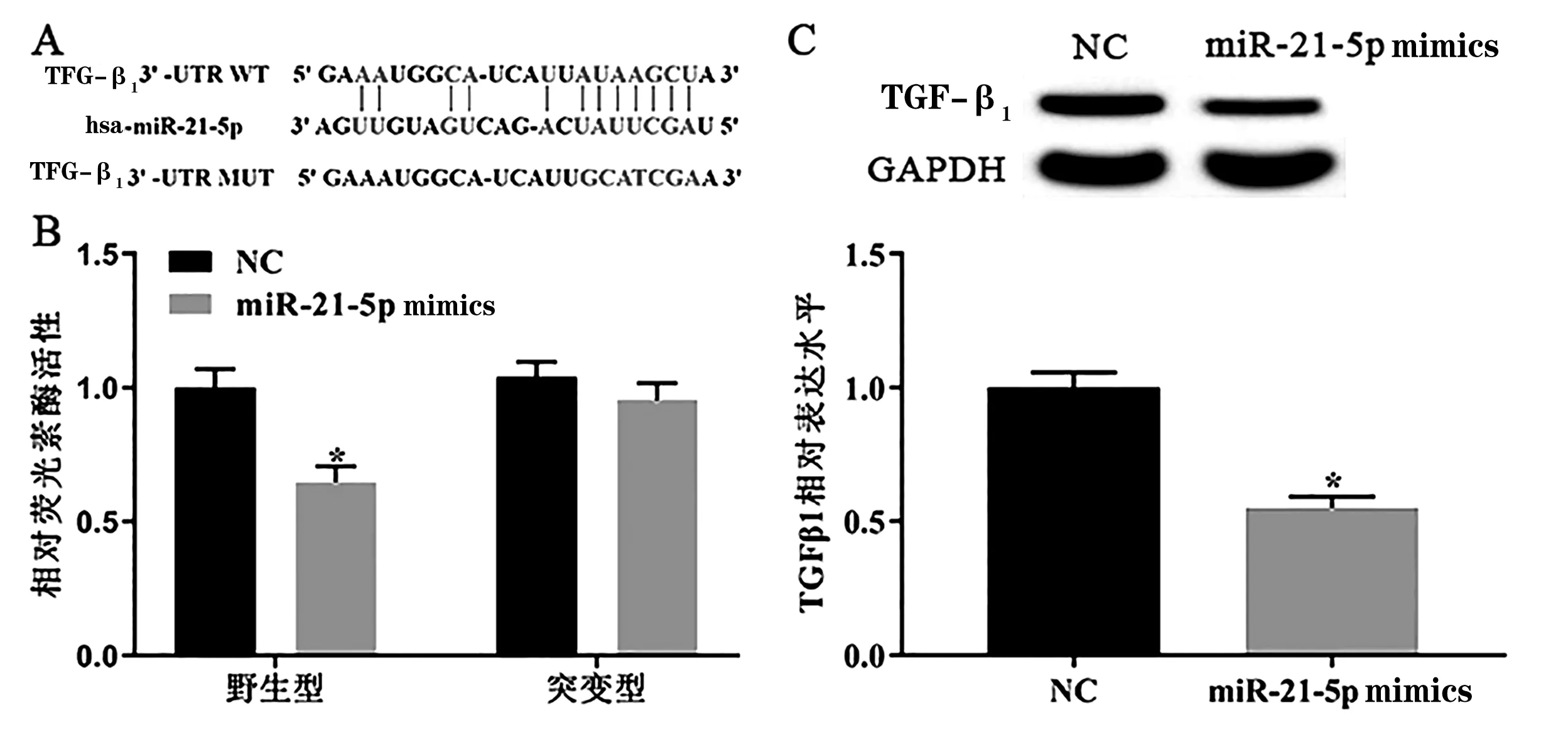
图2 miR-21-5p和TGF-β1的靶向关系
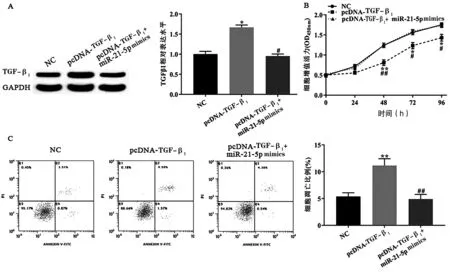
图3 miR-21-5p通过调控TGF-β1的表达水平对H9c2细胞增殖和凋亡的影响
3 讨论
心血管疾病是危害人类健康的主要疾患之一,具有发病率及病死率高等特点。AMI或者其他的心脏病会导致心肌细胞数量下降,进一步,心肌细胞被渐进性成纤维细胞替换,从而造成心肌肥大和左心室扩张,进而导致心脏功能下降,最终诱发心力衰竭而危及生命[7]。尽管,近些年的急诊PCI技术发展和广泛应用使得急性AMI的死亡率明显下降,但由于成年心脏心肌细胞几乎没有再生能力,从而最终会导致心力衰竭[8]。因此维持心肌细胞正常的结构和功能对于急性心肌梗死临床治疗的预后至关重要。
miRNA是由约21~23个核苷酸组成的非编码单链RNA分子,主要通过转录后的基因表达调控参与疾病的发生发展[9]。近年来大量研究发现,miRNA通路在心肌细胞的增殖和凋亡中起着重要的调控作用。如,miR-24-3p通过抑制Keap1/Nrf2通路,从而促进小鼠心肌细胞增殖并抑制其凋亡[10];高糖诱导miR-144表达上调,进而抑制CTRP3/JNK信号通路,从而抑制AC16心肌细胞的增殖并诱导其凋亡[4];间充质干细胞来源外泌体miR-21-5p通过PI3K信号通路上调心肌细胞的增殖并抑制其凋亡[11];此外,Tang等[5]发现,PGE1通过上调心肌细胞中miR-21-5p的表达水平,进而抑制FASLG促进心肌细胞的增殖并抑制其凋亡。本研究发现,敲降miR-21-5p能够显著抑制心肌H9c2细胞增殖并诱导其凋亡,该结果与Tang等[5]人研究一致,且本研究通过TargetScan数据库和双荧光素酶报告基因发现,miR-21-5p能够靶向负调控TGF-β1的表达水平。
TGF-β1是一种多效性和多向性的细胞因子,可通过自分泌或旁分泌的方式与细胞表面的受体信号进行应答,从而调节细胞增殖、分化和凋亡等生物学行为[12]。研究发现,TGF-β1在心肌细胞增殖、凋亡和成纤维化中扮演着重要的角色。如,β3-AR通过激活PKG/JNK/c-Jun信号通路上调TGF-β1的表达水平,从而抑制心肌细胞增殖并诱导其凋亡[13]。RyR-2上调心肌细胞中TGF-β1的表达水平,从而TGF-β1通过旁分泌机制促进了心脏成纤维细胞的胶原形成,进而导致心肌肥大和心肌收缩功能异常[14]。本研究发现,过表达TGF-β1后,H9c2心肌细胞增殖水平显著上升,此外,其凋亡水平下调,同时过表达miR-21-5p和TGF-β1能够恢复心肌H9c2细胞增殖和凋亡能力。
综上,本研究探讨了miR-21-5p通过TGF-β1对心肌H9c2细胞增殖和凋亡的作用机制。研究还发现,TGF-β1是miR-21-5p的靶基因,且miR-21-5p通过下调TGF-β1的表达水平,从而促进心肌H9c2细胞增殖并抑制其凋亡。
