染色盒同源物3对人结直肠癌细胞增殖的影响及其机制研究
2021-02-27张嘉琦贾佩琦苏东明
张嘉琦,贾佩琦,苏东明
0 引 言
结直肠癌是胃肠道中常见的恶性肿瘤,在我国其发病率近年不断上升。结直肠癌治疗选择多样且个体化,包括腹腔镜和手术局部切除、术前放疗、姑息化疗、靶向治疗和免疫治疗等等[1-3]。尽管如此,其治疗形势仍不乐观。部分与结直肠癌风险相关的癌症易感基因已被成功鉴定,但大多数导致发病的机制仍不清楚,有待进一步研究[4]。探讨结直肠癌发生发展的分子机制,寻找可靠的结直肠癌早期治疗靶点,仍旧是一个热点与难点。
染色盒同源物3(Chromebox3,CBX3),属于CBX蛋白家族,是一种异染色质蛋白,又被称为异染色质蛋白1γ(heterochromatin protein 1γ, HP1γ),存在于哺乳动物体内。CBX3已被证实在肺腺癌、宫颈癌、乳腺癌、结直肠癌等多种癌症中表达存在不同程度的上调,特别是结直肠癌中,已有研究证实miR-30a靶向CBX3,在小鼠异种移植模型中特异性地抑制结直肠癌细胞的生长[5],说明CBX3在结直肠癌发生发展中发挥重要作用,而其可能涉及到的下游机制还未被完全阐明,有待进一步的研究。本研究旨在探讨CBX3在结直肠癌中的表达,及其对结直肠癌细胞增殖的影响,并初步研究其下游作用机制,以期为结直肠癌治疗提供新的思路。
1 材料与方法
1.1 材料人正常结肠上皮细胞系(NCM460)及人结直肠癌细胞系(HCT116、HT29、SW620)购自美国模式培养物集存库(American type culture collection,ATCC)公司。16例结直肠癌患者组织样本及其配对癌旁组织样本来自南京医科大学附属逸夫医院病理科,病理诊断均为腺癌。
1.2 研究方法
1.2.1 生物信息学分析利用基因表达谱交互分析(GEPIA)数据库(http://gepia.pku.cn/)分析CBX3在各个类型癌症中癌组织及癌旁组织的表达情况,并对TCGA数据集内270例结直肠癌患者进行生存期分析,Kaplan-Meier生存曲线评估CBX3表达与结直肠癌生存结果之间的相关性;利用Oncomine数据库(https://www.oncomine.org/)分析CBX3基因在结直肠癌中表达差异,阈值的确定依据如下值:P值为0.0001,倍数变化为2,各基因排序;利用LinkedOmics数据库(http://www.linkedomics. org/login.php)筛选CBX3相关基因并进行京都基因与基因组百科全书通路(Kyoto Encyclopedia of Genes and Genomes Pathway,KEGG通路)富集分析。
1.2.2 免疫组织化学染色使用链霉菌生物素-过氧化物酶法(SP法)对收集的16例结直肠癌配对标本进行免疫组织化学染色。兔抗人CBX3抗体购自英国Abcam公司,鼠兔通用型二抗及浓缩型DAB购自北京中山金桥公司。染色结果由2位病理医师独立评分并进行统计,根据CBX3表达量,阴性0分,弱阳性1分,阳性2分,强阳性3分。
1.2.3 细胞培养人正常结肠上皮细胞NCM460,人结肠癌细胞系HCT116、HT29、SW620,均使用含10%胎牛血清的1640培养基进行培养。培养条件为:95%空气,5%二氧化碳,37 ℃,培养箱湿度70%~80%。
1.2.4 Western blot检测蛋白表达量收取正常结肠上皮细胞NCM460和结直肠癌细胞HCT116、HT29、SW620的细胞总蛋白进行Western blot实验。使用10%或12%的SDS-PAGE胶进行蛋白质电泳,每孔上样量20 μg。湿转法将蛋白质转到PVDF膜上,室温下5%的脱脂奶粉溶液封闭2 h。分别加入一抗4 ℃过夜,次日二抗室温孵育1~2 h。在摇床上进行以上操作,每个步骤之间用TBST洗膜10 min×3次,最后加ECL超敏发光液暗室内曝光,拍照并进行灰度分析。
1.2.5 结直肠癌细胞转染CBX3过表达质粒购自南京诺唯赞生物科技有限公司,CBX3特异性小干扰购自上海吉玛制药技术有限公司。用于转染的质粒载体经DNA Mini-prep(QIAGEN公司,德国)提取。按照脂质体核酸转染试剂使用说明书(上海翊圣生物科技有限公司)将CBX3过表达质粒(记作CBX3-OE组)、空载质粒(记作Vector组),或特异性小干扰(共三组序列,后续实验使用si-1、si-2及si-3混合组进行,记作CBX3-RNAi组)、无义序列(同记作Vector组)转染至6孔板上培养的结直肠癌细胞。24 h后用于增殖实验;48 h后收集细胞用于Western blot实验。
1.2.6 细胞增殖实验采用SRB实验及克隆形成实验来观察细胞增殖情况。用含10%胎牛血清的培养基悬浮细胞并计数,在96孔板中每孔接种3000个细胞,完全培养基体积200 μL,分别于24 h、48 h、72 h和96 h收取细胞进行SRB染色,检测515 nm波长处吸光值;在六孔板中每孔接种300~500个细胞,培养10~14 d,肉眼可见细胞克隆时,进行结晶紫染色后拍照,镜下计数克隆数目。
1.2.7 实时荧光定量PCR(qRT-PCR)HCT116细胞转染特异性小干扰及无义序列后,提取RNA,按照逆转录试剂盒(美国Qiagen 公司)说明书进行逆转录,获得cDNA,存于-20 ℃。订购CBX3及CEBPD(CCAAT/enhancer-binding protein delta,CCAAT/增强子结合蛋白delta)引物,按照qRT-PCR标准体系加样,在实时定量PCR仪(ABI公司,美国)上运行程序。CBX3及CEBPD相对于GAPDH的表达使用2-ΔΔCt法计算和标准化。
1.2.8 转录组测序选取HCT116细胞系,利用siRNA敲低CBX3表达,对CBX3敲低组及其对照组进行转录组测序。测序后,对2组间基因表达量进行差异分析,筛选出显著差异基因并制作热图。
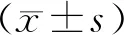
2 结 果
2.1 生物信息学分析
2.1.1 数据库分析CBX3表达及其与生存期关系GEPIA数据库分析显示,CBX3在多种癌症中呈现高表达,尤其在结肠癌与直肠癌中,CBX3显著高表达,见图1。在Oncomine数据库中,CBX3的mRNA表达水平明显高于正常组织(P<0.01)。上述结果提示CBX3表达水平在结直肠癌中明显升高。Kaplan-Meier生存曲线显示,高表达CBX3的患者无病生存期低于低表达组(log-rank检验,P=0.034),提示CBX3高表达与低生存率相关,见图2。
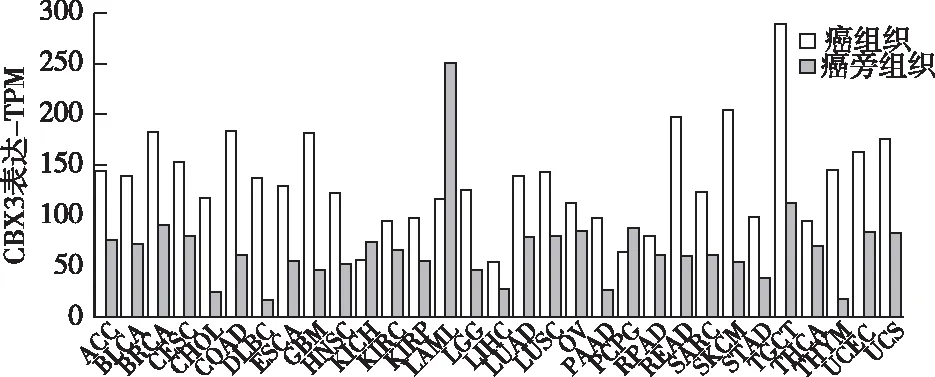
图1 GEPIA数据库分析CBX3在癌症特别是结直肠癌中表达水平
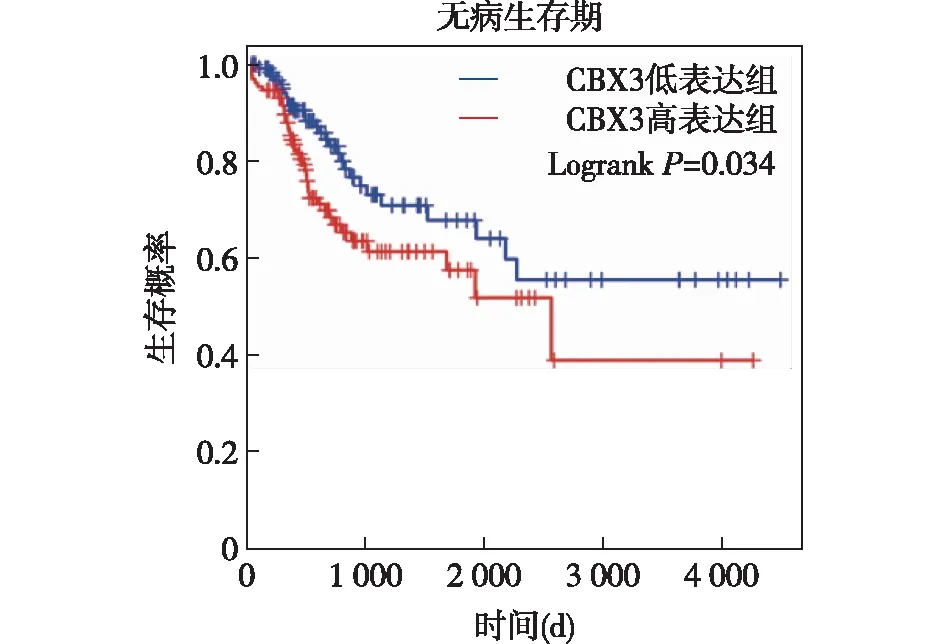
图2 CBX3表达水平与无病生存期关系
2.1.2 CBX3共表达网络研究KEGG通路分析结果显示,CBX3相关基因在核糖体、剪接体、蛋白酶体、RNA运输及降解、错配修复、细胞周期、Th17细胞分化、T细胞受体信号等多种途径富集,表明CBX3对转录组的影响广泛且复杂。
2.2 结直肠癌组织及细胞中CBX3表达水平免疫组织化学染色结果显示,CBX3主要定位于细胞核中,且在肿瘤组织中的表达明显高于对应癌旁组织,染色结果进行评分统计,差异具有统计学意义(P<0.0001),见图3。Western blot实验表明,CBX3在各结直肠癌细胞系中蛋白表达量显著高于正常结肠上皮细胞系,见图4。
*P<0.01图4 Western blot检测结直肠癌细胞系中CBX3蛋白相对表达量(n=3)
2.3 CBX3对结直肠癌细胞增殖的影响Western blot结果显示过表达及敲低效率显著,见图5。SRB实验结果显示,与Vector组相比,CBX3-OE组细胞增殖速率明显上升,CBX3-RNAi组细胞增殖速率明显下降;克隆形成实验结果显示,与Vector组相比,CBX3-OE组细胞克隆形成数量明显增多,CBX3-RNAi组克隆形成数目明显减少;见图6。以上结果提示CBX3能够促进HCT116细胞的增殖。
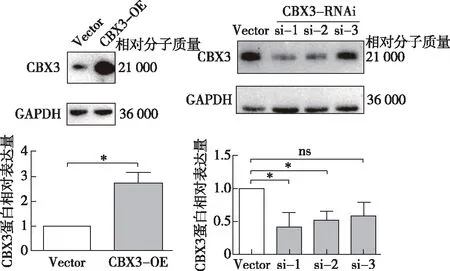
*P<0.05图5 Western blot验证CBX3过表达或敲低效率(n=3)
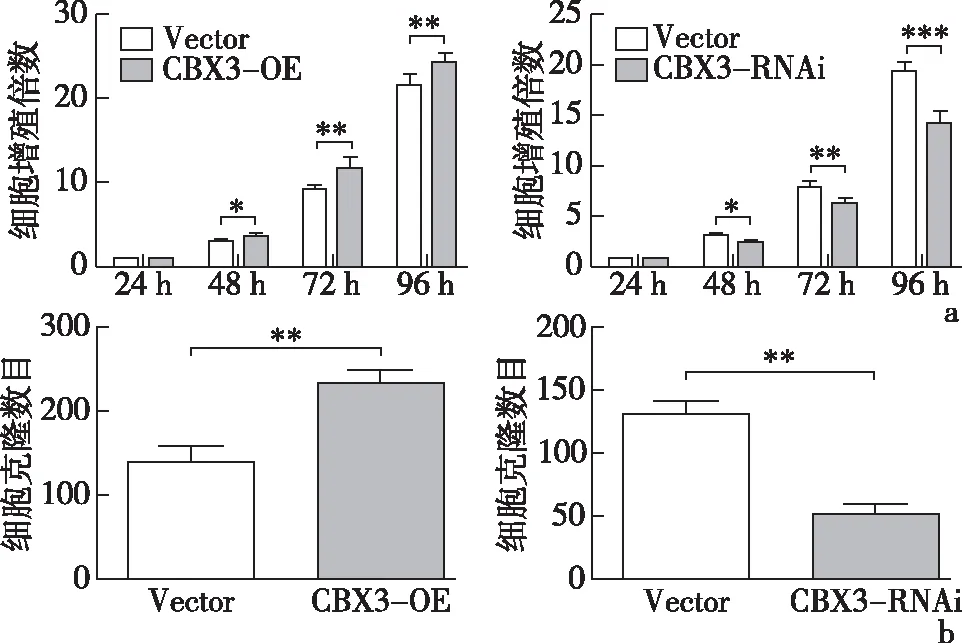
a:SRB实验(与24 h相比);b:克隆形成实验*P<0.05、**P<0.01、***P<0.001图6 SRB实验及克隆形成实验检测细胞增殖能力(n=3)
2.4 敲低CBX3后对CEBPD表达的影响转录组测序筛选差异基因热图见图7a,查阅其基因功能最终选取CEBPD、ADAM9、NT5E进行后续实验。qRT-PCR结果显示,敲低CBX3后,CEBPD mRNA水平显著升高,见图7b。Western blot结果显示,CEBPD蛋白水平也相应升高,见图8a。GEPIA数据库中CBX3与CEBPD相关性分析提示两者存在负性相关,见图8b。以上结果提示,CBX3的促癌作用可能通过抑制下游CEBPD的表达来实现。
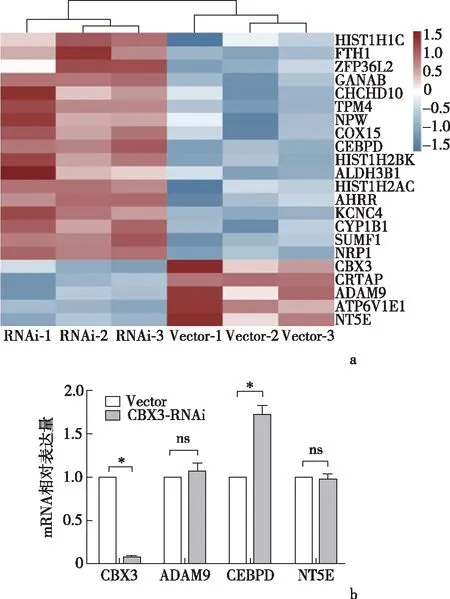
a:转录组测序差异基因热图;b:qRT-PCR检测差异基因表达*P<0.001图7 转录组测序筛选差异基因并进行验证(n=3)
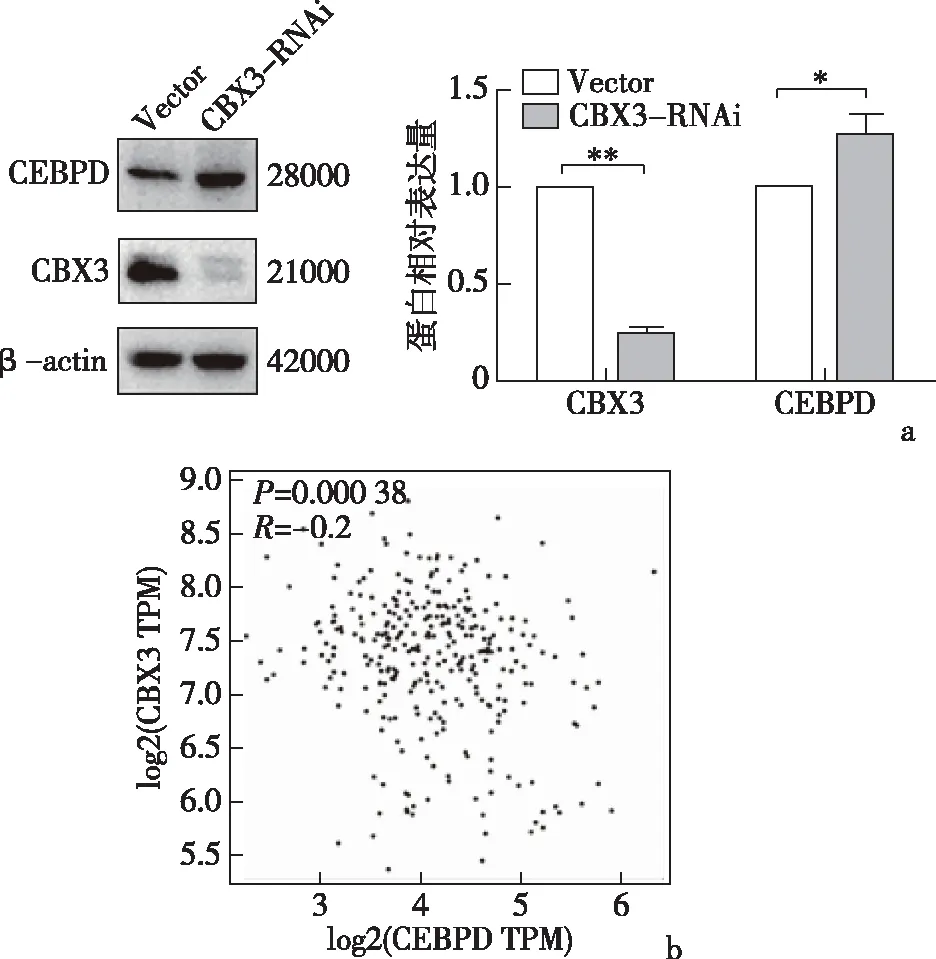
a:Western blot检测CEBPD蛋白相对表达量;b:CBX3与CEBPD相关性分析(GEPIA)*P<0.05、**P<0.001图8 Western blot检测CEBPD表达水平(n=3)
3 讨 论
CBX3蛋白属于CBX蛋白家族,与其结构相似的还有CBX1和CBX5,均属于异染色质蛋白。已知异染色质蛋白高度保守并参与细胞功能,包括DNA复制和修复[6]、转录调控[7]和RNA拼接[8]、细胞分化[9-10]、细胞周期和细胞分裂调控[11]、着丝粒和端粒内环境稳定[12]等。而不同的亚型又具有各自独特的功能,本课题重点关注CBX3的功能及机制。
前期调研发现,CBX3与多种癌症相关,例如,有研究显示CBX3的体内敲低减少了K-RasG12D诱导的肺腺癌的发生,延长了K-RasG12D诱导的肺腺癌小鼠的存活期[13];有关胰腺癌的研究中发现,CBX3的过度表达可以诱导胰腺癌细胞的体外增殖、无锚定生长、迁移和侵袭等等[14]。课题组通过生物信息学分析,明确了CBX3在多种癌症中均呈现高表达,尤其在结直肠癌中,CBX3表达显著升高且与预后相关。KEGG通路分析提示,CBX3可能通过蛋白酶体、RNA运输及降解、错配修复、细胞周期等途径影响结直肠癌的发生发展,从而发挥积极的促癌作用。
后续研究中,利用免疫组织化学染色及Western blot实验,确认了CBX3在结直肠癌组织中及细胞中均显著高表达。通过在结直肠癌细胞中过表达或敲低CBX3证明了CBX3能够促进结直肠癌细胞的体外增殖。在此基础上进一步进行转录组测序,以期能够找到CBX3促进结直肠癌细胞增殖的下游分子机制。
通过转录组测序,在敲低CBX3后,课题组发现多个癌症相关因子表达发生改变,其中CEBPD表达明显升高。CEBPD是一种转录因子,由单个外显子CEBPD基因编码,能够调控细胞分化、运动、生长停滞、增殖和死亡等多种生物学过程。有研究显示,紫草素对银屑病局部皮损JAK/STAT3信号通路有明显抑制作用,并增加CEBPD的表达,从而显著抑制细胞增殖并诱导凋亡[15]。而另有研究证实,CBX3敲低可以导致骨肉瘤细胞中G0和G1期的凋亡增加和细胞周期停滞[16],提示CBX3与细胞凋亡途径密切相关。通过GEPIA数据库对CBX3和CEBPD进行相关性分析,发现两者存在负性相关,因此推测,CBX3可能通过抑制CEBPD表达从而进一步抑制细胞凋亡,在结直肠癌中发挥促癌作用。但两者之间具体的作用机制还未完全明确,有待进一步研究与完善。
综上所述,本课题组在细胞水平验证了CBX3能够促进结直肠癌细胞的增殖,并发现这种促进作用可能是通过抑制CEBPD转录因子的表达而实现的,从而为基于CBX3为靶标的结直肠癌早期诊疗提供了新思路。
