改良儿科营养风险筛查工具的临床应用
2021-02-26李心仪黄晟周洪敏周明明吴晓娜
李心仪 黄晟 周洪敏 周明明 吴晓娜
(1.四川大学华西第二医院临床营养科,四川成都 610041;2.出生缺陷与相关妇儿疾病教育部重点实验室,四川成都 610041;3. 四川大学华西第二医院信息管理部,四川成都 610041)
规范的儿童营养管理包括及时的营养风险筛查,完整的营养评估及合理的营养支持治疗[1]。近年来,规范的营养管理已成为临床诊疗中不可忽视的一部分,可辅助临床治疗,促进患儿康复[2]。其中营养风险筛查可以在入院初期快速、简便地发现患儿是否存在营养风险,营养风险筛查结果对后续的营养评估和营养支持治疗都具有指导意义[3],是规范营养管理的第一步。我国住院患儿营养风险发生率为57.28%~81.26%[4-6]。高营养风险预示患儿发生营养不良的风险高,影响患儿的体格生长和智力发育,增加不良预后的风险[4,7]。改良儿科营养风险筛查工具由中华医学会肠内肠外营养学分会儿科学组专家制定,疾病谱更符合中国住院患儿,已初步验证其可有效识别住院患儿营养风险,且可较好地预测临床结局[8-9]。本研究对住院患儿的入院营养风险筛查和营养状况进行横断面研究,为改良儿科营养风险筛查工具的应用提供临床依据,并探讨营养风险筛查工具使用对临床营养工作开展的作用及意义,促进儿科规范化营养管理流程的建立。
1 资料与方法
1.1 研究对象
回顾性收集2018年10月至2019年7月四川大学华西第二医院16 249例住院患儿资料,男性8 653例(53.25%),女性7 596例(46.75%)。纳入标准:(1)纳入年龄为1月龄至18周岁;(2)住院时间≥24 h。排除标准:(1)入住重症监护室患儿(因国内外现有的儿童营养风险筛查工具均不推荐用于重症患儿)[10];(2)入住儿科急诊留观室的患儿;(3)无法准确测量身高(长)及体重的患儿,如水肿、脱水等。
1.2 改良儿科营养风险筛查工具
改良儿科营养风险筛查工具综合我国住院患儿的具体情况及疾病种类,包括疾病、饮食和人体测量3部分,3项评分总和为营养风险筛查结果,见表1。根据改良儿科营养风险筛查工具评分将每个年龄段患儿各分为3组:0~1分为无营养风险组,2~3分为中营养风险组,≥4分为高营养风险组。对无营养风险组、中营养风险组患儿每7 d重复进行营养风险筛查,对高营养风险组患儿依临床需求进行后续的营养及膳食评估,并给予营养支持治疗[8]。将改良儿科营养风险筛查工具整合至医院信息系统,由经过营养风险筛查技能培训的护理人员在患儿入院24 h内完成;营养师定期进行营养风险筛查质量控制。

表1 改良儿科营养风险筛查工具评分标准
1.3 营养状况评估
本研究中,对所有纳入患儿进行入院营养评估。儿童营养不良定义为营养需求和摄入之间的不平衡,从而导致能量、蛋白质或微量营养素累积不足,并可能影响儿童生长发育和其他相关不良后果[11]。儿童营养过剩分为超重和肥胖,是由能量摄入大于机体需求所致的体脂过量囤积[12]。儿童营养评估金标准依据世界卫生组织(WHO)公布的正常儿童及青少年生长标准。患儿入院24 h内测量身高(长)、体重。体重精确至0.1 kg,身长/身高精确至0.1 cm。5岁整(60月龄)及以下住院患儿按WHO 2006年发布的年龄别体重Z评分评估营养状况[13];5岁(61月龄起)至18岁住院患儿按WHO 2007年发布的年龄别体重指数Z评分评估营养状况[14]。Z评分<-1 SD为轻度营养不良;<-2 SD为中度营养不良;<-3 SD为重度营养不良;>+1 SD为超重;>+2 SD为肥胖。
1.4 营养支持治疗
营养支持遵循五阶梯治疗原则,依患儿病情按晋级/降级顺序选择营养教育、口服营养补充、全肠内营养、肠内联合肠外营养及全肠外营养,当现阶梯营养支持不能满足60%目标能量需求3~5 d时,选择上一阶梯营养治疗方式[15]。
1.5 统计学分析
采用SPSS 20.0统计软件进行数据分析。正态分布资料用均数±标准差()表示,非正态分布资料用中位数(四分位数间距)[M(Q1,Q3)]表示。计数资料用例数和百分率(%)表示,率的比较采用检验。Cramer'sV是χ2检验中的相关系数的修正值,可对2×2以上的表格进行相关性强度分析,当Cramer'sV<0.3,则相关性较弱;当0.3≤Cramer'sV<0.5,则为中强度相关;Cramer'sV≥0.5,则相关性较强[16]。采用Spearman进行相关性分析。P<0.05为差异有统计学意义。
2 结果
2.1 住院患儿疾病分布情况
本研究共收集16 249例患儿资料,中位入院年龄4.7(1.6,8.9)岁,其中5岁以下8 396例(51.67%),5岁及以上7 853例(48.33%)。按入院诊断分类,合并多系统疾病者以入院后第一诊断分类。血液系统疾病患儿2 213例(13.62%),心血管系统疾病2 549例(15.69%),消化系统疾病987例(6.07%),肾脏疾病2 779例(17.10%),神经系统疾病2 528例(15.56%),内分泌及遗传代谢疾病3 041例(18.71%),呼吸系统疾病945例(5.82%),免疫系统疾病1 207例(7.43%)。
2.2 住院患儿营养风险发生率
住院患儿营养风险发生率为30.27%(4 918/16 249),其中高营养风险588例(3.62%),中营养风险4 330例(26.65%),无营养风险11 331例(69.73%)。
2.3 住院患儿营养评估及营养风险的相关性分析
对所有住院患儿进行营养评估,营养不良发生率为27.37%(4 448/16 249),其中重度营养不良发生率为2.01%(326/16 249);营养过剩发生率为11.29%(1 834/16 249),其中肥胖发生率为3.75%(609/16 249)。
对不同营养风险程度患儿的营养状况分析,结果显示5岁及以上患儿,营养不良发生率及营养过剩发生率均随营养风险程度的升高而升高,且营养风险程度与营养状况存在线性相关性(P<0.05),见表 2。5岁以下患儿,营养不良发生率高于5岁及以上患儿(χ2=72.296,P<0.001),营养过剩发生率低于5岁及以上患儿(χ2=301.962,P<0.001)。高营养风险组患儿的营养不良发生率高于无、中营养风险组患儿,营养风险程度与营养状况存在线性相关性(P<0.05),见表3。
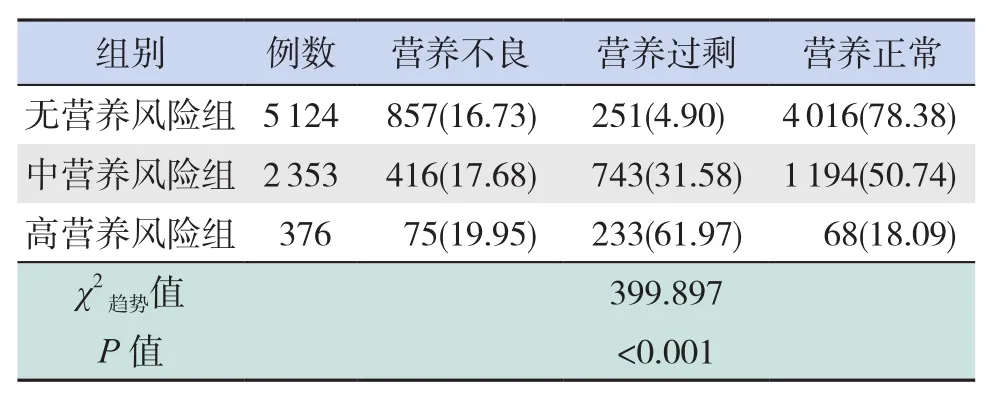
表2 ≥5岁儿童不同营养风险组营养评估结果比较[例(%)]
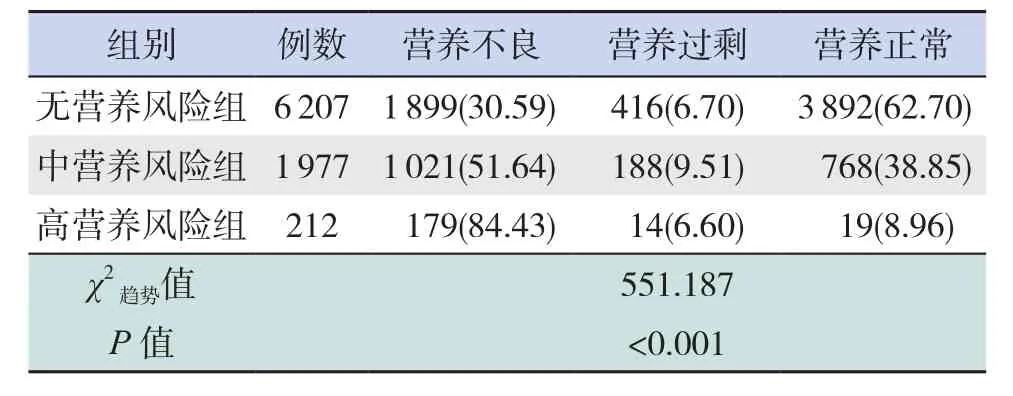
表3 <5岁儿童不同营养风险组营养评估结果比较[例(%)]
5岁及以上住院患儿的入院年龄别体重指数Z评分与营养风险分数存在正相关性(rs=0.313,P<0.001),5岁以下住院患儿的入院年龄别体重Z评分与营养风险分数存在负相关性(rs=-0.304,P<0.001)。
2.4 营养风险各项评分项目构成分析
疾病情况对中营养风险组及高营养风险组患儿评分影响较大,分别占91.32%和99.66%;饮食因素及人体测量指标主要影响高营养风险组患儿评分,分别占53.74%和89.62%。疾病情况与患儿营养风险存在高强度相关(Cramer'sV>0.5,PV<0.05),饮食情况与营养风险存在中强度相关(Cramer'sV>0.3,PV<0.05),人体测量项目与患儿营养风险存在中强度相关(Cramer'sV>0.3,PV<0.05),见表 4~6。
2.5 营养风险筛查对营养管理工作开展的影响
我院儿科于2017年10月开始在部分科室进行入院患儿营养风险筛查工作,2018年10月起营养风险筛查工作全院覆盖。随着营养风险筛查工作在儿科病房开展,具有营养风险的患儿接受营养支持治疗率逐年升高,且差异有统计学意义(P<0.05),见表 7。
对2018年10月至2019年7月不同科室存在营养风险住院患儿的营养支持治疗情况进行分析,获得营养支持治疗的患儿740人,占15.05%,其中饮食指导196例,口服营养补充170例,肠内联合肠外营养102例,全肠外营养119例,全肠内营养153例,全肠外: 全肠内营养支持为0.78 : 1(表8)。

表4 疾病情况在各营养风险组的评分情况 [例(%)]
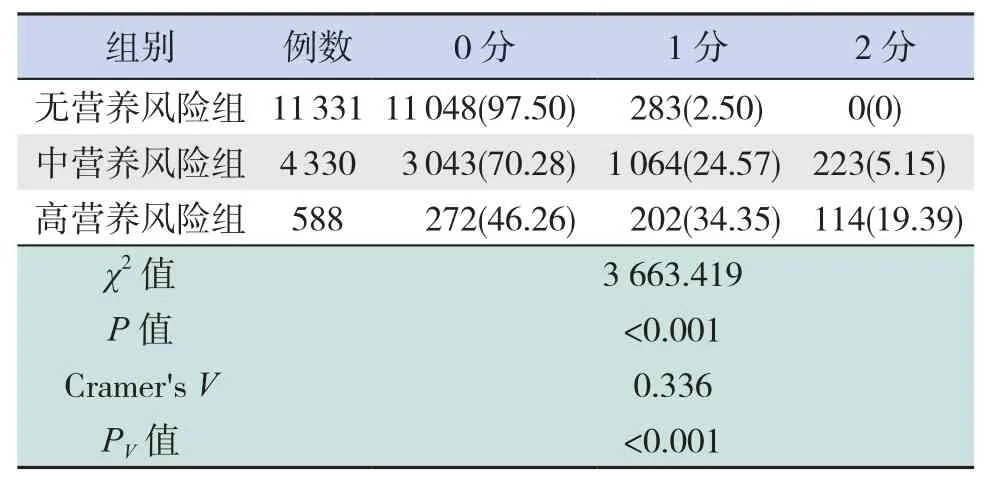
表5 饮食情况在各营养风险组的评分情况 [例(%)]
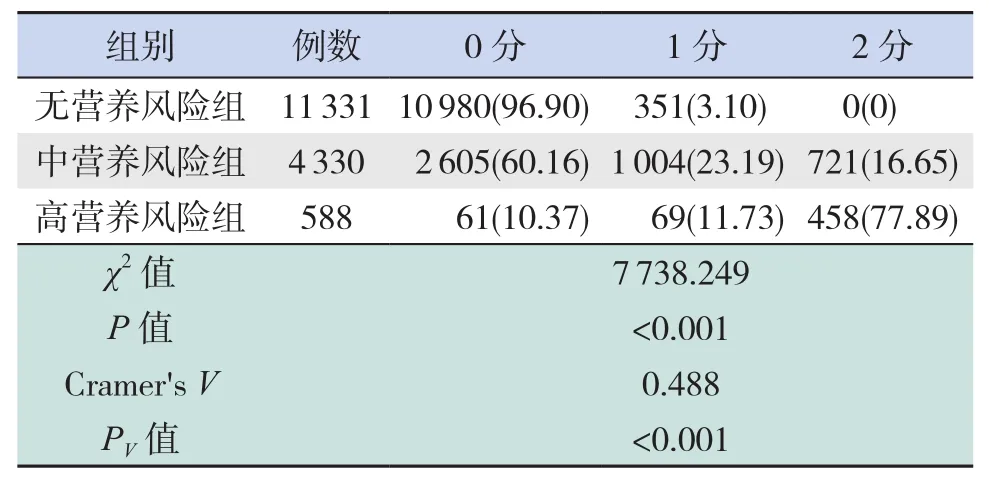
表6 人体测量在各营养风险组的评分情况 [例(%)]
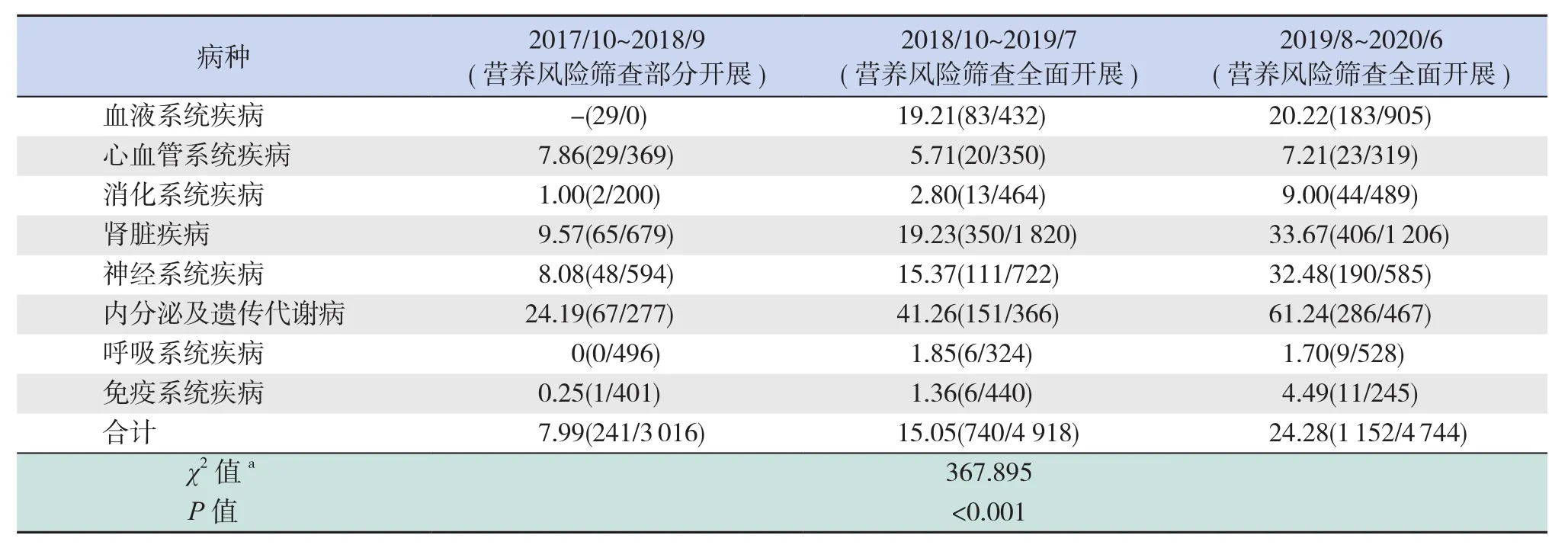
表7 营养风险筛查工作全面开展前后住院患儿营养支持率 [%(n/N)]
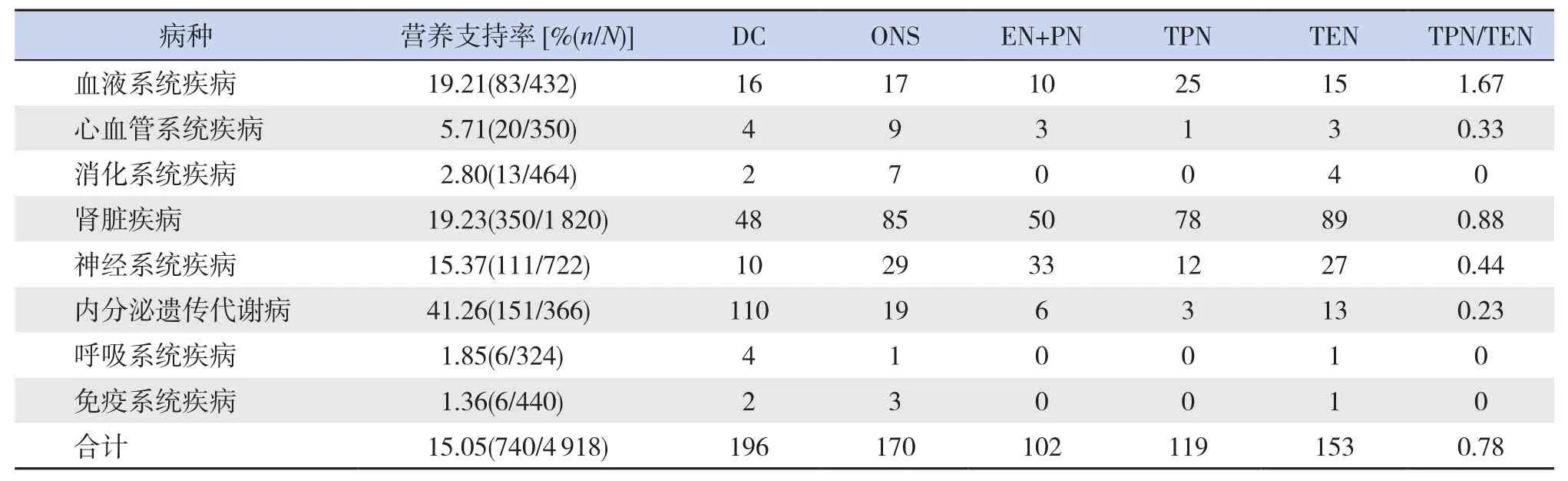
表8 2018年10月至2019年7月各儿科科室营养支持情况
3 讨论
建立规范的儿科营养管理体系,在患儿入院时及时进行营养风险筛查、准确营养评估及适当的营养支持是十分必要的。本研究采用改良儿科营养风险筛查工具,发现住院患儿营养风险发生率为30.27%,其中高营养风险发生率为3.62%,较国内报道营养风险发生率小[4-6],其可能原因是本研究未纳入外科患儿资料。本研究中,住院患儿营养不良为27.37%,营养过剩(包括超重和肥胖)为11.29%。国外研究报道的住院患儿营养不良发生率在19.7%~41.2%[17-19],但国内外针对营养过剩报道均较少。
此外,本研究同时对入院患儿进行营养筛查和营养评估,5岁及以上患儿中,营养不良及营养过剩发生率均随营养风险程度的增加而升高,该结果与于圣娟[20]及何冰洁[21]的结果一致,但两项研究仅讨论了营养不良与营养风险的关系。本研究中,5岁以下患儿各营养风险程度间营养不良发生率均高于5岁及以上患儿,而营养过剩发生率低于5岁及以上患儿,可能由于较小患儿更易因疾病或喂养不当而影响生长发育,而较大患儿更容易存在暴饮暴食、偏爱高热量食物等不良饮食行为问题,从而导致营养过剩。5岁及以上和5岁以下的营养风险与营养状况分别存在正、负相关性,说明5岁及以上患儿随着入院营养风险分数的增加,营养过剩的发生率逐渐超过营养不良的发生率,而5岁以下患儿则随入院营养风险分数的增加,营养不良的问题较营养过剩显著。目前,国内外针对住院患儿营养过剩的探讨仍然欠缺,本研究发现营养过剩也是导致住院患儿营养风险的重要原因,因加以重视。
不同营养风险组间,导致营养风险的影响因素也存在差异,因此营养风险筛查也对制订合理的营养治疗方案提供依据。疾病诊断是中营养风险患儿的主要影响因素,占91.32%,仅有少部分患儿存在自身发育异常(39.84%)和/或饮食受限(29.72%)。高营养风险组的患儿,往往受疾病(99.66%)、饮食(53.74%)和自身营养状况(89.62%)多方面影响。不同疾病患儿的营养风险发生率存在显著差异[7-8]。患儿自身营养状况不佳预示着不良临床结局,如住院天数的延长、住院费用的增加及并发症发生率等[8]。住院患儿能量及蛋白质的摄入普遍低于推荐膳食营养供给量,且膳食搭配不合理普遍存在[22],高营养风险的患儿可能因疾病更危重,自身营养状况较差,加重影响患儿进食或导致患儿无法经口进食。因此,营养风险筛查可指导更精准化的营养管理,以降低患儿因营养问题造成不良临床结局的概率[23]。
我院自开展儿科营养风险筛查工作以来,存在营养风险患儿的接受营养支持治疗率逐年增长,且存在统计学意义,但还需进一步努力,让更多存在营养风险的患儿能得到及时合理的营养支持治疗。建立规范的住院患儿营养管理流程,将改良儿科营养风险筛查工具纳入住院患儿营养管理体系,可促进医生、患儿及其家属对营养治疗的重视程度。同时,综合营养风险筛查及营养评估的结果后,可以对患儿因地制宜地采取营养支持治疗手段,规范肠内和肠外营养的使用[24]。我院患儿接受全肠外 : 全肠内营养支持为0.78 : 1,低于其他研究报道(2.0 : 1~8.7 : 1)[25-27],符合营养支持治疗的阶梯模式。其中血液系统及肾脏系统疾病患儿接受全肠外营养支持比例较高,主要为接受培门冬酶化疗后及患肾病综合征合并急性胰腺炎的禁食患儿,今后我们将尝试为急性胰腺炎的患儿安置空肠管,以实现急性胰腺炎早期肠内喂养,缩短全肠外营养支持周期[28]。其次为过敏性紫癜(腹型)的禁食患儿,该类患儿禁食时间较短,大多可在2~5 d启用肠内营养支持。
目前,国际上儿科营养风险筛查工具均存在一定缺陷,没有统一标准,限制了它们在临床大规模的应用。改良儿科营养风险筛查工具与国外已有的筛查工具类似,但病种列出更详细、具体,使用时指导性和准确性更强,有较高的灵敏度和特异度[8],能够有效地筛查营养风险,但大范围应用仍需更多循证依据。本次研究初步探讨了改良儿科营养风险筛查工具在儿科营养治疗中的应用,及营养风险筛查工作的临床意义,该工具使用可促进规范化儿童营养管理工作的开展,提高营养支持治疗的精准性及有效性。
