香水白掌的组培快繁技术研究
2021-02-26张晓纲霍慧敏曹冬梅
梁 峥,张晓纲,霍慧敏,张 超,曹冬梅
(1.山西省农业科学院园艺研究所,太原 030001;2.山西大宁隆泰双创农林科技有限公司,山西 大宁 042300)
香水白掌(Spathiphyllumpatinii)原产于哥伦比亚热带雨林,属天南星科白鹤芋属多年生观叶草本。其佛焰苞洁白开展,有微香,植株姿态清新悦目,叶墨绿挺拔,观赏期长又极耐阴,非常适合室内栽培[1],加之有一定的净化室内甲醛等有害气体的作用,深受消费者欢迎[2-4]。白掌属植物栽培自20世纪初应用于盆栽观赏,80年代广泛流行,目前盆栽白掌的年销售额位列荷兰盆花生产的第九位[5]。
香水白掌的花粉退化严重,栽培不易结籽[6-7],生产上主要通过分株的方法进行繁殖[8]。近年来,白掌类盆花的需求逐年上升,而周期长、数量少的分株繁殖方式已经不能适应市场需求,目前已有许多生产商把目光转向增殖系数更大、种苗质量更高的组培快繁生产方式[9-10]。
关于白掌类观叶植物工厂化栽培已有不少报道[10-15],但针对香水白掌进行的组培快繁技术报道鲜见[16]。本研究以香水品种茎段为试材,通过外植体消毒、不定芽的诱导、增殖、生根等试验,用统计分析的方法深入探讨相关技术要点,最终建立香水白掌的最适组培快繁体系,以期为其种苗的规模化生产提供理论依据和技术支持。
1 材料与方法
1.1 材 料
供试材料为12 cm盆径香水白掌,植株生长健壮,无病虫害,购自太原市鑫隆腾花卉市场。
1.2 方 法
1.2.1外植体消毒
取香水白掌幼嫩茎段,去除叶片,留叶柄,用带有顶端生长点的茎段作为外植体材料。将茎段切取约1 cm,置于烧杯中,滴加少许洗洁精后流水冲洗0.5~3 h。然后将外植体投入0.05% NaClO处理0~20 min,无菌水冲洗1次。将冲洗后的外植体置超净工作台,用75%酒精消毒2~15 min,无菌水冲洗1次。使用0.1% HgCl2消毒5~20 min。无菌水冲洗4次,每次3 min。为探究以上主要步骤中处理时间对消毒效率的影响,安排四因素四水平正交试验(表1)。将消毒后的外植体切去茎段下部边缘部分,留0.5 cm左右,生理向上置入MS培养基上培养,每种处理接种20瓶,每瓶3个茎段,重复3次。培养温度25 ℃,光照强度2 000 lx,每天光照12 h,30 d后观察记录污染率、褐化率和成活率(成活率(%)=(1-污染率-褐化率)×100%)。试验方案选择及试验结果见表5。
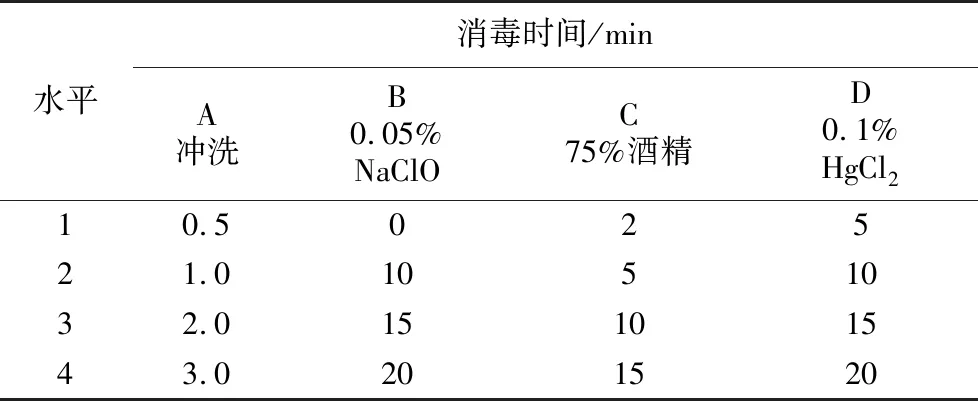
表1 外植体消毒方法的正交因素水平Table 1 Orthogonal factor level of explant disinfection method
1.2.2初培培养基的筛选
将经过最适外植体消毒方法处理的外植体,接种于含有不同激素配比的初培培养基中,在不同的光照和温度条件下培养。安排四因素四水平(表2)正交试验,探究初培培养条件对诱导愈伤组织和不定芽的影响。每种处理接种20瓶,每瓶3个茎段,重复3次,每日光照12 h,30 d后统计不定芽和愈伤组织的诱导情况。试验方案选择及试验结果见表7。
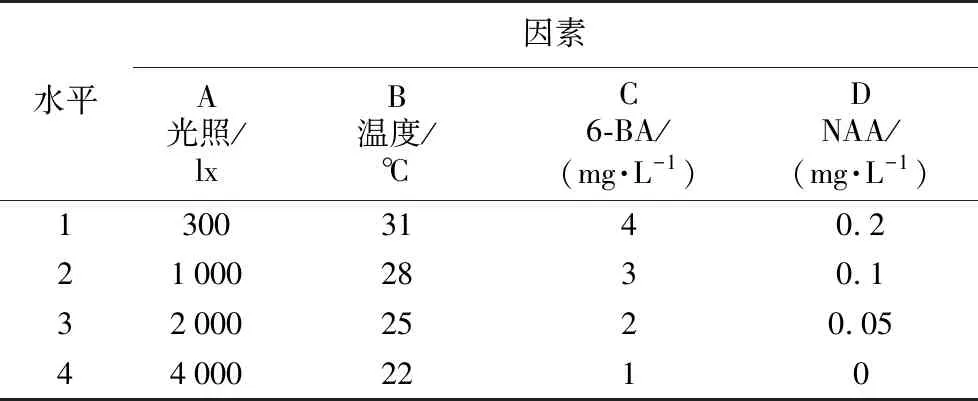
表2 初培培养条件的正交因素水平Table 2 Orthogonal factor level of initial culture condition
1.2.3不定芽的增殖培养
将优化的初培条件下培养的,生长状况相同的不定芽置入不同激素组合的增殖培养基上。安排四因素四水平(表3)正交试验,探究不同培养条件对不定芽增殖效果的影响。每种处理接种20瓶,每瓶3个茎段,重复3次,每日光照12 h,光照强度2 000 lx,30 d后观察统计不定芽增殖情况,计算其增殖系数。
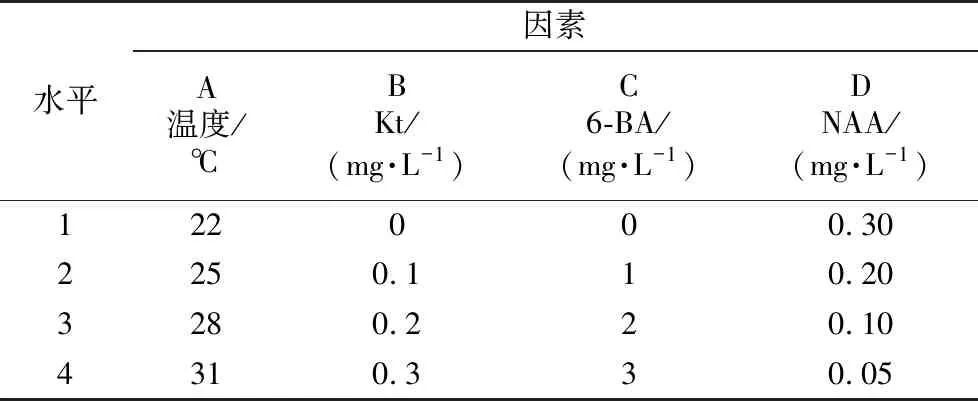
表3 不定芽增殖培养条件的正交因素水平Table 3 Orthogonal factor level of adventitious bud proliferation culture
增殖系数=(增殖培养后的芽数/接种芽数)×100%。
试验方案选择及试验结果见表9。
1.2.4生根培养
取优化的不定芽增殖培养条件下、生长状况健康一致的幼苗,分别继代于含有不同浓度大量元素和不同激素组合的生根培养基上。安排四因素二水平(表4)完全随机试验,探究不同培养条件对生根效果的影响。每种处理接种20瓶,每瓶3个幼苗,重复3次,每日光照12 h,光照强度2 000 lx,30 d后观察统计生根情况。试验方案选择及试验结果见表10。

表4 生根培养条件的正交因素水平Table 4 Orthogonal factor level of rooting culture
2 结果与分析
2.1 外植体消毒
采用L16(45)正交试验进行外植体消毒,设第5列为误差列,试验方案及结果见表5。极差分析结果(表5)表明,所试范围内各因素对污染率的影响主次顺序为0.1% HgCl2>冲洗>0.05% NaClO>75%酒精。污染率随0.1% HgCl2处理时间增加而明显减小,在15 min水平和20 min水平变化不明显;随冲洗时间增加而减小,2 h水平与3 h水平变化不明显;随0.05% NaClO处理时间增加小幅减小;随75%酒精处理时间增加变化不明显。各因素对褐化率的影响主次顺序为0.1% HgCl2>75%酒精>0.05% NaClO>冲洗。褐化率随0.1% HgCl2处理时间增加而明显增大;随0.05%NaClO、冲洗时间和75%酒精处理时间变化不明显。各因素对成活率的影响主次顺序为0.1% HgCl2>冲洗>75%酒精>0.05% NaClO。成活率随0.1% HgCl2处理时间增加先增大后减小,在15 min水平到达最高值;随冲洗时间增加而增大,2 h水平与3 h水平变化不明显;随0.05% NaClO和75%酒精处理时间变化不明显。最高成活率组合为A 3 B 4 C 4 D 3,即冲洗2 h+0.05% NaClO处理20 min+75%酒精处理20 min+0.1% HgCl2处理15 min。方差分析结果(表6)表明,0.1% HgCl2对褐化率的影响显著(p<0.05),其他因素与指标的组合均表现为不显著。

表5 外植体消毒方法的极差分析Table 5 Range analysis of explants disinfection methods
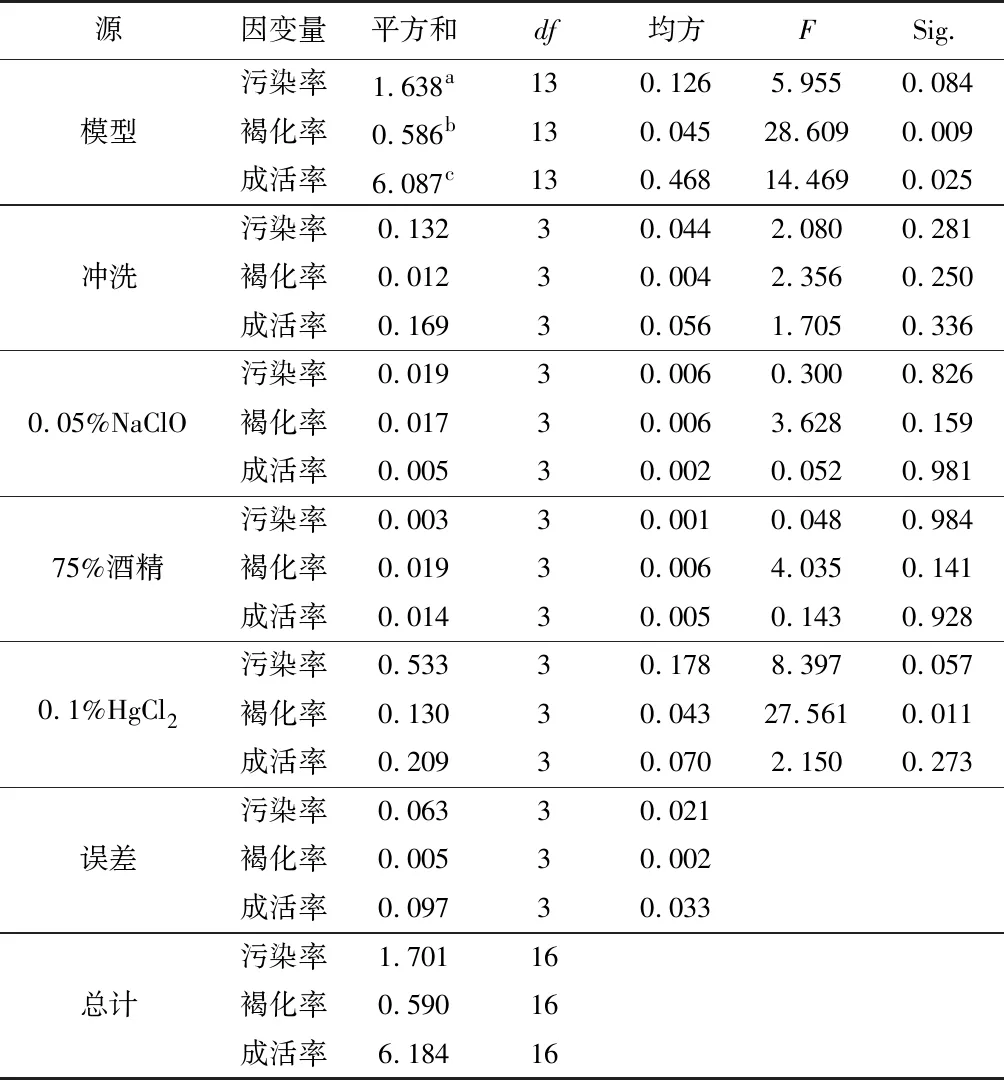
表6 外植体消毒方法的方差分析Table 6 Variance analysis of disinfection methods of explants
2.2 初培培养基的筛选
采用L16(45)正交表进行培养条件筛选试验,设第5列为误差列,试验方案及结果见表7。极差分析结果(表7)表明,所试范围内各因素对愈伤组织诱导率的影响主次顺序为6-BA>NAA>温度>光照。愈伤诱导率随6-BA浓度增加而增加;随NAA浓度变化不明显,但在2 mg·L-1水平出现明显降低;随温度和光照变化不明显。最大愈伤组织诱导率组合为A 2 B 2 C 1 D 2,即光照1 000 lx+28 ℃+4 mg·L-16-BA+0.1mg·L-1NAA。各因素对不定芽诱导率的影响主次顺序为光照>6-AB>NAA>温度。不定芽诱导率随光照强度增加呈先增大后减小趋势,在2 000 lx水平达到最高值;随6-BA浓度增加呈先增大后减小趋势,在3 mg·L-1水平达到最高值;随NAA浓度增加先增大后减小趋势,在0.05 mg·L-1水平达到最高值;随温度增加先增大后减小趋势,在25 ℃和28 ℃水平变化不明显。最大不定芽诱导率组合为A 3 B 2 C 2 D 3和A 3 B 3 C 2 D 3,即光照2 000 lx+25 ℃/28 ℃+3 mg·L-16-BA+0.05 mg·L-1NAA。方差分析结果(表8)表明,各因素对愈伤组织和不定芽诱导率的影响均不显著。
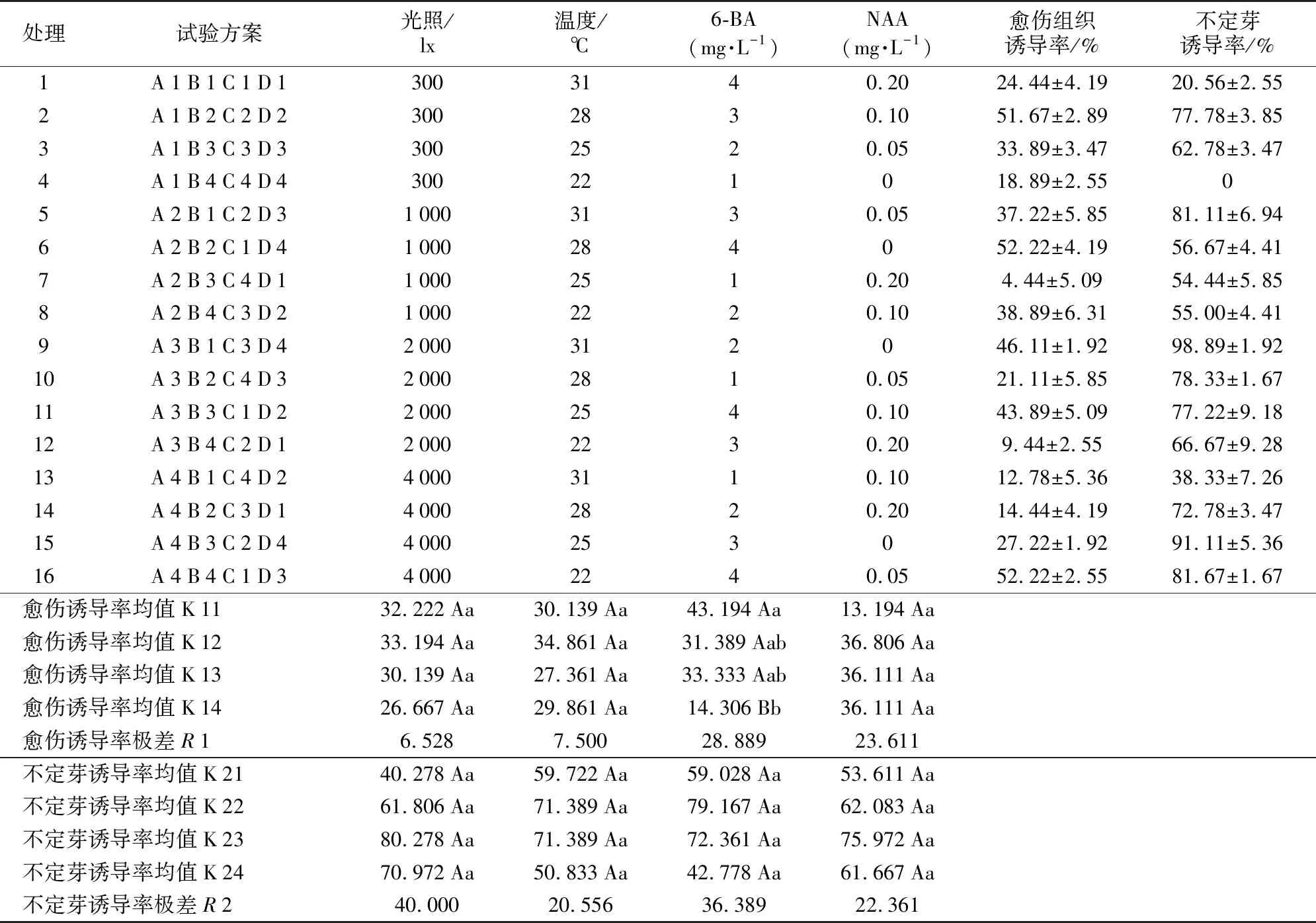
表7 初培培养条件的极差分析Table 7 Range Analysis of initial culture
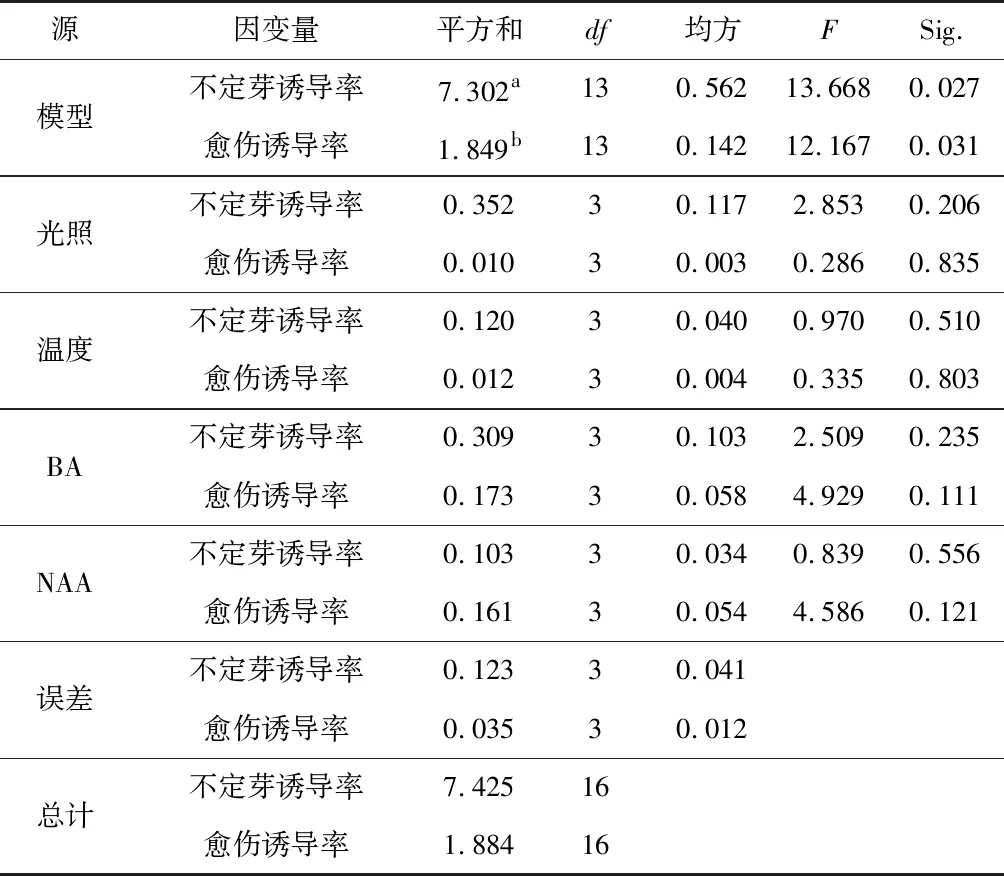
表8 初培培养条件的方差分析Table 8 Analysis of variance of initial culture
初培试验表明,愈伤组织诱导率均在60%以下,而不定芽诱导率在所试培养条件下能够达到(98.89±1.92)%。故选择不定芽诱导途径作为初培培养方案较为合适。
2.3 不定芽的增殖培养
采用L16(45)正交表进行培养条件筛选试验,设第5列为误差列,试验方案及结果见表9。极差分析结果(表9)表明,所试范围内各因素对不定芽增殖系数的影响主次顺序为6-BA>Kt>温度>NAA。不定芽增殖系数随6-BA浓度增加而增大,在2 mg·L-1和3 mg·L-1水平变化不明显;随Kt浓度增加而增大,在0.2 mg·L-1和0.3 mg·L-1水平变化不明显;随温度升高而增大,在28 ℃和31 ℃水平变化不明显;随NAA变化不明显。最大不定芽增殖系数组合为A 3 B 3 C 3 D 2,即28 ℃+0.2 mg·L-1Kt+2 mg·L-16-BA+0.2 mg·L-1NAA。各因素对不定芽苗高的影响主次顺序为NAA>温度>6-BA>Kt。不定芽苗高随NAA浓度增加而增大;随温度升高先增大后减小,在28 ℃水平达到最高值;随6-BA浓度增加先增大后减小,在1 mg·L-1水平达到最高值;随Kt浓度增加而减小。最大不定芽苗高组合为A 3 B 1 C 2 D 1,即28 ℃+1 mg·L-16-BA+0.3 mg·L-1NAA。方差分析结果(表10)表明,6-BA对不定芽增殖系数的影响显著(p<0.05),其他因素与指标的组合均表现为不显著。

表9 增殖培养条件的极差分析Table 9 Range Analysis of proliferation culture
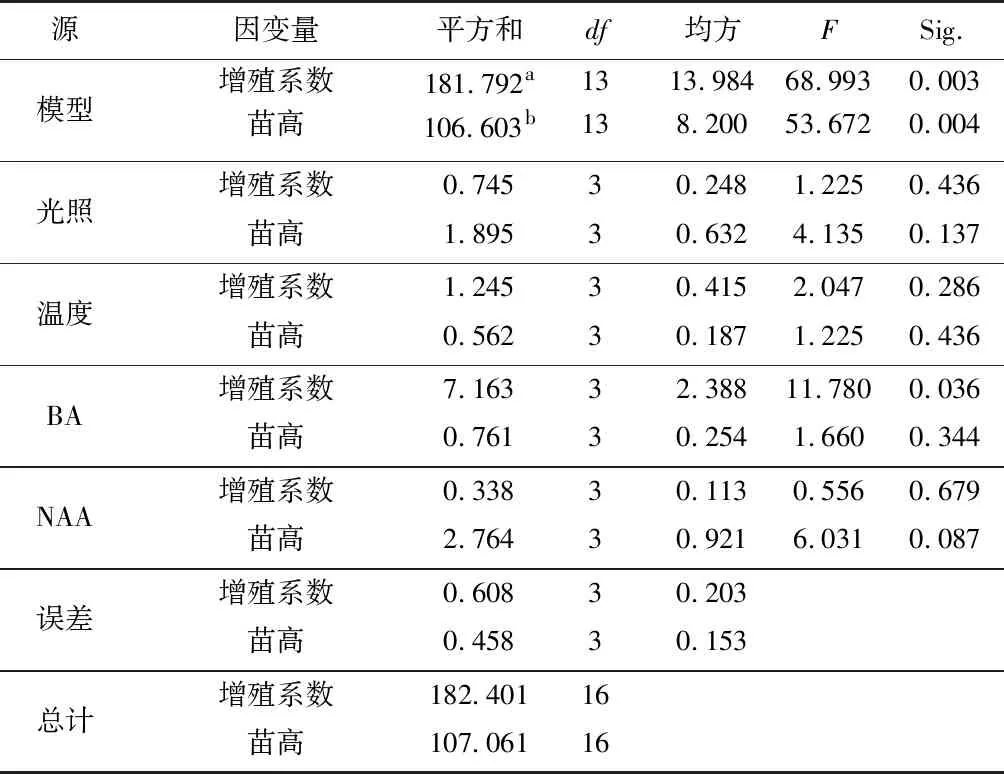
表10 增殖培养条件的方差分析Table 10 Variance analysis of proliferation culture
2.4 生根培养
生根培养条件试验(表11)表明,各因素对生根率的影响主次顺序为:大量元素>NAA>IBA>苗高。最大生根率组合为:A 1 B 2 C 2 D 2和A 2 B 2 C 2 D 2,即苗高2~4 cm+1/2 MS+0.2 mg·L-1NAA+0.2 mg·L-1IBA。方差分析结果(表12)表明,大量元素对生根率的影响极显著(p<0.01),NAA对生根率的影响显著(p<0.05),IBA和苗高对生根率的影响不显著。
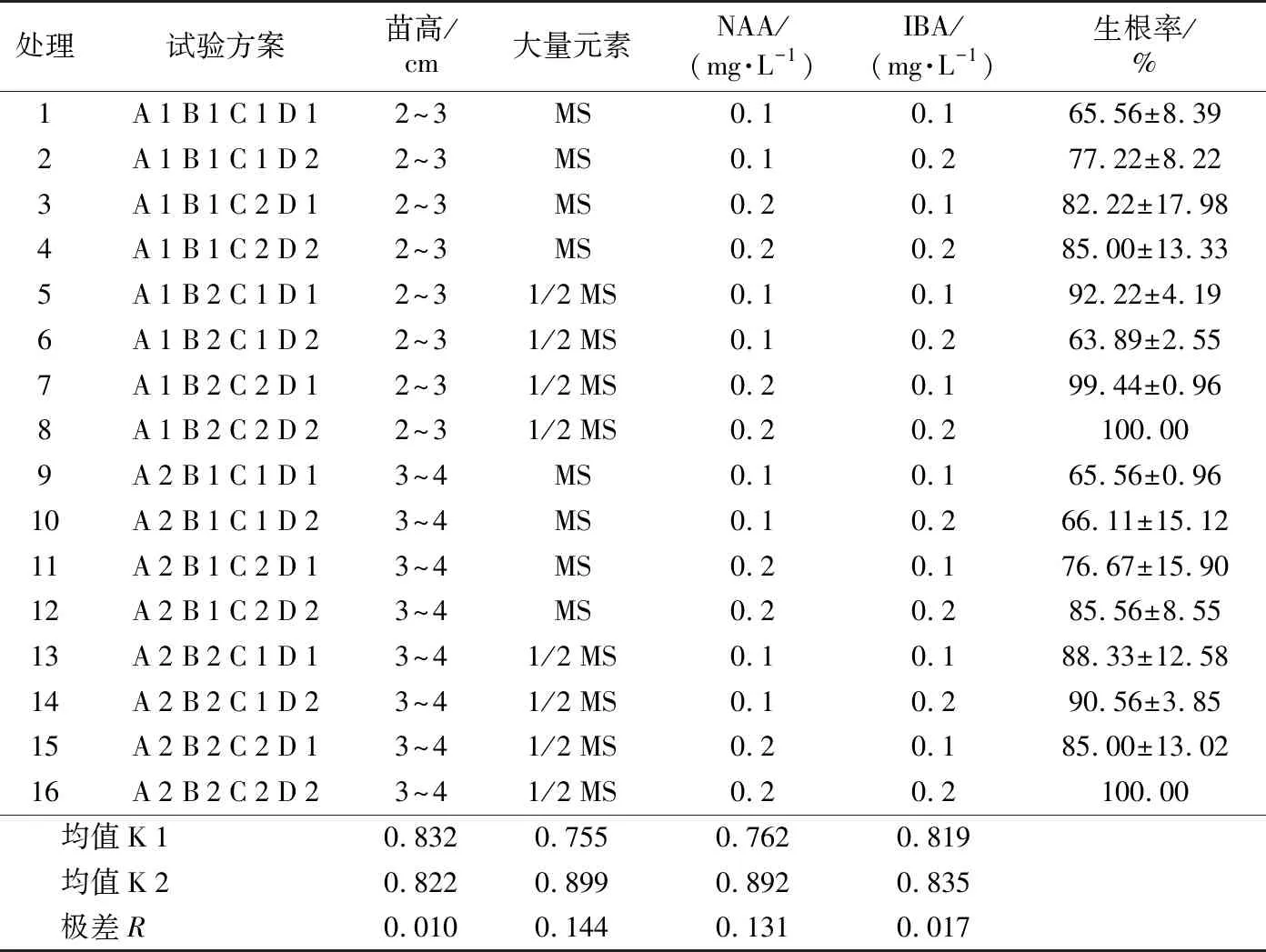
表11 生根培养条件的极差分析Table 11 Range analysis of rooting culture
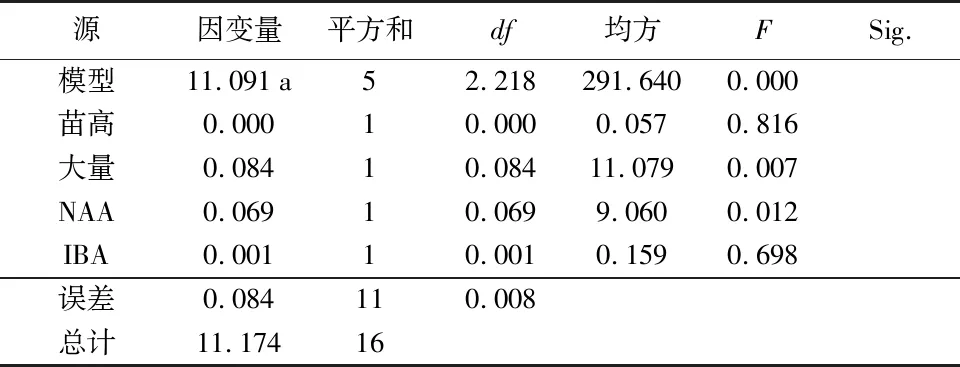
表12 生根培养条件的方差分析
3 讨 论
外植体消毒方法的试验表明,0.1%HgCl2处理时间对于污染率、褐化率和成活率的影响均表现出决定性的作用。延长冲洗时间对降低污染率的贡献在本试验中仅次于0.1% HgCl2,又由于最不容易引起褐化,导致其对最终成活率的贡献明显高于0.05% NaClO和75%酒精。因此在实际操作中,除了选择适宜的0.1% HgCl2处理时间,也应重视冲洗时间对于消毒的辅助效果。对于一些幼嫩的外植体,尤其是对0.1%HgCl2处理相对敏感的材料,适当增加冲洗时间不仅能够提升消毒效果,也有助于减轻由于0.1% HgCl2处理时间难以精确掌握而造成的褐化损失[17-19]。
后期培养中发现,在最大不定芽增殖系数组合28 ℃+0.2 mg·L-1Kt+2 mg·L-16-BA+0.2 mg·L-1NAA条件下,多次继代的香水白掌会出现不同程度的玻璃化现象。这可能是由于长期在高增殖系数培养条件下,材料状态趋于幼嫩和密集而引起的[20-21]。为了缓解玻璃化现象,需要定期将材料转移至最大不定芽苗高组合28 ℃+1 mg·L-16-BA+0.3 mg·L-1NAA条件下,以增加幼苗的健壮程度。
生根培养试验的结果表明,2~4 cm范围内苗高对生根率的影响很小。这意味着香水白掌在生根培养阶段开始前,可能并不需要特意关注幼苗的健壮程度,幼嫩的小苗可以同时作为增殖继代材料和生根炼苗的储备用苗。
