辣椒Capsicum annuum×Capsicum chacoense种间杂种的创制及鉴定
2021-02-25钟洋敏柴松琳程远阮美颖王荣青叶青静姚祝平周国治万红建
钟洋敏 柴松琳 程远 阮美颖 王荣青 叶青静 姚祝平 周国治 万红建


摘 要:遠缘杂交是导入外源有效基因的主要途径之一,种间杂交是拓宽辣椒栽培种遗传基础和创制种质资源的有效方式。为了拓宽栽培辣椒的遗传基础,增强遗传潜力,以辣椒栽培种Capsicum annuum ‘PI194879为母本、野生种C. chacoense ‘PI639651为父本进行杂交试验,通过形态学观察、花粉育性观察和SSR分子标记分析对种间杂种F1的真实性进行鉴定。结果表明:(1)种间杂种F1表型性状与双亲有较大差异,多介于双亲之间;(2)种间杂种F1花粉活力仅为6.58%,远低于母本的97.08%和父本的94.51%;(3)SSR分子标记扩增结果显示,5对引物扩增的杂种F1谱带既有父本的特征带,又有母本的特征带,呈共显性,进一步在分子水平上证明了杂种F1的真实性。获得的C. annuum和C. chacoense种间杂种不仅拓宽了栽培辣椒的遗传多样性,而且为利用野生辣椒C. chacoense的优异基因来改良栽培辣椒提供了理论依据。
关键词:辣椒;种间杂交;表型性状;SSR
中图分类号:S641.3 文献标志码:A 文章编号:1673-2871(2021)01-024-05
Creation and identification of interspecific hybrids between Capsicum annuum and Capsicum chacoense
ZHONG Yangmin1,2, CHAI Songlin2, CHENG Yuan2, RUAN Meiying2, WANG Rongqing2, YE Qingjing2, YAO Zhuping2, ZHOU Guozhi2, WAN Hongjian2
(1. College of Horticulture, Northwest A & F University, Yangling 712100, Shaanxi, China; 2. Institute of Vegetable, Zhejiang Academy of Agricultural Sciences, Hangzhou 310021, Zhejiang, China)
Abstract: Distant(Interspecific and Intergeneric)hybridization is an important method for introducing exogenous elite genes into cultivated crops. In pepper, interspecific hybridization is an efficient way to broad genetic basis of cultivated species and develop the excellent germplasm. In order to expand the genetic basis of cultivated pepper and further enhance genetic potential, interspecific hybrid F1(Capsicum annuum ×C. chacoense) was created with cultivated species(C. annuum ‘PI194879-female) and wild species(C. chacoense ‘PI639651-male) in this study. To identify the authenticity of interspecific hybrids, analysis of morphological observation, pollen viability and SSR molecular markers were employed on hybrid F1 and their parents. Our results showed that(1) remarkable difference was found in agronomic traits between hybrid F1 and their parents, and majority of phenotypic traits of hybrid F1 presented intermediate values,(2)the pollen viability of interspecific hybrid F1(6.58%) was less than that of female(97.08%) and male(94.51%), and(3) analysis of SSR markers clearly indicated that interspecific hybrid F1 had bands from the paternal and maternal accessions, which confirmed that F1 hybrid was authenticity. Here, interspecific hybrids between C. annuum and C. chacoense will not only expand genetic diversity of cultivated pepper, but also provide the basis for transferring excellent genes from C. chacoense into cultivate pepper.
Key words: Pepper; Interspecific hybridization; Morphological descriptors; SSR
辣椒是我国重要的蔬菜作物,起源于美洲热带地区,属于茄科(Solanaceae)辣椒属(Capsicum),为一年生或多年生草本植物,在全球范围内广泛种植[1]。辣椒栽培种、野生种的种类繁多[2],包括5个栽培种(C. annuum、C. baccatum、C. chinense、C. frutescens、C. pubecens)和20多个野生种[3]。其中,一年生栽培辣椒(C. annuum)是我国种植面积最广泛、品种类型最丰富的栽培种[4],它在果实大小、形状、气味和颜色上与其他4个栽培种存在明显的遗传差异。然而,在高强度的人工选择压力下,C. annuum遗传基础渐趋狭窄,遗传多样性指数逐渐降低,阻碍了辣椒新品种培育的进程[5]。
多年生野生辣椒在自然选择的长期影响下形成了极其丰富的变异类型,遗传方面未受到人工选择的影响,许多特异性状没有因为人工选择而丢失,如抗病、抗逆和广适应性等,这些性状对扩大栽培辣椒的遗传基础具有重要意义。此外,野生辣椒也是辣椒系统发育和演化的研究载体之一,是辣椒生产可持续发展的重要遗传基础。辣椒属野生种C. chacoense主要分布于南美洲,其优良特性可改良栽培品种,如抗疮痂病、抗烟草花叶病毒(TMV)、耐热性好、连续坐果率高等,其植株矮小,株高60~90 cm,果小,果实纵径8~14 mm[6-7]。因此,利用C. chacoense创制种间杂种不仅能扩大栽培辣椒的遗传基础,而且可以将其进一步应用于辣椒品种改良。
植物种间杂交是远缘杂交的方式之一,可以拓宽栽培种的遗传基础,创制新的种质资源,加快新品种的培育进程[8]。20世纪50年代以来,国内外学者就辣椒种间杂交技术开展了大量研究,获得了种间杂种[9-11]。笔者以栽培种C. annuum ‘PI194879为母本、野生种C. chacoense ‘PI639651为父本进行种间杂交试验,对获得的种间杂种F1及其亲本植株进行形态学观察、花粉育性观察和分子标记分析。研究结果将为深入开展辣椒种间优异基因的转移与新材料的创制提供重要依据。
1 材料与方法
1.1 材料
试验材料为栽培种C. annuum ‘PI194879和具有多种优良性状的野生种C. chacoense ‘PI639651,两者均引自美国国家种质资源实验室。上述材料均由浙江省农业科学院蔬菜研究所經过多代自交保存。
1.2 方法
1.2.1 种间杂种F1的创制 试验在浙江省农业科学院蔬菜所(杨渡科研创新基地)进行。2019年3月4日,将辣椒材料播种于72孔穴盘内,待幼苗生长至5叶1心时(2019年4月10日)定植于塑料大棚。试验采用高垄覆膜栽培,双苗定植,垄宽80 cm,株距45 cm。在开花盛期,以C. annuum ‘PI194879为母本(P1)、 C. chacoense ‘PI639651为父本(P2)进行杂交试验,采用徒手旋花去雄法杂交后包上棉花防止传粉,并挂牌标记,第2天上午重复授粉1次,50 d左右获得成熟果实。为保证父本花粉的纯度,在杂交前1 d的下午,用棉花包上次日要开放的花蕾,防止异交。同时,母本植株应尽量选择生长健壮且无病虫害的植株。
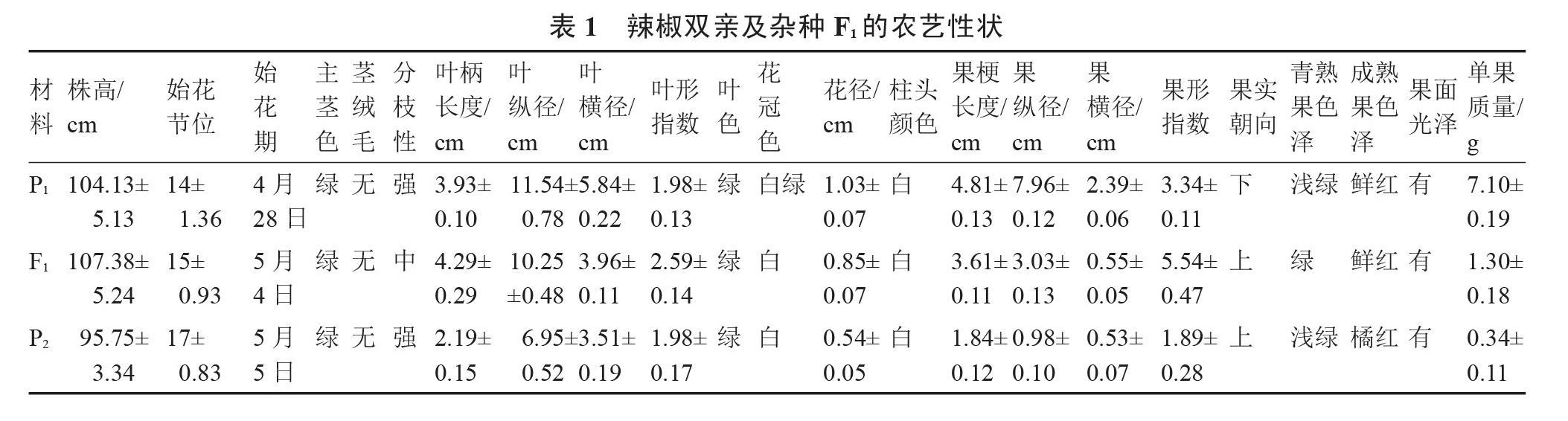
1.2.2 形态学观察 2019年12月20日,将P1、F1和P2播种于浙江省农业科学院杨渡科研创新基地的塑料大棚内,2020年3月18日定植。随机选取双亲及其杂种F1各8株进行形态学观察,包括株高、始花节位、始花期、主茎色、茎绒毛、分枝性、叶柄长、叶纵径、叶横径、叶形指数、叶色、花冠色、花径、柱头颜色、果梗长度、果纵径、果横径、果形指数、果实朝向、青熟果色泽、老熟果色泽、果面光泽、单果质量共23个指标。其中叶形指数=叶纵径/叶横径,果形指数=果纵径/果横径,具体参照辣椒种质资源描述规范和数据标准[12]进行。
1.2.3 花粉育性观察 利用醋酸洋红染色法对辣椒杂种F1及其亲本植株的花粉进行染色,并用显微镜观察花粉活力。在辣椒的盛花期,随机采集上午8:00—10:00的杂种F1及其亲本花3朵,取少量花粉置于载玻片上,加1~2滴醋酸洋红溶液,盖上盖玻片染色20 min后吸去多余染液在显微镜下观察,每朵花镜检5个视野,3次重复,统计花粉活力,取其平均值。
1.2.4 分子标记分析 辣椒DNA提取:采集父母本及F1新鲜幼嫩叶片50 mg,参照Paterson等[13]改良CTAB法提取DNA,用1% (m/V)琼脂糖凝胶电泳检测DNA,并用超微量核酸蛋白测定仪检测DNA浓度,将DNA质量浓度稀释至20~30 ng·μL-1,置于-20 ℃冰箱保存备用。
SSR标记分析:选用多态性好、条带清晰稳定的40对SSR引物对P1、F1和P2进行SSR分子标记分析。SSR引物由生工生物工程(上海)股份有限公司合成。PCR反应体系为10 μL,其中,2×T5 Super PCR Mix(PAGE) 5 μL,正反引物各1 μL,模板DNA 1 μL,ddH2O 2 μL。Mix和Marker均购自北京擎科新业生物技术有限公司,PCR扩增程序为: 94 ℃ 3 min,30个循环(94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min), 72 ℃ 5 min,然后4 ℃保存。采用8%聚丙烯酰胺凝胶电泳观察PCR结果,电泳缓冲液为0.5×TBE,在180 V、150 mA、50 W恒压下电泳2.5 h。银染方法:①电泳结束后取出凝胶用无菌水漂洗1次。②将凝胶放入硝酸银(0.1%,m/V)染色液中摇床染色20 min,染色完成后无菌水漂洗凝胶3次。③加入由氢氧化钠(1.5%,m/V)、硼砂(0.1%,m/V)和甲醛(0.4%,φ)组成的显影液显色3~5 min(摇床上晃动至可见清晰条带时停止显色),显色完成后无菌水漂洗凝胶2次。④捞出包胶并拍照保存。
2 结果与分析
2.1 种间杂种F1的获得
在浙江省农业科学院杨渡科研创新基地的自然条件下,C. annuum ‘PI194879和 C. chacoense ‘PI639651均能正常开花结果,经人工去雄杂交,杂交33朵花,授粉后50 d左右成功获得5个F1成熟果实,种间杂交坐果率为15.2%。共得到26粒F1种子,种子饱满度不一改,F1发芽率38%。
2.2 形态学观察
对得到的种间杂种F1代植株及其双亲进行田间农艺性状调查,发现杂种F1表型性状与双亲有较大差异,多介于双亲之间(图1~2,表1)。其中始花节位、叶纵径、叶横径、花径、果梗长度、果纵径、单果质量都介于双亲之间,初步表明所获杂种F1是真实的杂交种。
2.3 花粉育性观察
利用醋酸洋红染色法,对双亲和F1的花粉进行染色。通过显微镜观察发现,杂种F1平均花粉可染率为6.58%,而亲本C. annuum ‘PI194879和C. chacoense ‘PI639651的花粉可染率分别为 97.08%和 94.51%(图3)。杂种F1的花粉可染率明显低于双亲。
2.4 SSR分子标记分析
SSR分子标记具有多态性高、重复性好、共显性等特点,常被用来鉴定杂种的真实性。利用40对SSR引物对父母本及杂种F1进行扩增,其中5对引物(Primer ID:3-11、4-20、5-17、11-4、12-13)在F1杂种中均扩增出2条带,分别表现为父母本的特征带,扩增条带表现为双亲互补型,即在分子水平上证明了辣椒种间杂种的真实性(表2,图4)。
3 讨论与结论
具有高度抗逆境和抗病虫害胁迫能力的作物野生近缘种常在育种中被作为优异性状的变异来源[14-15]。1997年,据国际水稻研究所报道[16],印度、泰国、菲律宾等国将Xa21基因(来源于非洲的长雄蕊野生稻)成功转入栽培稻中,培育出高产且具白叶枯病广谱抗性的品种,如‘Swarna‘Triguna‘Mahsuri‘Khao Dak Mali‘Pusa Basmati-1‘PR106等;2003年,谢一芝等[17]将甘薯栽培种与不同倍性的野生种I. trifida杂交,选育出高产抗病、抗逆性强、适应范围广的甘薯品种‘苏渝303。这些研究结果证实了野生近緣种中的优良性状已经在作物栽培种中得到广泛的利用。
辣椒为茄科辣椒属作物,该属具有5个栽培种和20多个近缘野生种[3]。与辣椒栽培种相比,野生种在植株形态、叶片、花和果实等性状上表现出极丰富的多样性[18-20]。由于长期的人工选择,辣椒栽培种的遗传基础日趋狭窄,因此,将野生种的优异基因转移到栽培种中对辣椒新品种的选育具有重要意义。辣椒野生种C. chacoense具有抗烟草花叶病毒(TMV)、抗疮痂病、耐热性好、连续坐果率高等优良特性[6]。笔者以栽培种C. annuum ‘PI194879为母本、野生种C. chacoense ‘PI639651为父本进行种间杂交,创制种间杂种F1,结果可为通过有性杂交转移野生种C. chacoense优异基因提供“桥梁”。
前人研究发现,与亲本相比,作物种间杂种F1的花粉活力普遍较低。例如,1990年,王志宁等[21]发现棉属三元和四元种间杂种的花粉活力低于双亲;2012年,王雪芬等[22]测定了南瓜属种间杂种后代的花粉活力,结果显示杂种F1的花粉活力为28.0%,低于母本材料的72.8%和父本材料的65.2%;2019年,Martin等[23]观察了亚麻荠属(Camelina microcarpa×Camelina sativa)种间杂种及其亲本的花粉活力,分别为1.3%~45%、97%和90%。笔者对辣椒种间杂种F1的花粉育性进行观察,发现其花粉活力仅为6.58%,远低于父母本的94.51%和97.08%。这与大多数作物种间杂种F1花粉活力低于亲本的情况相似。低花粉活力将直接影响F1植株产生后代的能力,为此,研究者对辣椒种间杂种F1的生殖特性进行了研究,推测可能与授粉受精时染色体易位或细胞在减数分裂过程中的异常有关[24-26]。因此,研究者通常使用秋水仙碱诱导F1植株进行染色体加倍,进一步提高花粉活力,从而增强F1植株的授粉受精能力[27]。此外,还可以采用回交法恢复杂种花粉活力,从种间杂种后代中筛选花粉活力有所恢复的单株,逐代提高杂种后代的育性[22]。
利用远缘杂交,向栽培种C. annuum中转移野生种的优异性状是辣椒种质创新的重要方法。笔者以C. annuum ‘PI194879为母本、C. chacoense ‘PI639651为父本,开展了C. annuum与C. chacoense 种间杂交并成功获得种间杂种F1,为进一步对C. chacoense优异基因的鉴定与转移、新材料创制奠定了基础。
参考文献
[1] WAHYUNI Y,BALLESTER A R,TIKUNOV Y,et al.Metabolomics and molecular marker analysis to explore pepper(Capsicum sp.) biodiversity[J].Metabolomics,2013,9(1):130-144.
[2] 贾豪,魏小春,姚秋菊,等.辣椒SSR标记种质资源遗传多样性的分析[J].分子植物育种,2017,15(1):353-363.
[3] 覃成.基于栽培辣椒和野生辣椒的全基因组测序揭示辣椒属的驯化与特异性[D].四川雅安:四川农业大学,2014.
[4] 陈学军,方荣,周坤华,等.辣椒种质亲缘关系的数量分类学研究[J].现代园艺,2009(8):23-26.
[5] 魏家香,俞佳虹,程遠,等.辣椒种间杂交的现状及其研究进展[J].分子植物育种,2018,16(16):5474-5482.
[6] 孙润生.辣椒种间杂交亲和性研究及其杂种鉴定[D].南京:南京农业大学,2014.
[7] L?PEZ,P,GORZALCZANY S,ACEVEDO C, et al.Chemical study and anti-inflammatory activity of Capsicum chacoense and C. baccatum[J].Revista Brasilra De Farmacognosia,2012,22(2):455-458.
[8] 魏家香.辣椒种间杂种创制、种间遗传图谱的构建和主要农艺性状QTL定位[D].浙江金华:浙江师范大学,2018.
[9] 陈学军,周坤华,方荣,等.辣椒C. frutescens×C. chinense种间杂种的获得与鉴定[J].植物遗传资源学报,2012,13(5):907-911.
[10] 孙润生,王述彬,刁卫平,等.辣椒C. annuum×C. chinense种间杂种的获得及鉴定[J].华北农学报,2015,30(1):158-161.
[11] 张凯,刁卫平,郭广君,等.辣椒C. baccatum×C. frutescens种间杂种的获得与鉴定[J].江西农业学报,2019,31(8):1-5.
[12] 李锡香,张宝玺.辣椒种质资源描述规范和数据标准[M].北京:中国农业出版社,2006.
[13] PATERSON A H,BRUBAKER C L,WENDEL J F.A rapid method for extraction of cotton(Gossypium spp.) genomic DNA suitable for RFLP or PCR analysis [J].Plant Molecular Biology Reporter,1999,11(2):122-127.
[14] REEM H,TOBY H.The use of wild relatives in crop improvement: a survey of developments over the last 20 years[J].Euphytica,2007,156(1/2):1-13.
[15] OLIVIER H,HANS J,RAF A.Crop wild relatives: more common ground for breeders and ecologists[J].Frontiers in Ecology and the Environment,2012,10(3):121-121.
[16] BRAR D S,KHUSH G S.Alien introgression in rice[J].Plant Molecular Biology,1997,35(1/2):35-47.
[17] 谢一芝,吴纪中,戴起伟,等.甘薯近缘野生种资源的杂交亲和性评价及利用[J].植物遗传资源学报,2003,4(2):147-150.
[18] ESHBAUGH W H.The taxonomy of the genus Capsicum(Solanaceae)[J].Journal of General Microbiology,1980,47(3):153-166.
[19] SUDR? C P,GONCALVES L S A,RODRIGUES R,et al.Genetic variability in domesticated Capsicum spp. as assessed by morphological and agronomic data in mixed statistical analysis[J].Genetics and Molecular Research,2010,9(1):283-294.
[20] THUL S T,LAL R K,SHASANY A K,et al.Estimation of phenotypic divergence in a collection of Capsicum species for yield-related traits[J].Euphytica,2009,168(2):189-196.
[21] 王志宁,季道藩,许复华. 栽培棉种间二、三、四元杂种的研究Ⅱ.杂种F1减数分裂的染色体行为和花粉萌发率[J].浙江农业大学学报,1990,16(4):35-40.
[22] 王雪芬,智海英,李永平,等.南瓜属种间杂交后代花粉活力研究[J].天津农业科学,2012,18(5):100-102.
[23] MARTIN S L,LUJAN-TORO B E,SAUDER C A,et al.Hybridization rate and hybrid fitness for Camelina microcarpa Andrz.ex DC(female) and Camelina sativa(L.) Crantz(Brassicaceae)(male) [J].Evolutionary applications,2019,12(3):443-455.
[24] KUMAR O A,PANDA R C,RAJA R K G.Cytogenetic studies of the F1 hybrids of Capsicum annuum with C. chinense and C. baccatum [J].Theoretical and Applied Genetics,1987,74(2):242-246.
[25] BARBARA P.Genetic resources and breeding of Capsicum spp. [J].Euphytica,1997,96(1):129-133.
[26] MONTEIRO C E D S,PEREIRA T N S,CAMPOS K P D.Reproductive characterization of interspecific hybrids among Capsicum species[J].Crop Breeding and Applied Biotechnology,2011,11(3):241-249.
[27] ANDERSON J A,MOUSSET-DE?CLAS C,WILLIAMS E G,et al.An in vitro chromosome doubling method for clovers(Trifolium spp.) [J].Genome,1991,34(1):1-5.
