荧光碳点的合成、性能及其应用*
2021-02-25毛惠会薛茗月韩国成
毛惠会,薛茗月,2,韩国成
(1. 桂林电子科技大学 生命与环境科学学院,广西 桂林 541004;2. 岭南师范学院 化学化工学院,广东 湛江 524048)
0 引 言
荧光碳点(Carbon dots ,CDs)是2004年发现的新型碳纳米材料[1],它不仅具有普通纳米材料的共性,还具有出色的荧光性能,可以作为新型荧光探针被广泛的应用于生物医学和光电学领域,从而吸引了越来越多研究者的关注。
与传统的半导体量子点和有机染料相比,碳点作为优良的荧光纳米探针具有各种独特的性能。一方面,与传统的半导体量子点相比,碳点具有良好的生物相容性,即使在较高浓度条件下,细胞或生物体依然可持续地生活。另一方面,碳点表面通常富含羧基、氨基和羟基等亲水性基团,在水中表现出良好的溶解度和稳定性。再者,碳点具有良好的光稳定性,不存在光漂白问题,有利于长期细胞成像。另外,碳点还具有成本低廉、制备简单方便、稳定性好等优异性能,对碳点在体外和体内荧光成像中的应用具有重要意义。
近年来,关于碳点的制备、性质和应用的研究已经取得了较大的进展,多种碳纳米材料(多功能纳米药载[2]、聚合物胶束[3]、磁性纳米粒子[4]等)在生活的各方面也得到了广泛应用。因此,本文对碳点的性质、合成方法及其应用进行了综述。
1 碳点的合成方法
自从CDs被发现以来,已经有了各种各样的制造技术,根据制造工艺的不同,大体可将制备方法分成两大类:自上而下(Top-down)和自下而上(Bottom-up)途径[5,6]。Top-down 途径是指CDs在比较大的碳结构材料中形成或剥离出来,它包括电弧切割法、激光消融法和电化学法,其中,电弧切割法、激光消融法需要消耗太大的电能;电化学法是最传统的合成方法之一,通常合成过程中需要使用强氧化剂(强碱或酸),由于很难彻底去除过量的氧化剂,增加了环境问题,所以传统的合成方法通常在原材料或合成技术中都是不符合绿色化学要求、不符合可持续发展要求的。而 Bottom-up 途径是以小分子有机物为前驱体,例如葡萄糖、蔗糖、柠檬酸、氨基酸甚至食物残渣等,通过一系列反应最终得到CDs,主要包括微波辅助法、热解合成法、水热合成法等,这些方法中采用的原材料均为有机化合物与生物质材料,是开发“更绿色”的方法来合成CDs的重要方向。下面对各种方法进行简单介绍。
1.1 Top-down
1.1.1 电弧切割法
这种方法也是最初发现荧光碳点的经典方法。2004年,Xu等[1]通过电弧放电法制备单壁碳纳米管时,偶然发现在紫外灯照射下,该单壁碳纳米管具有荧光分离带,对该荧光物进行电泳分离,得到蓝、绿和黄光三种荧光发射的纳米材料,如图1所示。该方法实验工艺复杂,制备的碳点杂质较多且荧光量子产率(photo luminescence quantum yield,PLQY)较低,因此并未得到广泛采用,但是电弧放电法对碳点的首次发现有着里程碑式的意义。

图1 不同比例的荧光碳点在365 nm照射下的照片[1]Fig 1 Images of different proportions of fluorescent carbon dots under 365 nm irradiation[1]
1.1.2 激光消融法
2006年,Sun等[7]使用新的备制方法:利用激光消融法制出了碳纳米粒子,并提出了碳点的说法,简单的激光消融法制备CDs的实验装置示意图如图2所示。用激光使碳化物熔融得到没有荧光的基本碳纳米粒子初产物。将所得初产物经加热回流处理12 h,再经过末端含氨基的高分子聚合物如 PEG1500N 修饰后,制得了可发出荧光的直径为5 nm的碳纳米粒子,对碳纳米粒子进行激发时,其波长可以达到450 nm,此时 PLQY 为4%~10% 左右。随后的研究发现,如果把ZnS或ZnO掺入到材料中去,PLQY可达到45%以上,但制作过程繁琐。
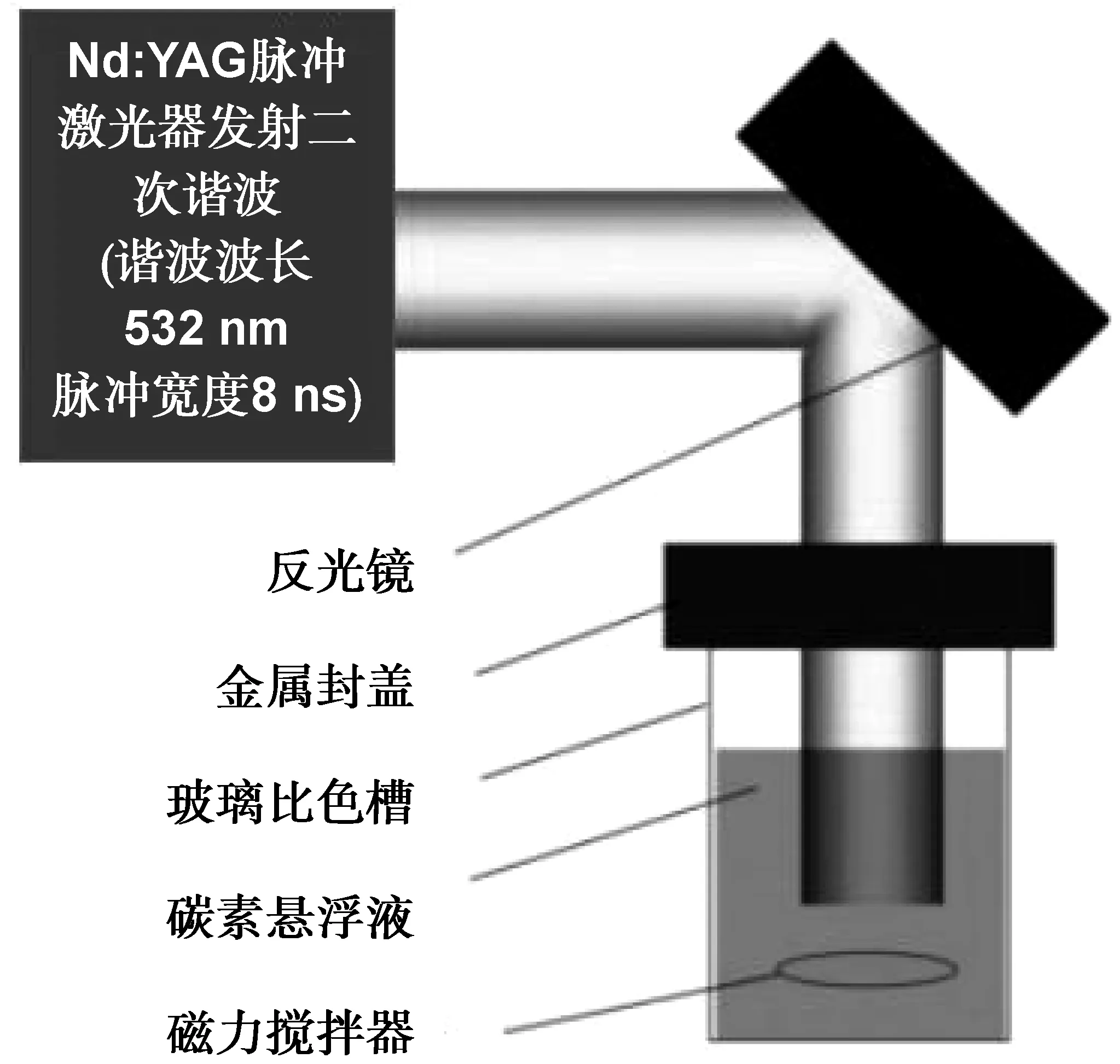
图2 简单的激光消融法制备CDs的实验装置示意图[7]Fig 2 Schematic diagram of experimental device for CDs prepared by simple laser ablation method[7]
由于激光消融法对操作仪器的要求较高,而这些仪器又往往比较昂贵,同时这一做法还需要钝化剂,所以这一方法成本过高,再加上产量低,所以使用者比较少。
1.1.3 电化学法
2007年,Zhou等[8]利用电化学方法,以多壁碳纳米管作为工作电极,铂丝为对电极,Ag/AgClO4为参比电极,将含有0.1 mol/L 四丁胺高氯酸盐的乙腈溶液作为电解液,进行电位扫描,最后得到发蓝色光的碳纳米簇。经对得到的含有碳纳米的溶液进行分离可以得到直径为3.0~6.0 nm的CDs,这一方法的 PLQY 可以达到6.4% 。在一系列研究的基础上,Lu等[9]采用等离子液体做电解液、石墨做电极,通过调节水和离子液体的比例,成功合成出粒径分布在2~4 nm,发光覆盖紫外-可见光区域的CDs,如图3所示,实现了对CDs荧光发射的调控。该方法具有反应速率快、电解质可循环使用的优点,但是,复杂的实验条件和电解体系使其未得到广泛采用。

图3 在超纯水中以电化学方法制备CDs[9]Fig 3 Preparation of CDs in ultrapure water by electrochemical method[9]
1.2 Bottom-up
1.2.1 微波辅助法
Zhu等[10]首次采用微波法,在短短几分钟内就合成出了荧光强度高、水溶性好、耐光漂白的CDs。研究发现,随着反应时间的延长,溶液逐渐由无色变成黄色(A),最后变成深棕色(B),如图4所示,说明了CDs的生成。

图4 微波热解法合成CDs[10]Fig 4 Synthesis of CDs by microwave pyrolysis[10]
Wang等[11]用750 W微波加热甘油和PBS溶液14 min,得到PLQY为3.2%的CDs。Liu等[12]对该合成方法进行改良,以甘油为碳源, TTDDA为表面纯化剂,700 W微波加热10 min,制得了PLQY为12.02%的CDs。该课题组进一步以柠檬酸和乙二胺为碳源和表面纯化剂,制得量子产率高达30.2%的CDs[13]。
微波具有优越的穿透能力,采用微波加热可以使分散于溶剂中的碳源材料受热更加均匀,反应时间大为缩短,因此微波法是一种十分简便快捷的荧光碳点制备方法。
1.2.2 热解合成法
热分解法早期被用来制备多种半导体和磁性纳米材料,但研究证实,外部加热可以加速有机物的脱水和碳化,进而得到碳点。Xue等[14]将荔枝核置于一个陶瓷坩埚中,以10 ℃/min加热至300 ℃ 碳化2 h,冷却后研磨,将样品加入纯水中,在超声的条件下采用滤膜(0.22 μm孔径)过滤溶液除去较大颗粒获得碳点。Lin等[15]将3 g柠檬酸加入到5 mL烧杯中,然后将烧杯置于加热罩中加热到230 ℃,在20 min后液体的颜色由无色变为紫红色,说明CDs已经形成。Martindale等[16]在180 ℃下将柠檬酸(Citric Acid, CA)热解40 h,得到产率为45% 、粒径分布在(6.8±2.3)nm范围内的CDs。
但是,由于受热不均匀,温度偏高或者偏低均会导致碳点的发光性能变差。
1.2.3 水热合成法
Pan等[17]首先将纯化过后的氧化石墨分散在水中,之后调节溶液至碱性,在200 ℃下反应10 h,经过离心、透析等一系列的纯化过程之后就可得到所需的蓝光CDs,粒径为5~13 nm,PLQY 为6.9% 。Zhang等[18]将水和乙醇的混合液作为水热反应的溶剂,将L-抗坏血酸(L-ascorbic acid,L-AA)作为碳源,在水热反应釜中180 ℃反应4 h,最后经过纯化后制得了粒径为2 nm左右的CDs。Wang等[19]将50 mL 1-甲基-2-吡咯烷酮置于80 mL聚四氟乙烯高压锅中,在200 ℃下恒温加热约10 h,以水作为溶剂透析3 d除去剩余溶剂,获得直径为5~15 nm的CDs, PLQY 为8.4% 。
利用水热法制备CDs几乎用不到一些相当昂贵的仪器设备,经济环保,而且具有简单易行的操作方法和较强的可控性,同时,由于反应在密闭的水热反应釜中进行,还避免了有毒物质挥发进入环境,也能利用日常生活中常见的资源,是一种绿色、简便、快捷、高效的来合成CDs的方法。
随着对荧光CDs的深入研究发现,自下而上的合成方法采用的碳源更加丰富、绿色环保,所需的设备也更加简便、容易操作,该方法在细胞成像、药物输送等方面具有更加广泛的应用。
2 碳点的结构与性质
2.1 碳点的结构
CDs是一种三维团簇结构,其3个维度尺寸均在纳米级别,CDs的核一般由 sp2杂化碳或无定形碳组成,晶格间距与石墨或无定形碳的晶格间距一致,粒径一般小于10 nm,如图5所示[20],只有传统荧光试剂的十分之一,因此,CDs更易于通过内吞作用到达细胞内,且因其容易获得,合成简单,越来越受到研究人员的关注。

图5 CDs的结构示意图[20]Fig 5 Structure diagram of CDs[20]
2.2 碳点的性质
2.2.1 光学性质
CDs在紫外光区域内(主要在280~360 nm之间)表现出较强的光吸收,经修饰后吸收波长会相应增加或吸收峰增强,有一些吸收峰可延伸至可见光区[21]。
CDs发射荧光的一个有趣特征是激发波长依赖的发射光谱,虽然已有许多研究报道,但CDs的普遍荧光起源仍是一个谜。目前,最普遍接受的发光机制是表面态[22-25]、量子限制效应[26-27]和分子荧光[28-29]。用不同的合成方法、前驱体和后处理合成的CDs表现出不同的光学性能,这表明CDs表现出比预期更复杂的系统。例如,熊焕明等[23]采用对苯二胺和尿素做前驱物,进行水热反应、分离,获得了发光覆盖整个可见光光谱的CDs,如图6所示,发现CDs的发光与尺寸大小无关,仅与其表面态有关。林恒伟等[26]采用3种不同的同分异构体邻/间/对苯二胺做前驱物,水热反应、分离、提纯后,得到蓝光、绿光和红光CDs,如图7所示,发现CDs的荧光性质受尺寸和N含量共同影响。

图6 全彩色发光CDs示意图(上);发射红移与表面氧化的关系(下)[23]Fig 6 Schematic diagram of full-color luminous CDs(up); relationship between emission redshift and surface oxidation(down)[23]
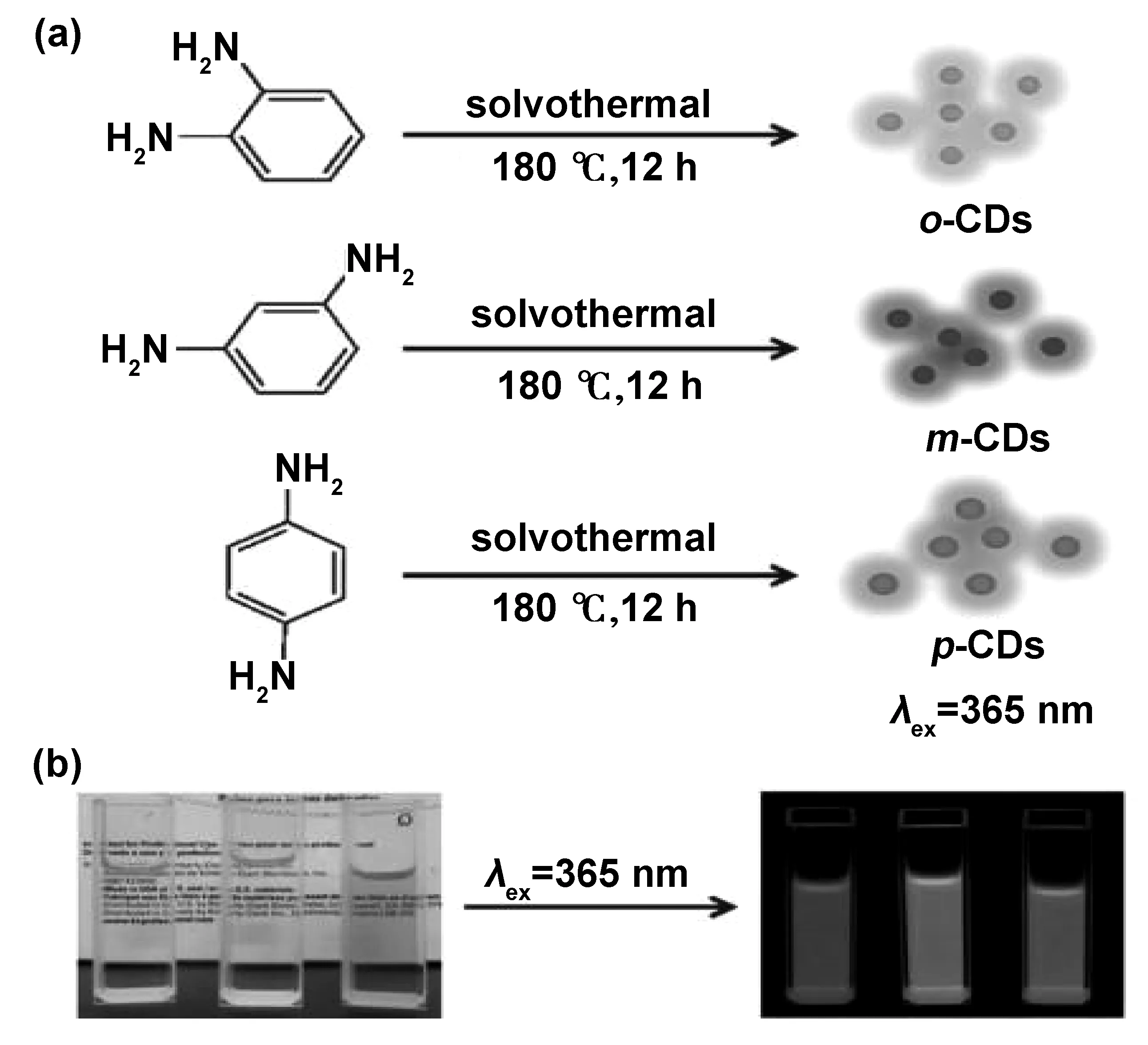
图7 (a)3种不同的CDs;(b)3种CDs在日光(左)和365 nm紫外灯照射下(右)的照片[26]Fig 7 Three different CDs and photos of three CDs illuminated by sunlight (left) and 365 nm UV light (right)[26]
此外,Schneider等[28]通过制备3种柠檬酸基CDs,证实了独特的分子荧光对CDs发射的贡献,证明了溶液中附着在CDs上的分子荧光对CDs的光学特性有很大的影响。因此,对不同文献报道中CDs的性质进行比较以形成统一的理论是不合适的。
与常见的有机或无机荧光团相比,CDs的荧光不发生光闪烁,并且具有优异的光稳定性。Hill等[30]采用微波介导法分别制备葡萄糖与N-掺杂TTDDA、多巴胺形成CDs,如图8所示,曝光24 h后,用激光扫描共聚焦显微镜观察,发现CDs的荧光并没有发生漂白现象,其荧光强度也没有明显的降低。
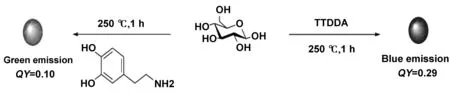
图8 葡萄糖与N-掺杂 TTDDA 和多巴胺形成CDs的比较研究[30]Fig 8 Comparative study of CDs formed by glucose, N-doped TTDDA and dopamine[30]
CDs的荧光强度还与 pH 有关[31]。荧光CDs的光致发光强度在中性范围内几乎是恒定的(pH=5.5~8.0)[32],随着pH值从8增加到13,光致发光逐渐增强,从5.5降低到1,荧光逐渐衰减,如图9所示;同时pH依赖的光致发光行为是可逆的,当pH值从13到1时,吸收变弱,当pH值又恢复到13时,吸收光谱和光致发光光谱恢复。
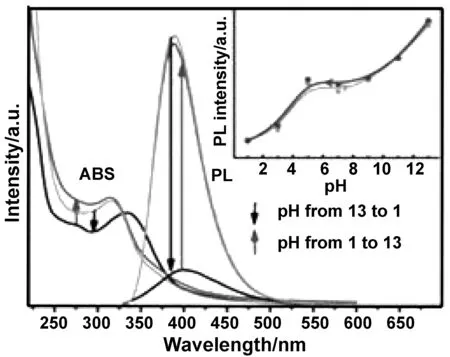
图9 光致发光强度与pH值的关系[32]Fig 9 Relationship between photoluminescence intensity and pH value[32]
2.2.2 发光性质
CDs的发光特性主要包括光致发光(Photoluminescence,PL)和电致发光(Electroluminescence,ECL)两种,发光机理示意图如图10所示[33]。CDs的光致发光机理还未完全研究清楚,不能准确定义。除了PL性能外,与半导体量子点相似,碳点还具有ECL性能[34]。在电位循环过程中,负电位时(R*-)可形成碳点还原态,正电位时(R*+)可形成碳点氧化态。还原和氧化物质之间的电子转移湮灭导致激发态(R*)形成,激发态会在跃迁回基态时产生一个ECL信号。

图10 碳点的ECL和PL发光机理[33]Fig 10 Luminescence mechanism of ECL and PL of carbon points[33]
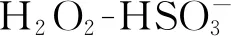
与常规荧光团相比,CDs表现出更高的上转换荧光(UCPL)效率。Li等[37]利用浓酸氧化制备的石墨烯量子点经 PEG 钝化后,激发波长为600~800 nm时,发射波长为390~468 nm,具有上转换荧光性质。而且上转换发射光和激发光的能量几乎是不变的,大约为1.1 eV。由于长激发波长光具有深层组织穿透能力,所以上转换(同时吸收两个或连续吸收多个较长波长的光子后发射较短波长的光子)荧光更易于实现体内成像;同时由于高度局域化的非线性光子吸收过程,上转换荧光易于实现高空间分辨率、低背景干扰和低光子毒性的分子成像。
2.2.3 碳点的毒性和生物相容性
碳元素是生物分子的骨架,因此,CDs比其他纳米材料具有更好的生物相容性[38-39]。另有研究证实,CDs对多个细胞系的细胞毒性很低。同时,在短时间内CDs可完全被人体清除。因此,CDs在生物医学应用方面具有巨大的潜力。
孙亚平课题组是最早实现以CDs进行活体成像的[40]。他们分别研究了以皮下注射和静脉注射CDs溶液的方式进行活体成像,如图11所示。从小鼠前掌皮下注入CDs后,CDs沿小鼠前肢缓慢移动;以静脉注射的方式向小鼠体内注入CDs,并剖开小鼠腹部进行成像时,除了膀胱及尿液有CDs荧光外,其他组织没有明显的荧光。这一现象从一个侧面反映了CDs这类体积超小的纳米颗粒一般是可以从尿液排泄的,在体内无残留,无累积。

图11 小鼠前掌皮下注射CDs(左);静脉注射CDs示意图(右)[40]Fig 11 CDs were injected subcutaneously into the forepalm of mice and schematic diagram of intravenous CDs[40]
3 碳点的应用
由于CDs具有水溶性好、化学惰性高、易功能化、光致发光、低毒性、生物相容性好、耐光漂白等重要特性,这使得它们在生物传感、生物成像、药物传输和光电等领域具有重要地位。
3.1 生物传感
CDs由于优良的光学特性(高荧光强度、抗光、漂白性低、发光颜色可调等)得到了极大的重视,并被广泛应用于阴阳离子、有机小分子及大分子检测等方面的研究。
3.1.1 阴阳离子检测
CDs广泛应用于各种阴阳离子的检测,如Fe3+、Zn2+、Hg2+、Cr3+、Au3+、Al3+、Ag+、Pb2+、F-、I-、S2-等。
代[41]以杏仁为碳源,采用热解-水热的方法制备了磷、氮共掺杂CDs,这种碳点在水溶液中对Fe3+的特异性选择和高灵敏度,可用于检测细胞内Fe3+的浓度,实现生物传感的功能,如图12所示。Zhang等[42]合成了喹啉衍生物修饰的CDs,基于喹啉衍生物对Zn2+的特异性识别作用使得CDs荧光增强的现象,建立了高灵敏、高选择性检测Zn2+的荧光方法,如图13所示,该方法还可以实现细胞内Zn2+的实时成像。除此之外,杨子康[43]利用油茶果壳粉末制备的CDs,在Pb2+的存在下会发生荧光猝灭,对Pb2+有良好的选择性和较高的灵敏度。

图12 激光共聚焦 HepG-2 细胞成像。不加 Fe3+ (下左),加入 Fe3+ (下右)[41]Fig 12 Laser confocal HepG-2 cell imaging. No Fe3+ (lower left) and adding Fe3+ (lower right)[41]

图13 基于CDs的荧光探针的合成及其用于检测 Zn2+ 的示意图[42]Fig 13 Synthesis of CDs based fluorescent probes and a schematic diagram of Zn2+ detection[42]
除上述阳离子外,CDs也可用于阴离子的检测。郑[44]利用碳点表面的羧基与金属离子的配位特性,构建了Al3+-CDs复合荧光探针,建立了环境中F-的定量检测方法。当F-存在时,由于F-能与Al3+发生强烈相互作用,CDs分散,荧光恢复。因此,该方法用于玻璃厂排放的废水中F-的检测,简单快速。
3.1.2 小分子及大分子检测
CDs常用于许多生物分子的荧光分析,包括代谢物,鸟苷-3′-二磷酸-5′二磷酸(ppGpp),碱性磷酸酶,赖氨酸,透明质酸酶,谷胱甘肽,三磷酸腺苷等。此外,CDs还作为许多药物分子的荧光探针对其进行检测,包括维生素B12,四环素,抗坏血酸,敌敌畏,草甘膦和有机磷农药以及其他小分子物质等。
江[45]以乙二醇胺同时作为碳源及氮源,无需其他溶剂或催化剂,经微波法在10 min内制备得氮掺杂CDs,在实际样品(血样、尿样)的检测中其优异性能得到了进一步的印证。Chen等[46]提出了一种使用铽改性CDs(CDs-Tb)检测ppGpp的高选择性、高灵敏度荧光比值法。研究表明,Tb3+的特征峰强度随着ppGpp浓度的增加而增加,而CDs的荧光则保持不变。因此,CDs-Tb可以在其他核苷酸(如GTP和GDP)中特异性地识别ppGpp,CDs-Tb的合成过程如下图14所示。周[47]以N、S、P共掺杂碳纳米点(N,S,P-CNDSac)为基础,构建了免标记锰(VII)和L-AA的荧光探针。加入L-AA后,Mn(VII)被还原为Mn(IV)、Mn(II)和Mn(0),N,S,P-CNDSac的荧光恢复,实现了对L-AA的检测。Chen等人[48]通过将柠檬酸、丙烯酰胺溶解于甲酰胺的溶剂,采用热解法合成了红光CDs,发现,农药福美锌可以与Hg2+形成更稳定的络合物,该络合物使CDs淬灭的荧光得到恢复。因此,在Hg2+存在的情况下,CDs对福美锌具有较高的选择性。

图14 CDs-Tb 的合成过程示意图[46]Fig 14 Schematic diagram of the synthesis process of CDs-Tb[46]
一些生物分子如蛋白质和氨基酸可以通过表面钝化增强CDs的荧光。在此基础上,Song等[49]制备了一种功能双发射CDs(functional dual emissive CDs,dCDs),该dCDs对赖氨酸(440 nm)和pH(624 nm)表现出有趣的波长依赖性双重响应功能,使这两个目标的比值检测成为可能。因此,该探针成功地用于监测细胞系统中赖氨酸和pH的动态变化,dCDs的制备过程和赖氨酸和pH的特异性比值检测的原理图如图15所示。

图15 dCDs 的制备过程以及赖氨酸和 pH 的特异性比值检测的原理图[49]Fig 15 Preparation process of dCDs and the schematic diagram of specific ratio detection of lysine and pH[49]
3.2 细胞成像与细胞标定
CDs具有良好的生物相容性和无毒性等特点,已被广泛应用于细胞和细菌等生物物种的生物成像和传感。
郁[50]分别采用同分异构体的邻/间/对苯二胺为碳源,通过优化苯二胺的种类、水热反应的温度、时间及溶剂体系(水/乙醇)获得发光覆盖整个可见光波段的蓝、绿、黄、橙和红光CDs,将PLQY较高的橙光碳点作为荧光成像探针,成功标定了HeLa细胞。Wang等[51]成功地将红光碳点(R-CDs)用于细胞内甲醛(FA)的检测,如图16所示。体外实验表明,R-CDs能快速、高选择性地检测FA。

图16 R-CD(5 mg/mL)和不同浓度的 FA 孵育 HepG-2 细胞的共聚焦荧光图像[51]Fig 16 Confocal fluorescence images of HepG-2 cells incubated with R-CD (5 mg/mL) and different concentrations of FA[51]
除了细胞成像,CDs还为细菌检测提供了一种很有前途的探针。Wang等[52]采用溶胶-热法制备了PLQY为18.98%的水溶性CDs(W-CDs),并将其进一步用于大肠杆菌O157:H7的荧光检测。Chen等[53]通过一步加热反应获得PLQY为43%的CDs,可作为金黄色葡萄球菌、大肠杆菌等细菌的多色标记剂。
3.3 药物传递
化疗作为癌症的主要治疗方法之一被广泛应用,但是化疗药物较差的针对性和非特异性毒性严重影响了治疗效果,基于此,CDs因其独特的理化性质,作为药物载体,在肿瘤治疗领域应用广泛。
文[54]采用“微波法”制备CDs作为药物载体,通过酰胺化反应与葡萄糖胺盐(Glu-NH2)靶向配体结合形成CD-Glu纳米复合物,最后将顺铂(Pt)负载到CD-Glu,组成纳米药物(CD-Glu-Pt)。通过观察4T1小鼠皮下瘤的肿瘤体积和体重变化,发现CD-Glu-Pt纳米药物能靶向输送药物至肿瘤,并降低药物毒性,发挥了良好的抑制肿瘤生长的效应。郑等[55]以有序介孔纳米碳球(OMCNs)为基质,先后对其进行磁化、氨基和肼基修饰,最终制得可与抗肿瘤药物盐酸阿霉素(DOX)共价结合的磁靶向药物载体(HMOMCNs)。通过研究发现,HMOMCNs对DOX具有pH控释性,随着pH的降低,其累积释药率增加,当pH降至5.5时,10 h累积释药率达到最大,最大值为76%。Gao等[56]报道了聚乙烯亚胺修饰的碳量子点(P-CD)与透明质酸共轭的阿霉素(HA-Dox)通过静电自组装形成P-CDs/HA-Dox复合物用于质酸酶的检测、自身靶向成像和药物递送,如图17所示。通过利用透明质酸对CD44受体(一种细胞膜糖蛋白)的高亲和力在许多癌细胞过表达,P-CD/HA-Dox能够靶向渗入癌细胞,随后被透明质酸酶激活,HA-Dox被消化成许多小片段,导致Dox的释放,从而恢复P-CD的荧光。

图17 PEI-CDs/HA-Dox 的形成以及用于靶向癌细胞成像和药物递送的纳米探针[56]Fig 17 Formation of PEI-CDs/Ha-DOx and nanoprobes for targeting cancer cell imaging and drug delivery[56]
考虑到生物体对可见光区的强吸收,碳点在药物传递和靶向治疗方面有很大的应用前景。
3.4 发光材料
由于出色的荧光发光性质,碳点作为发光材料,被广泛应用于生活中。
3.4.1 LED器件
由于CDs具备优异的发光可调性能,因此荧光CDs取代传统发光材料在白光 LED 器件方面有一定的应用。
张[57]采用溶剂热法处理柠檬酸铵和乙二胺四乙酸等前驱体成功制备出一系列发光可调的全光CDs。其中,白光发射主要是因为能级间电子跃迁引起的不同发射光的重叠。研究结果表明了全光CDs在LED和全光显示等方面有着潜在的应用前景。Wang等[58]通过水热法以柠檬酸钠和L-半胱氨酸为前驱体合成了发射峰为500 nm左右的绿色CDs。把绿光CDs跟红光荧光粉的混合物作为荧光粉,再结合395 nm紫外芯片制得白光LED,适用于室内照明。
3.4.2 荧光油墨
CDs由于其独特的荧光发光性质,制成的荧光油墨可以用于防伪、信息加密等领域。
Yang等[59]利用简单的水热法成功合成了一种新型多孔氮掺杂碳点复合材料。研究发现NCDs和g-C3N4以及最终产物NCDs@g-C3N4均可发出明亮的荧光,可作为荧光油墨用于防伪和信息加密,如图18所示。Bu等[60]采用一步水热法制备了一种水溶性的氮掺杂碳点(N-CDs)。该碳点作为一种新型安全荧光油墨具有显著的荧光特性,如图19所示。与传统油墨相比,新型CDs油墨具有清洁、持久、无污染等优点。
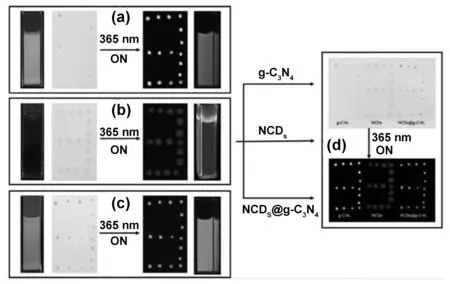
图18 NCDs、g-C3N4和NCDs@g-C3N4 3种荧光油墨在365 nm紫外灯照射下的照片[59]Fig 18 NCDs, G-C3N4 and NCDs@G-C3N4 fluorescent inks under ultraviolet light of 365 nm[59]

图19 N-CDs作为荧光油墨在紫外灯照射下的照片[60]Fig 19 N-CDs as a fluorescent ink under ultraviolet light[60]
3.5 光催化剂
利用光催化剂降解污染物是治理水污染的有效途径之一。石墨化碳(g-C3N4)作为有效的光催化剂引起了全球的广泛关注,但其光电子空穴对的高复合率和低可见光吸收效率限制了g-C3N4的光催化效果,这极大地阻碍了实际应用。
面对这个问题,Zhang等[61]通过简便的浸渍热法合成了CD修饰的石墨化碳氮化(g-C3N4)光催化剂,用其来降解苯酚,发现,合成的光催化剂不仅可以通过扩展可见光吸附区来增强光致电子-空穴对的产生,也促进了g-C3N4/CDs结中的电子空穴分离,从而产生更多的空穴、O2-和 -OH 自由基,促进了苯酚的降解。Wang等[62]报道了N掺杂碳点(NCDs)在可见光照射下降解吲哚美辛(IDM)的反应速率比原始g-C3N4高出13.6倍。而Yang等[59]发现,在可见光照射下,NCDs @ g-C3N4的光催化活性明显高于g-C3N4和 NCDs 对亚甲基蓝(MB)的降解。
由此可见,g-C3N4/CDs复合材料可以作为一种良好的光催化体系,运用到实际的污染物治理中。
4 结 语
自2004年发现CDs以来,CDs的研究得到了长足发展。主要概括了近几年CDs领域的研究,包括CDs的合成方法、性能特征以及在环境、生物成像、药物传递、光催化等方面的应用,发现CDs具有良好的发展前景。但是目前,其制备和应用方面仍然存在一些局限性:CDs的发光机制还没有被很好的理解,可持续的绿色合成方法还存在一些限制,用不同的掺杂元素来探索CDs的功能还有很大的发展空间等。随着精确医疗进入我们的视野,药物靶向运输、肿瘤靶向治疗也将成为可能。
虽然面临的挑战还有很多,但是我们相信,随着时间的推移,对CDs的认识会越来越透彻,CDs在今后的生活中也必将发挥出巨大的作用。
致谢:感谢岭南师范学院人才专项的大力支持。
