应用Box-Behnken 实验设计优化七叶皂苷钠固体脂质纳米粒的处方研究
2021-02-24王金悦叶青卓张向荣
王金悦,叶青卓,李 婷,王 迪,张向荣*
(1.沈阳药科大学 中药学院,辽宁 沈阳 110016;2.沈阳药科大学 功能食品与葡萄酒学院,辽宁 沈阳 110016)
七叶皂苷钠(sodium aescinate,SA)是从七叶树科植物天师栗(Aesculus Wilsonii Rehd.)的干燥成熟果实娑罗子中提取到的皂苷钠盐,主要成分为七叶皂苷钠 A、B、C、D。研究表明,SA具有消炎[1]、抗渗出[2]、消肿[3]、抗氧化、清除自由基[4]、增加静脉张力[5]和改善血液循环[6]等作用。临床可用于治疗脑水肿、创伤或手术所致肿胀,也用于治疗静脉回流障碍性疾病,具有很高的临床应用价值。
目前已经上市的 SA 制剂有片剂、注射剂、针剂和凝胶剂,但都有各自的缺点。口服 SA 的生物利用度较低[7],而由于 SA 属于含多酯键的三萜皂苷类药物,具有较强的刺激性,静注可对血管产生刺激性,引起注射部位疼痛,长时间用药可能引起静脉炎,外用可能会引起皮肤或粘膜的局部疼痛和过敏反应等[8-10]。作为一种具备多种生物活性和药理作用的药物,这极大地限制了它的临床应用和与其相关的新药开发。
纳米技术在药物递送领域的应用在学术界和工业界呈现出不断发展的趋势,纳米技术的发展也日趋成熟[11]。因此借助有效的制剂手段,可将 SA 制备成固体脂质纳米粒(solid lipid nanoparticles,SLNs),进而提高口服 SA 的生物利用度,更好地实现其临床应用价值。固体脂质纳米粒的制备方法有很多,包括:沉淀法、研磨法、高压均质法和乳化法等。本研究采用熔融乳化超声法,使用单硬脂酸甘油酯(glycerol monostearate,GMS)作为脂质材料,蛋黄卵磷脂(egg yolk lecithin,EL)和泊洛沙姆 188(F68)为乳化剂,将 SA 制备成 W/O/W 型复乳液,再通过探头超声得到分散均匀的七叶皂苷钠固体脂质纳米粒(SA-SLNs)。此方法设备简单、容易操作,适用于学校及其他科研机构的中小规模试验。
Box-Behnken 实验设计(Box-Behnken design,BBD)可通过建立可信的数学模型来表达响应与因素之间的关系,筛选得到最优的处方设计,目前已被广泛应用[12-14]。本研究采用 BBD 实验,以粒径(particle size,gPS)和包封率(encapsulation efficiency,wEE)为评价指标,考察处方中 GMS、EL 和 F68 用量对制剂的影响,预测最优处方并验证,最后考察其体外释放效果并进行评价。
1 仪器与材料
CP114 分析天平(上海奥豪斯仪器有限公司),YP2002 电子天平(余姚市金诺天平仪器有限公司),DF-101S 集热式恒温加热磁力搅拌器(河南予华仪器有限公司),XO-250 超声波细胞破碎仪(南京先欧仪器制造有限公司),KQ3200E 超声波清洗器(昆山超声仪器有限公司),TG16G 高速离心机(天津广丰科技有限公司),SC-04 低速离心机(安徽中科中佳科学仪器有限公司),L-7000 高效液相色谱仪(日本日立公司),Nano-ZS90 Zetasizer 粒度测定仪(英国 Malvern公司),JEM-2100F 透射电子显微镜(日本电子株式会社),MD34 透析袋(截留分子量20 000,美国 VAKE 公司)。
七叶皂苷钠 A(质量分数 ≥ 98%,批号 ZJ0719BC13,上海源叶生物科技有限公司),SA原料药(质量分数 98%,南京春秋生物工程有限公司),GMS(分析纯,天津市大茂化学试剂厂),EL(批号 510300-2183999,德国 Lipoid GmbH 公司),F68(德国 BASF 公司),无水乙醇、甲醇、乙腈(色谱纯,山东禹王和天下新材料有限公司),水(杭州娃哈哈集团有限公司),其余试剂(分析纯,市售)。
2 方法与结果
2.1 SA-SLNs 的制备
采用熔融乳化超声法制备 SA-SLNs。首先将 GMS、EL 溶于无水乙醇,于 75 °C 加热至溶剂挥干且充分熔融,作为油相。将 SA 原料药溶于 1 mL 蒸馏水中加热至与油相等温,形成内水相。将内水相注入油相,于 75 °C 超声 5 min,制得 W/O 型初乳。另将 F68 溶于剩余 19 mL蒸馏水中,水浴至 75 °C,作为外水相。将外水相逐滴加入到 W/O 型初乳中,继续乳化 15 min,得 W/O/W 型复合乳,将制得的复乳在冰浴条件下探头超声(250 W,95%)12 min(3s on,3s off),即得 SA-SLNs。
2.2 固体脂质纳米粒中 SA 的分析方法
2.2.1 色谱条件
色谱柱为 Diamonsil C18柱(250 mm × 4.6 mm,5μm);流动相为乙腈∶磷酸(取质量分数为 85% 的磷酸 4 mL 用水稀释至 1 000 mL)体积比为 40∶60;体积流量为 1.0 mL•min-1;检测波长为 220 nm;进样量为 20μL;柱温为室温[15-16]。

Fig.1 The HPLC chromatograms of sodium aescinate A standard solution (A),sodium aescinate solution (B),SASLNs solution (C) and blank SLNs solution (D)图1 七叶皂苷钠A 标准溶液 (A)、SA-Sol (B)、SA-SLNs 溶液 (C)、空白 SLN s 溶液 (D) 的高效液相色谱图
2.2.2 标准曲线的制备
精密称取 SA 原料药 300.0 mg 置于 50 mL 量瓶中,用适量甲醇超声溶解并定容摇匀,即得质量浓度为 6.0 g•L-1的储备液。精密移取 0.25、0.5、1.0、2.0、3.0,4.0 和 5.0 mL 的储备液,置于 10 mL 的量瓶中,用甲醇定容至刻度,混合得澄明无色溶液,在 220 nm 处检测,进样 20μL进行测定。以峰面积(A)为纵坐标,质量浓度(ρ)为横坐标,进行线性拟合,得到拟合方程A=5.168 3 × 102ρ+6 .169 6 × 103,r=0.999 8,且 SA 质量浓度在 150~3 000 mg•L-1浓度范围内线性关系良好。
2.2.3 精密度试验
配制质量浓度分别为 150、1 200 和3 000 mg•L-1的低、中、高三种 SA 溶液,在同一日内按照 2 h 的时间间隔,进样 20μL 进行检测,每个质量浓度平行测定 3 次,按所测峰面积积分值,求取日内相对标准差,计算日内精密度。同时,将该试验样品在第 1~5 d 分别测定,计算日间精密度。由表1 可知,根据本方法所求得的日内及日间精密度的 RSD 均小于 2%,证明该方法精密度良好,符合要求。
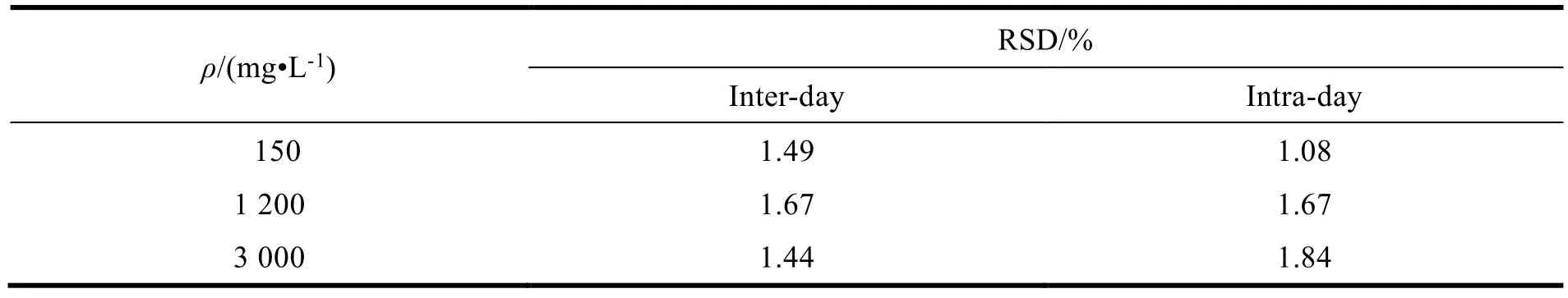
Table 1 Inter-day and intra-day precision assay of sodium aescinate by HPLC method表1 SA 液相分析方法的日内和日间精密度
2.2.4 重复性试验
配置质量浓度分别为 150、1 200 和 3 000 mg•L-1的低、中、高三种 SA 溶液各 6 份,取上述样品过 0.45μm 的微孔滤膜,按“2.2.1”项色谱条件在同一日内将 6 份续滤液依次连续进样10μL,测定其峰面积求取相对标准差,计算得 RSD 为 1.09%,表明方法重复性良好。
2.2.5 稳定性试验
配制质量浓度为 1 200 mg•L-1的 SA 溶液,室温下放置,分别在 0、2、4、6、8、12 h 后,按“2.2.1”项下色谱条件进样分析,记录峰面积以考察其稳定性。经计算求得峰面积的 RSD 值为 0.81%,可见样品溶液在 12 h 内的稳定性良好。
2.2.6 检测限和定量限的确定
精密吸取 SA 储备液适量,用甲醇稀释配制成不同浓度的溶液,进行 HPLC 检测,测得其检出限(S/N=3)浓度为 30 mg•L-1,定量限(S/N=10)质量浓度为 100 mg•L-1。
2.3 粒径的测定
纳米制剂为热力学不稳定的体系,粒径和粒度分布可以从一定程度上反映一个体系的物理稳定性。研究表明,粒径较小且粒度分布均匀的制剂质量更好,更容易跨膜吸收,发挥疗效。利用马尔文粒度仪基于动态光散射对 SA-SLNs 的粒径进行测定,测定方法是将待测样品用注射用水稀释适当倍数,放入样品池内并调节光强,测定温度样品池内不得有气泡,测定三个循环,最后取平均值。
2.4 包封率的测定
包封率是评价纳米制剂的重要指标之一,包封率指被包载药物在纳米制剂混悬液中占药物总量的百分量,包封率越高越好。本研究采用超滤膜过滤法测定 SA-SLNs 的包封率。具体方法如下:
总药物含量的测定:精密移取 SA-SLNs 液体 2 mL 置于 10 mL 量瓶,加入甲醇超声破乳,20 min 后,甲醇定容摇匀,取适量样品于 10 000 rpm 下离心 10 min,取上清液,经 0.22μm 微孔滤膜过滤,取续滤液按“2.2.1 色谱条件”进行测定,并计算药物含量。
游离药物浓度的测定:移取适量 SA-SLNs 液体于超滤管中,在 4 000 rpm 下离心 10 min收集超滤液,精密移取 2 mL 超滤液至 10 mL 量瓶,甲醇稀释定容后,经 0.22μm 微孔滤膜过滤,取续滤液按第一章节“2.1.2 色谱条件”进行测定并计算含量。
包封率计算公式:

式中:mtotal为总药物含量;mfree为游离药物含量。
2.5 Box-Behnken 实验设计
2.5.1 实验设计
Box-Behnken 实验设计用于 SA-SLNs 的优化,将三种主要材料 GMS、EL 和 F68 的用量作为考察因素,各因素的高、中、低水平分别用 1、0、-1 表示,粒径和包封率作为响应值,建立优化处方的数学模型。其中 GMS、EL、F68 分别用A、B、C表示(见表2),按表3 的处方设计来制备固体脂质纳米粒,测定每组的粒径和包封率,并记录。

Table 2 Factors and levels of Box-Behnken design表2 BBD 实验设计的因素与水平
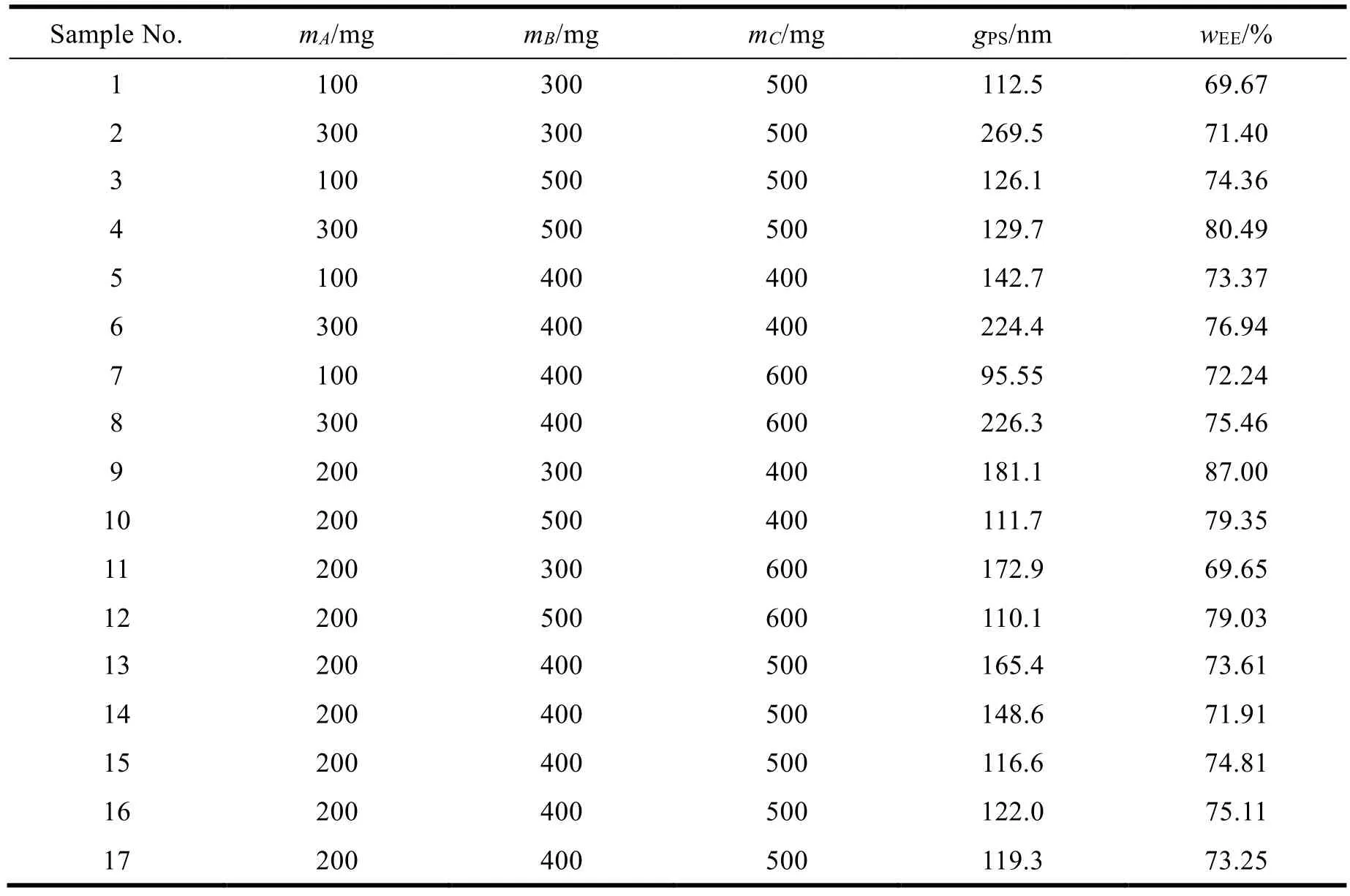
Table 3 Results of Box-Behnken design test表3 BBD 实验设计结果
2.5.2 试验分析
采用 Design-Expert 8.0.7 软件分别对粒径和包封率进行二次多元回归分析,分析结果见表4。
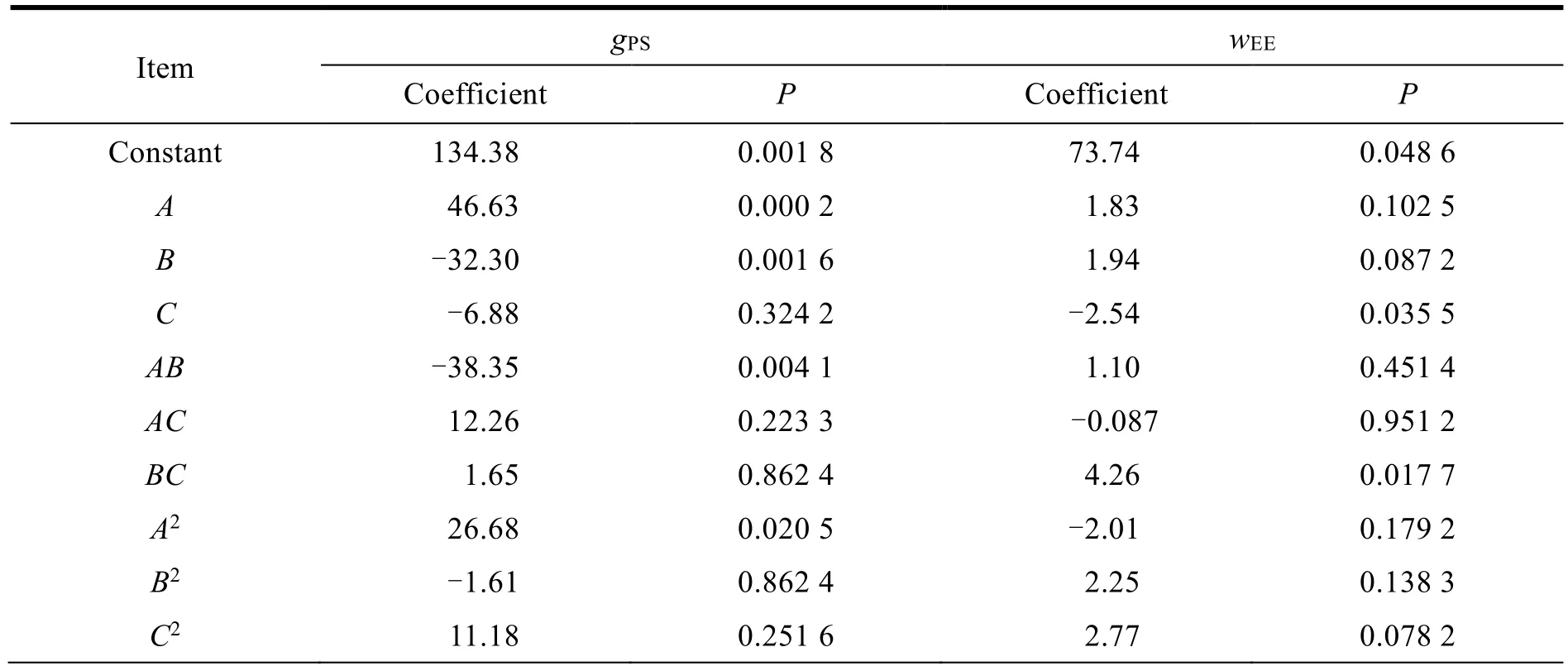
Table 4 Results of Box-Behnken design test analysis表4 BBD 实验设计分析结果
2.5.2.1 粒径分析
粒径是影响固体脂质纳米粒性质的关键因素,粒径小且粒径分布窄的固体脂质纳米粒较好。因此,首先对粒径进行分析,拟合方程如下:gPS=134.38+46.63A-32.30B-6.88C-38.35AB+12.26AC+1.65BC+26.68A2-1.61B2+11.18C2。结果表明,二次模型显著(表4),A、B、AB、A2的P值均小于 0.05,说明它们对固体脂质纳米粒的粒径有显著影响。总体而言,经F值检验显示总模型方程显著(P< 0.05,r2=0.939 0),回归方程的代表性较好,能预测实际情况。其中 GMS(A)对粒径的影响最显著,EL(B)次之。
2.5.2.2 包封率分析
粒径分析后,再对包封率进行分析,得到拟合方程:wEE=73.74+1.83A+1.94B-2.54C+1.10AB-0.087AC+4.26BC-2.01A2+2.25B2+2.77C2。C和BC的P值均小于 0.05,这表明它们对固体脂质纳米粒的包封率具有显著影响(表4)。F值检验显示总模型方程显著(P< 0.05,r2=0.827 1)。F68(C)对包封率的影响最大,其次是 EL(B)。
2.5.3 试验预测与验证
根据响应曲面试验原理,三维交互作用曲面图弯曲度越大,表明两因素之间的差异越显著。利用 Design Expert 8.0.7 软件对 SA-SLNs 的最佳处方用量进行了分析和预测。分析结果是,制备 20 mL 的 SA-SLNs 需要 204 mg GMS、500 mg EL 和 600 mg F68,而预测得到的固体脂质纳米粒粒径为 107.3 nm,包封率为 82.54%。最后,制备三批样品进行验证(表5)。
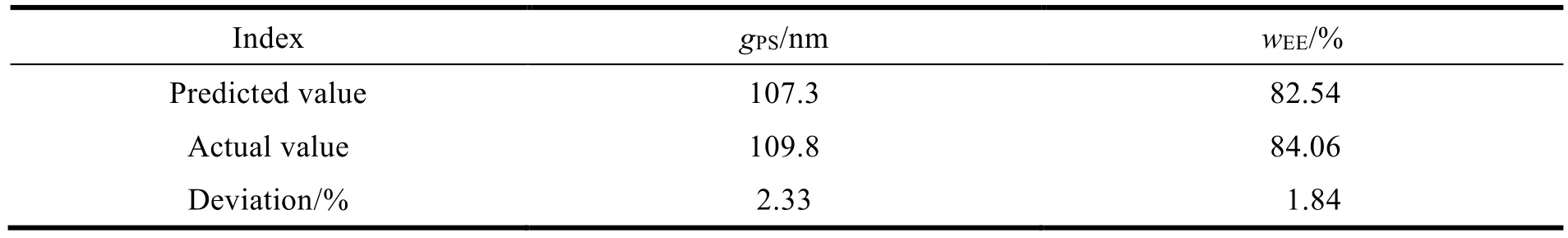
Table 5 The verification test results of Box-Behnken design表5 BBD 实验设计验证结果
制备得到的固体脂质纳米粒平均粒径为(109.8 ± 0.14)nm,包封率为 84.06%。结果表明,实际值与预测值的粒径和包封率的偏差均小于 5%,因此该处方适用于制备 SA-SLNs。
2.6 Zeta 电位分析
同样利用马尔文粒度仪对 SA-SLNs 的 Zeta 电位进行测定,将待测样品用注射用水稀释适当倍数,测定三个循环,最后取平均值。平均 Zeta 电位为(-31.5 ± 0.02)mV,电位绝对值较大,胶体系统较稳定。结果见图2。

Fig.2 Zeta potential distribution of SA-SLNs图2 SA-SLNs 的 Zeta 电位分布图
2.7 透射电镜(transmission electron microscopy,TEM)分析
将制备得到的固体脂质纳米粒经磷钨酸负染色法处理后,采用透射电子显微镜观察纳米粒的形态。固体脂质纳米粒用超纯水稀释 50 倍,取适量滴在铜网上,放置几分钟。然后加入染色液,染色 1~2 min,滤纸吸干后用透射电镜观察,结果如图3 所示。粒子呈球形,粒度分布均匀,粒径在 100 nm左右,与马尔文粒径测定结果相吻合。

Fig.3 TEM image of SA-SLNs图3 SA-SLNs 的透射电镜图
2.8 体外释放研究
按照《中华人民共和国药典》(2015 年版),采用透析袋法评价 SA-SLNs 的体外释放研究,由于 SA 在中性及碱性条件下溶解度较好[17],所以选择 pH 值 7.4 的磷酸盐缓冲液为释放介质。试验中取 5 mL 的 SA-SLNs 混悬液(相当于 SA 质量浓度为 15 g•L-1)置透析袋中,扎紧两端,置烧杯中,释放介质为 pH 值 7.4 的磷酸盐缓冲液,释放体积为 50 mL,转速为 100 rpm,于恒温磁力搅拌器中加热并维持在(37 ± 0.5)°C 进行实验。在预定的时间点取样 1.0 mL,同时补充等体积同温的新鲜释放介质,根据“2.2.1 色谱条件”进行测定,并计算各时间点 SA 的释放量。同时准确称量 75 mg SA,溶解于 5 mL 蒸馏水中,配制成质量浓度为 15 g•L-1的 SA 水溶液,以上述方法考察 SA 水溶液在 pH 值 7.4 释放介质中的释放情况。所有试验均平行操作三次。以累积释放百分率为纵坐标,取样时间为横坐标绘制释放曲线,并将释放结果拟合成动力学模型,进一步分析。
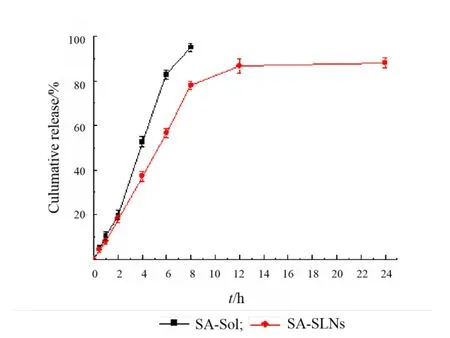
Fig.4 In vitro release profiles of SA from SA-Sol and SA-SLNs图4 SA 水溶液和 SA-SLNs 的体外释放曲线图
体外释放结果表明,8 h 后 SA 水溶液的累积释放量可达 95.00% 以上,而 SA-SLNs 在 8 h时累积释放量为 78.00%,表明 SA 水溶液和 SA-SLNs 的释放曲线存在显著差异(图4)。SASLNs 继续释放,12 h 时累积释放量为 86.74%,24 h 后的累积释放量仅为 88.16%,结果发现与12 h 相比,24 h 后的释放量没有明显增加,由此可知 12 h 后药物释放呈缓慢趋势。2015 版《中华人民共和国药典》中规定一个缓释制剂的释放度为 1 h:10%~30%;4 h:40%~60%;8 h:85%以上。所以制备的 SA-SLNs 释药速率缓慢,且释药效果较好。
SA-SLNs 的释放曲线被拟合到不同的动力学模型中,结果可知采用 Higuchi 模型[18]拟合较好,相关系数最高(r=0.944 6)(表6),表明 SA 在模拟肠道释放介质中 24 h 内的累积释放行为符合 Higuchi 动力学方程,模型药物 SA 以扩散驱动的方式从纳米粒中释放出来[19-20]。

Table 6 The simulated model for the release profiles of SA-SLNs表6 SA-SLNs 释放曲线的模型拟合
3 结论与讨论
a.根据 SA 的理化性质,作者采用熔融乳化超声法制备了 SA-SLNs,工艺简单、操作条件易得。以粒径和包封率作为评价指标,通过 Box-Behnken 实验设计法优化处方,对制备 SA-SLNs的影响因素:GMS 的用量、EL 的用量和 F68 的用量进行了筛选,并通过验证试验得到粒径较小且包封率较高的固体脂质纳米粒。通过本实验可以发现,Box-Behnken 实验设计法成功优化了SA-SLNs 的处方,且将 SA 包裹在 W/O/W 型复乳液的内水相中,提高了固体脂质纳米粒的包封率,减少了药物的损失。
b.Zeta 电位分析测定 SA-SLNs 的电位值为(-31.5 ± 0.019)mV。一般认为,当电位值的绝对值大于 30 mV 时,静电斥力使纳米粒子的存在相对稳定,不会出现粒子聚集且大颗粒沉淀的现象[21]。因此,从电位分析来看,SA-SLNs 稳定性较好。
c.制备得到的 SA-SLNs,使用 pH 计测定其 pH 值为 6.87。作为口服制剂,其 pH 值满足4~9 的生理耐受范围,符合要求。同时也为体外释放研究提供了参考。选择与制剂 pH 值相近的缓冲液作为体外释放介质,即 pH 值 7.4 的磷酸盐缓冲液,来模拟体液研究 SA 的释药情况。研究结果表明,将 SA 包裹在复乳液型的固体脂质纳米粒中,释药行为符合 Higuchi 动力学方程,释药速率合适,且效果较好。而关于药物疗效需进一步通过体内试验来考察。
d.作者成功制备了 SA-SLNs,处方简单、设计新颖、包封率较高。在后续研究中,将根据《中药、天然药物稳定性研究技术指导原则》,通过影响因素试验、加速试验等试验进一步考察SA-SLNs 的稳定性,并进行动物体内的药效学研究,为 SA-SLNs 的开发和应用提供参考。
