心脑舒通胶囊对氧糖剥夺/复氧损伤原代神经元的保护作用*
2021-02-24袁庆贾壮壮张彤刘文杰柴丽娟胡利民
袁庆,贾壮壮,张彤,刘文杰,柴丽娟,胡利民
(天津中医药大学中医药研究院,组分中药国家重点实验室,天津市中药药理学重点实验室,方剂学教育部重点实验室,天津 301617)
微管相关蛋白2(MAP-2)是中枢神经系统中一种重要的细胞骨架蛋白,尤以神经元胞体、树突等部位较为常见,主要参与神经元的生长及损伤后修复,对神经元突触的稳定性及可塑性等方面发挥重要作用[1-2]。有研究表明,脑缺血损伤会导致MAP-2等细胞骨架蛋白的降解,从而使得细胞骨架完整性遭到破坏,导致神经元轴突传导功能障碍,最终引起神经细胞的死亡[3]。心脑舒通胶囊是由中药蒺藜干燥的地上全草提取物而制成的胶囊剂,以蒺藜总皂苷为其主要活性成分,具有活血化瘀、补肝益肾等功效[4-5]。目前有关心脑舒通胶囊对脑缺血损伤的研究主要在炎症、氧化应激、神经营养以及其他如星型胶质细胞、小胶质细胞保护等方面[6-9],而对神经元细胞骨架蛋白及突触的研究较少。本实验通过对大鼠皮层原代神经元给予缺氧/复氧(OGD/R)处理,模拟脑缺血再灌注损伤过程,观察心脑舒通胶囊对OGD/R大鼠皮层神经元活力及微管相关蛋白表达的影响,探讨心脑舒通胶囊对损伤神经元的保护作用。
1 材料与方法
1.1 实验动物与试剂 出生24 h的SD大鼠[北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0006];心脑舒通胶囊(吉林敖东股份有限公司);DMEM/F12培养基(Gibco,美国);CellCounting Kit-8(DOJINDO,日本);Anti-MAP-2(CST,美国);二氧化碳(CO2)培养箱(THERMO,FORMA3111型,美国);缺氧小室(STEMCELL,27310,加拿大);倒置相差显微镜(Nikon,TE200,日本);多功能读板机(TECAN,INFINITE F50,瑞士);低温高速离心机(BECKMAN,64R型,美国)。
1.2 神经元细胞的原代培养 体外大鼠神经元的建立参照邓莉等[10]与孙琪等[11]的培养方法,略有改动。实验选取新生24 h内的Wistar大鼠乳鼠,经75%酒精消毒处理后立即断头处死,取脑置于冷的磷酸盐缓冲液(PBS)中并小心去除脑膜及大血管,于冰上小心分离出两侧大脑皮质于预冷的DMEM/F12培养基中,立即转入超净台内并进行杀菌处理;用小剪刀剪碎皮层组织,剪碎后加入约5 mL的0.25%胰蛋白酶于37℃恒温摇床内消化5 min,加入含血清培养液终止消化,轻吹细胞使其分散,经75 μm的筛网过滤,取滤液于4℃,1000 r/m,离心半径9.3cm,离心10 min后收集沉淀,用含10%胎牛血清(FBS)的DMEM/F12的全培基重悬细胞,轻吹细胞使其完全分散成单个细胞,接种于事先经多聚赖氨酸包被处理的培养板中,置37℃,5% CO2培养箱中静置培养。4 h后加入新鲜配制的B27全培养基(2%B27+1%青霉素+1%链霉素+0.5%谷氨酰胺+DMEM/F12),置37℃,5% CO2培养箱培养,隔天半量换B27全培养基。每日于倒置相差显微镜观察细胞形态和生长状况。
1.3 MAP-2免疫荧光法鉴定 24孔培养板经多聚赖氨酸包被处理后接种神经元细胞,待细胞生长至80%时进行免疫荧光鉴定处理。吸除培养板内液体并用PBS将细胞轻洗2遍,4%多聚甲醛室温固定15 min,用PBS轻洗3次,每次3 min。每孔加入300 μL封闭液,室温封闭60 min。随后加入 anti-MAP-2(1∶200)抗体于 4℃孵育过夜。次日用PBS洗涤3次,每次5 min。避光加入IgG-FITC(1∶1 000)荧光二抗,37 ℃孵育 30 min。用 PBS洗涤3次,每次 5 min,加入 Hochest 33342染液,并用抗荧光淬灭封片剂,倒置荧光显微镜下观察并拍照。
1.4 体外OGD/R损伤模型的建立 建立体外建立OGD/R损伤模型[12]:用PBS洗涤细胞2次,迅速加入无糖DMEM培养基,放入缺氧小室,向小室内持续充入含95% N2+5% CO2的混合气体6 min,放入37℃孵箱中分别培养2、3、4 h后,打开缺氧小室,取出培养板,弃去无糖缓冲液,加入含糖培养基,放入37℃、5% CO2培养箱培养24 h。对照组用含糖缓冲液洗细胞2次后,迅速加入含糖缓冲液,放入37℃,5% CO2培养箱孵育24 h。
1.5 心脑舒通胶囊对正常和OGD/R损伤神经元细胞活力的影响 首先检测不同浓度心脑舒通胶囊对体外正常神经元细胞活力的影响,以期明确实验所加药物对细胞无毒作用的浓度范围。具体步骤如下:对照组置换为基础培养基,加药组在对照组的基础上加入不同浓度心脑舒通胶囊(0.01、0.1、1、10、25、50 μg/mL)的培养基,正常孵育 24 h 后弃细胞上清,向每孔加入100μL的CCK-8工作液(终浓度10%),37℃孵育60 min,酶标仪450 nm波长检测各孔的吸光度值,吸光度值的大小与细胞活力成正相关。
对OGD/R损伤神经元细胞活力的检测,细胞缺氧处理方法如1.4所述,于复氧的同时加入不同浓度心脑舒通胶囊(0.01、0.1、1.612 5、3.125、6.25 μg/mL)的培养基,复氧24 h后向每孔加入含10% CCK-8的DMEM培养液100 μL,37℃孵育60 min,酶标仪检测各孔450 nm波长处吸光度值,筛选药物对氧OGD/R损伤神经元的有效剂量。
1.6 心脑舒通胶囊对OGD/R损伤神经元突触长度表达的影响 将原代神经元接种于事先经多聚赖氨酸包被处理的24孔培养板内,隔天换液,待细胞生长至80%时进行处理。首先将细胞分为对照组、模型组、心脑舒通胶囊给药组,细胞OGD/R及加药处理如1.4所述,并于复氧24h后进行MAP-2免疫荧光染色处理,如1.3所示。倒置荧光显微镜下进行拍照处理,每组随机拍摄10个视野,用Image J软件对图片进行荧光强度及突触长度的测定,结果取平均值。
1.7 心脑舒通胶囊对OGD/R损伤神经元MAP-2蛋白表达的影响 将原代神经元接种到多聚赖氨酸包被的6孔板,细胞OGD/R及加药处理如1.4所述。24 h后用预冷的PBS洗3次。每孔加入100 μL蛋白裂解液(含1%PMSF),于冰上震荡裂解30 min,刮下细胞于4℃12 000 r/min,离心半径9.3 cm,离心15min。吸取上清用BCA法测定蛋白浓度。10%SDSPAGE胶质进行电泳及转膜,5%的奶粉封闭2 h,封闭后将相应 PVDF 膜置于 Anti-MAP-2(1∶1 000)、Anti-β-actin(1∶1 000)抗体中,4 ℃过夜。次日用TBST 洗涤5min×3 次。加入IgG-HRP 二抗(1∶10000)孵育1 h,用TBST洗涤5 min×3次。自动曝光仪进行曝光,通过凝胶图像处理系统分析目的蛋白条带灰度值并计算相应蛋白表达量,实验重复3次。
1.8 统计学方法 数据由SPSS 24.0统计软件处理,计量资料统计结果以均数±标准差(±s)表示,多组样本均数比较采用单因素方差分析(one-way ANOVA),组间两两比较采用 LSD 法。P<0.05 为差异具有统计学意义。
2 结果
2.1 原代神经元鉴定 原代神经元细胞接种4 h后显微镜下观察到大部分细胞开始贴壁,少部分细胞长出短突起;24 h后观察大多数细胞已出现长突起;2~3 d后观察,细胞突起增多、增粗,胞体变得更加透亮;4 d后突起密集,细胞间开始形成突触联系;7~9 d,突触的分支大量增多,且细胞间建立起更为紧密的联系(见图1左)。利用MAP-2免疫荧光化学法进行鉴定,结果显示神经元细胞形态正常且纯度达到95%以上(见图1右),可用于后续实验。
2.2 神经元OGD/R损伤模型的建立 实验进一步对神经元进行OGD/R损伤条件的摸索,与对照组比较,缺氧2、3、4 h/复氧24 h后,细胞活力均有所下降,缺氧2 h损伤程度较低细胞活力约为对照组的76%,后期实验中可能造成模型不成功;缺氧4 h损伤过于严重活力约为对照组的41%,可能影响药效的发挥;缺氧3 h后细胞活力约为对照组的56%,故选取OGD3 h/R24 h建立OGD/R损伤模型。见图2。
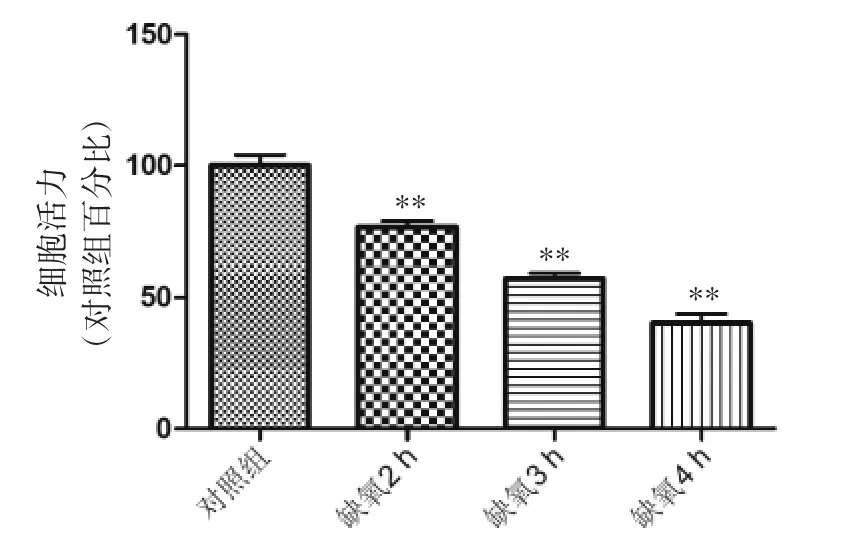
图2 神经元细胞OGD/R模型的建立Fig.2 Establishment of OGD/R model of neuron
2.3 心脑舒通胶囊对正常及OGD/R损伤神经元细胞活力的影响 CCK-8结果显示与对照组比较,心脑舒通胶囊在10、25、50 μg/mL浓度对正常培养神经元细胞活力显著降低(P<0.05),表明心脑舒通胶囊在该浓度范围内对神经元细胞有一定的细胞毒作用,因此选取低于10 μg/mL浓度的心脑舒通胶囊(0.01、0.1、1.612 5、3.125、6.25 μg/mL) 进行后续实验;而在OGD/R损伤条件下,与模型组比较,心脑舒通胶囊在 3.125、6.25 μg/mL 浓度能显著增加OGD/R 损伤神经元的细胞活力(P<0.05),且在3.125 μg/mL浓度作用最为显著,故选择该浓度进行后续免疫荧光实验。见图3。
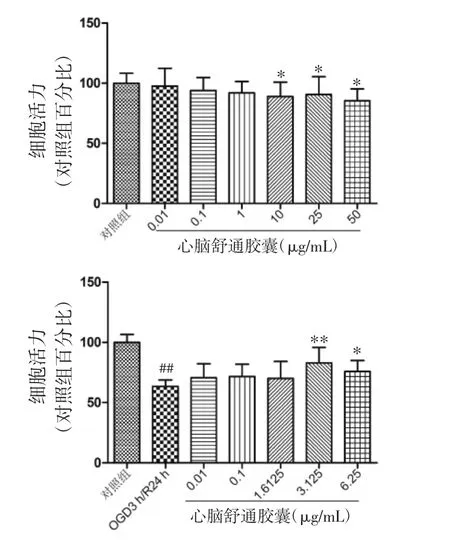
图3 心脑舒通胶囊对正常及OGD/R损伤神经元细胞活力的影响Fig.3 Effects of Xinnao Shutong Capsule on normal and OGD/R neuronal cell viability
2.4 心脑舒通胶囊对OGD/R损伤神经元突触长度表达的影响 MAP-2蛋白荧光强度检测可反映神经元MAP-2的蛋白表达情况,荧光强度越高表明其蛋白表达量越高,反之亦然。MAP-2免疫荧光结果显示,与对照组比较,模型组荧光强度显著降低,表明OGD/R损伤后神经元MAP-2蛋白表达显著降低,对其突触长度进行测定结果显示,模型组神经元突触长度也显著降低(P<0.01);与模型组比较,心脑舒通胶囊在 3.125 μg/mL浓度能显著增加OGD/R损伤神经元的MAP-2荧光强度以及神经元突触长度(P<0.01)。见图 4。
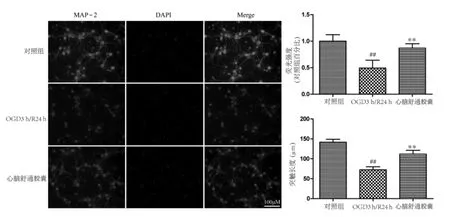
图4 心脑舒通胶囊对OGD/R损伤神经元突触长度表达的影响Fig.4 Effects of Xinnao Shutong capsule on the expression of synaptic length in neurons injured by OGD/R
2.5 心脑舒通胶囊对OGD/R损伤神经元MAP-2蛋白表达的影响 与对照组比较,模型组能显著降低神经元的MAP-2蛋白表达量(P<0.05);与模型组比较,心脑舒通胶囊能显著增加MAP-2蛋白表达水平(P<0.05)。见图5。
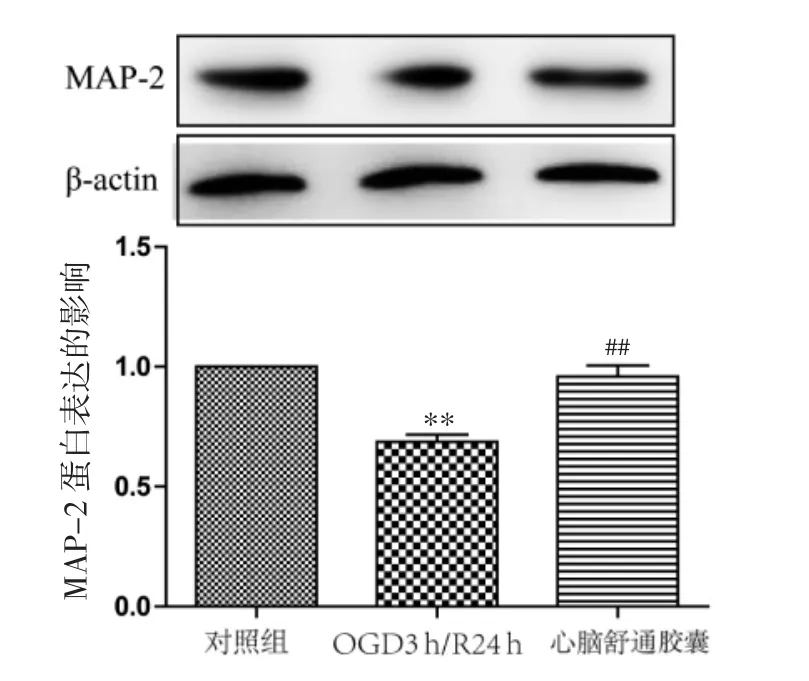
图5 心脑舒通胶囊对OGD/R损伤神经元MAP-2蛋白表达的影响Fig.5 Effect of Xinnao Shutong Capsule on the expression of MAP-2 protein in neurons injured by OGD/R
3 讨论
脑缺血再灌注损伤是指脑组织在遭受一定时间缺血而恢复血供后,不但其功能未能恢复,其组织损伤程度反而加重的病理现象,其主要通过一系列反应诱导细胞凋亡最终导致神经元死亡[13]。有研究表明,再灌注过程中机体会产生一定程度的内源性神经修复反应,但该作用往往有限,不足以修复再灌注损伤后严重的神经功能障碍,因此需要给予一定的外源性药物从而增强神经修复过程[14]。
MAP-2是一种重要的细胞骨架蛋白,集中表达于脑组织内,在神经元的胞体及树突均有分布,其主要功能与神经再生、细胞凋亡及突触可塑性等方面有关[15]。MAP-2是神经元中的标志性微管相关蛋白,其含量的变化可反映神经元的存活状态和功能变化[16]。脑缺血再灌注损伤初期即发见MAP-2的表达量出现明显下调,其表达降低可使细胞微管结构发生不稳定变化,甚至引起神经元不可逆损伤。Gotohda等[17]通过体内实验使大鼠吸入一定剂量甲苯以造成神经元的损害,结果发现受损神经元内的MAP-2含量较正常神经元明显减少。Cao等[18]通过使沙鼠脑干发生短暂性缺血后通过免疫组化方法检测不同时间缺血脑组织内MAP-2的表达情况,结果显示随着缺血时间的延长及神经元的死亡,其MAP-2的表达量逐渐降低,表明MAP-2是反应神经元损伤的敏感指标。MAP-2对神经元的发育和可塑性也具有重要调节作用。Chiba等[19]通过对脊髓损伤的大鼠进行骨髓间充质干细胞移植处理,结果发现经过干细胞移植处理的大鼠后肢功能恢复能力明显加快,且发现在皮质区脊髓灰质内MAP-2的阳性表达明显增加,该结果提示MAP-2可能参与了神经元间突触连接的建立及神经环路的重建。
研究结果发现,与对照组比较,OGD/R损伤神经元无论在细胞活力还是MAP-2荧光强度表达强度及蛋白表达量均显著下降,且通过测量突触长度发现其突触长度明显短于对照组,表明其神经元中MAP-2表达量量降低,突触受损断裂严重,推测缺血再灌注损伤导致的MAP-2表达下降可能使神经细胞功能受损,影响神经元的再生及可塑性,甚至死亡。而在模型组的基础上给予心脑舒通胶囊干预后神经元细胞活力、MAP-2荧光强度、突触长度及其蛋白表达量均显著升高,提示心脑舒通胶囊可促进受损神经元MAP-2的表达,从而维持细胞稳定性及突触可塑性,进而说明其在神经元可塑性方面发挥重要作用。
综上所述,心脑舒通胶囊在OGD/R损伤神经元存活方面发挥重要保护作用,且其作用机制与促进细胞骨架蛋白MAP-2表达及突触稳定性有关。