新藤黄酸通过PTEN-PI3K/AKT/VEGF/eNOS信号通路干预人脐静脉内皮细胞血管生成的研究
2021-02-24李庆林
高 俊,程 卉,李庆林
(1.安徽中医药大学药学院,安徽 合肥 230012;2.安徽中医药大学新安医学教育部重点实验室,安徽 合肥 230038)
细胞迁移也称为细胞爬行,是正常细胞的基本功能之一,表现为细胞头部伪足延伸、建立新的黏附、细胞体尾部收缩的交替进行,是机体正常生长发育的生理过程。细胞迁移涉及血管生成、癌症转移、炎症反应、动脉粥样硬化等过程。
肿瘤血管生成是从已存在的血管床中形成新生血管,是一个受众多生长因子调节的复杂的病理生理过程,多种细胞因子和细胞基质参与肿瘤的生长、转移、复发。其过程包括:肿瘤细胞与正常血管内皮细胞相互作用;肿瘤细胞与细胞外基质相互作用;相关细胞的参与及大量白细胞因子的调节,使得新生血管得以形成。抗肿瘤血管生成的主要机制:抑制促血管生成因子与配体的表达和结合及相应的信号传递途径,抑制血管内皮细胞的增殖、迁移,抑制基底膜的降解等。
藤黄是藤黄科植物藤黄的干燥树脂,具有攻毒蚀疮、破血散结等功效。现代研究表明,新藤黄酸(gambogenic acid,GNA)为藤黄中的活性成分之一,具有良好的抗肿瘤活性。本课题组前期研究发现,GNA对多种肿瘤细胞如人乳腺癌MCF-7和人肝癌BEL-7402细胞的增殖均有抑制作用。近期实验研究表明,GNA对肿瘤的血管生成、侵袭转移也具有一定的抑制作用。本研究选择人肺腺癌A549细胞和人脐静脉内皮细胞(human umbilical vein endothelial, HUVECs)建立体外非直接接触式共培养体系,观察GNA对HUVECs迁移能力的影响,探讨GNA抗人肺腺癌A549细胞侵袭转移的作用及GNA影响血管生成的信号转导机制,为GNA的开发和应用提供理论依据。
1 试剂与材料
1.1 细胞株 人肺腺癌细胞株A549、HUVECs购于中国科学院上海细胞库。
1.2 试剂 GNA(分子量为630.8,纯度>98.0%,货号 B50231):上海源叶生物有限公司提供;胎牛血清(货号 16140071)、DMEM高糖培养基(货号 12100046):美国GIBCO公司;Matrigel胶(货号 356234):美国BD公司;Boyden小室:美国康宁公司;聚碳酸酯膜孔径8.0 μm,NO检测试剂盒(货号 A012):南京建成生物工程研究所;LY294002、L-NAME(货号 S0006):江苏碧云天生物技术研究所;β-actin、eNOS抗体:美国Santa Cruz Biotechnology;NS-siRNA、第10号染色体缺失的磷酸酶及张力蛋白同源的基因(phosphatase and tensin homolog deleted on chromosome ten, PTEN) siRNA(序列:5′-GGCUAAGUGAAGAUGACAATT-3′;5′-UUGUCAUCUUCACUUAGCCTT-3′):上海吉玛生物工程公司;Lipofectamine 2000(货号 11668-019):美国Invitrogen公司。
1.3 仪器 细胞培养箱、-80 ℃冰箱:日本Sanyo公司;倒置显微镜:日本Olympus公司;超净工作台:浙江苏净净化设备有限公司;灭菌锅:日本Hirayama公司;高速冷冻离心机:德国Eppendorf;倒置荧光显微镜(DMI-6000B):德国徕卡公司;垂直电泳仪:上海天能科技有限公司。
2 方法
2.1 倒置显微镜下观察GNA对HUVECs形态的影响 取对数生长期的HUVECs,消化和收集,将细胞密度调整为6×10mL,接种于25 mL培养瓶。37 ℃、5% CO培养箱中培养24 h后,更换含有GNA的条件培养液,倒置显微镜下观察细胞并拍照。
2.2 改良的Boyden chamber检测GNA对HUVECs转移能力的影响 将Matrigel胶与预冷的无血清DMEM培养基按照1∶3的比例稀释加至Boyden小室中,每孔容积为50 μL,冰上操作。条件培养箱孵育5 h后,向上室加入200 μL的HUVECs悬液,下室中加入500 μL的A549细胞悬液,置于37 ℃,5% CO培养6 h后加药,继续培养24 h后取出小室,清洗上室残留细胞,4%多聚甲醛固定30 min后用0.1%结晶紫染液染色25 min,PBS洗涤3次,于倒置荧光显微镜下计数并拍照。
2.3 细胞划痕实验 于6孔板以每孔约2×10接种HUVECs,待细胞长满6孔板,用无菌200 μL加样枪头垂直于6孔板均匀划痕,用PBS轻洗细胞2~3遍后进行0 h取样,此为空白对照组,加入含不同浓度GNA的条件培养基,24 h后于倒置显微镜下取样。
2.4 NO水平的检测 采用硝酸还原酶法检测NO水平。不同药物组作用HUVECs 24 h后吸弃细胞培养液,收集细胞后超声裂解,2 000 r/min离心,收集上清,按照说明书的步骤操作,采用多功能酶标仪于550 nm处检测各组的吸光度。根据说明书提供的计算公式,计算细胞中NO的水平。
2.5 Western blot法检测GNA及LY29400预处理对HUVECs内磷脂酰肌醇3激酶(phosphatidylinositol 3 kinase, PI3K)、p-PI3K、蛋白激酶B(protein kinase B, AKT)、p-AKT表达水平的影响 各组HUVECs分别处理24 h后,无菌细胞刮刮取细胞后,收集,离心提取总蛋白,进行BCA蛋白定量。每组样品总蛋白25 μg,经12% SDS-PAGE电泳,分离蛋白。转膜后5%脱脂奶粉常温封闭3 h,一抗(稀释比例1∶1 000)4 ℃孵育过夜。TBST漂洗3次,每次10 min,二抗常温孵育2 h,再用TBST漂洗3次,每次10 min,加入ECL发光底物,曝光,采用平均灰度值比较各组蛋白的表达水平。
2.6 PTEN-siRNA转染细胞,琼脂糖凝胶电泳检测血管内皮生长因子(vascular endothelial growth factor, VEGF)表达水平 取对数生长期的A549细胞1×10/mL接种至6孔板,每孔加入1.8 mL无抗生素的培养基,37 ℃、5% CO培养箱孵育过夜。弃去6孔板中旧培养基,PBS洗2次,各孔加入不含抗生素培养液1.8 mL,按说明书操作配制好转染试剂并加入,轻轻混匀后培养箱培养6 h,倒置荧光显微镜下拍照,观察转染效率。提取总RNA,逆转录PCR,分别将VEGF、β-actin扩增产物(见表1)各5 μL与1 μL 6×SDS上样缓冲液混匀后,用移液器加样,电压90 V,电泳约40 min,取胶放置在凝胶成像系统上,紫外光下拍照,采用Biocapt MV软件测定吸光度(A),采用Image J分析各组条带光密度值,并采用Graphpad 5.0作图。

表1 VEGF、β-actin基因引物表

3 结果
3.1 条件培养基的制备 将A549细胞2×10接种于75 mL培养瓶,12 h后取培养液,离心后取上清,再加入10%胎牛血清,-20 ℃冻存备用。使用前加入不同浓度的GNA,此为HUVECs的条件培养基。
3.2 倒置显微镜下观察GNA对HUVECs形态的影响 空白对照组中细胞贴壁牢固,折光性强;1 μmol/L GNA组细胞核固缩变圆,体积变小,贴壁细胞有少量出现漂浮现象;2 μmol/L GNA组少数细胞体积变大,折光性明显变弱,细胞呈现坏死状态;4 μmol/L GNA组大量细胞固缩变圆,漂浮于培养液中。见图1。
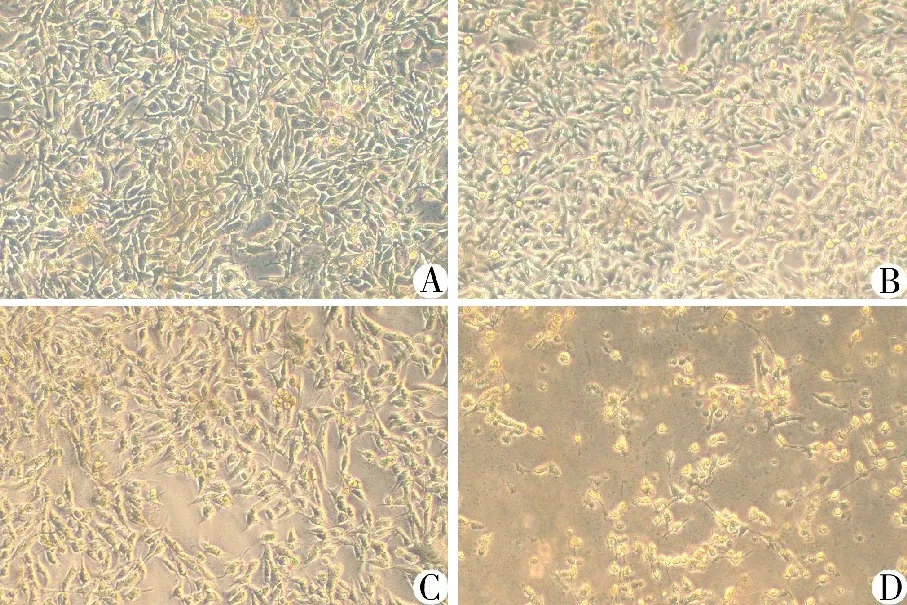
注:A.空白对照组;B.1.0 μmol/L GNA组;C.2.0 μmol/L GNA组;D.4.0 μmol/L GNA组
3.3 Boyden小室实验观察GNA对HUVECs迁移的影响 倒置荧光显微镜下观察发现,接种至Boyden小室上室中的细胞,5~6 h后开始贴附于凝固的Matrigel胶上,24 h后倒置荧光显微镜下观察,与空白对照组相比,2 μmol/L GNA组和50 μmol/L LY294002组可以降低细胞迁移数目(P
<0.05);与空白对照组及2 μmol/L GNA组相比,2 μmol/L GNA+50 μmol/L LY294002组能够显著降低细胞迁移数目(P
<0.05)。见图2、表2。
注:A.空白对照组;B.2 μmol/L GNA组;C.50 μmol/L LY294002组;D.2 μmol/L GNA+50 μmol/L LY294002组

表2 Boyden小室实验观察GNA对HUVECs迁移的影响
3.4 细胞划痕实验观察GNA对HUVECs划痕愈合的影响 实验24 h后,GNA各处理组较空白对照组划痕愈合变慢(P
<0.05)。结果表明,GNA可抑制HUVECs的划痕愈合,并且呈一定的剂量依赖性,见图3、表3。3.5 GNA对不同抑制剂处理的HUVECs中NO水平的影响 LY294002及L-NAME抑制剂作用HUVECs后,采用硝酸还原酶法测定NO含量,判断GNA对内皮型一氧化氮合酶(endothelial nitric oxide synthase, eNOS)活力的影响。实验结果显示,2 μmol/L GNA组能够显著降低NO水平(P
<0.05),与PI3K抑制剂LY294002组效果接近,且2 μmol/L GNA+50 μmol/L LY294002组NO水平更低(P
<0.05)。见表4。与空白对照组比较,GNA组、L-NAME组NO水平显著降低(P
<0.05),且GNA+L-NAME组NO水平更低(P
<0.05)。见表5。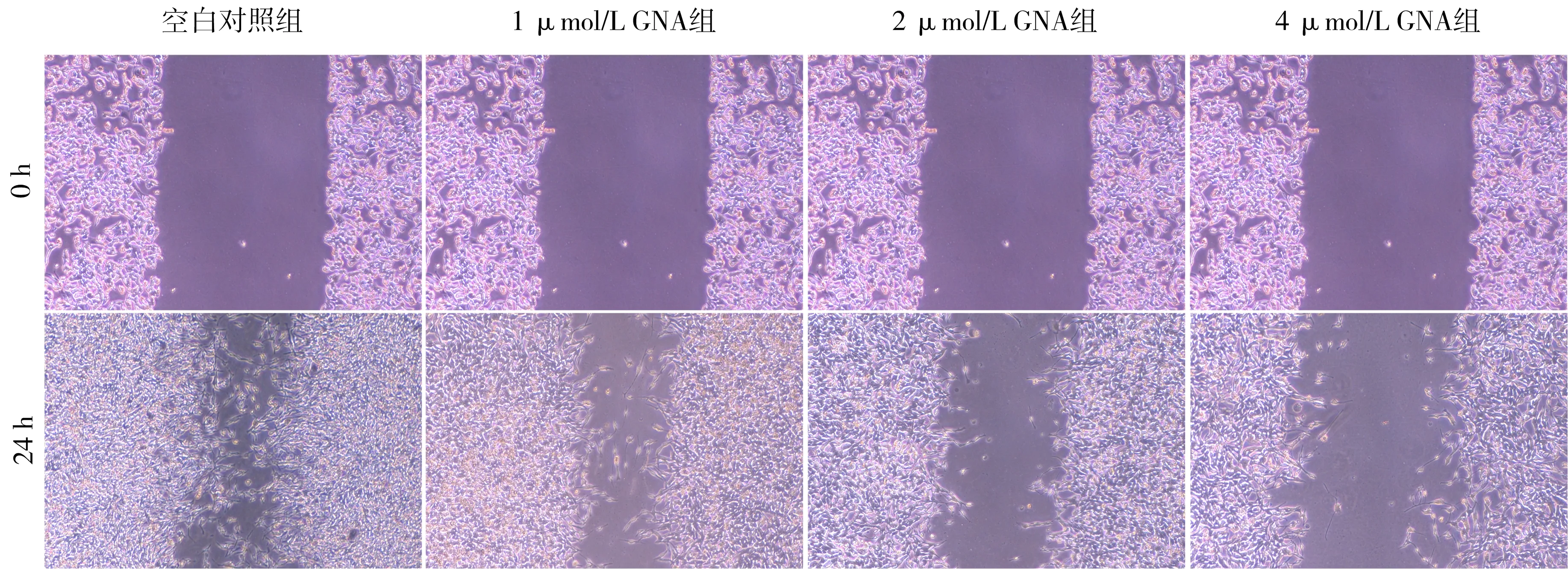
图3 细胞划痕实验观察GNA对HUVECs划痕愈合的影响(结晶紫染色,10×20倍)

表3 细胞划痕实验观察GNA对HUVECs划痕愈合的影响

表4 GNA及PI3K抑制剂对细胞培养上清中NO水平的影响

表5 GNA及L-NAME对HUVECs上清中NO水平的影响
3.6 Western blot实验检测结果
3.6.1 Western blot法检测GNA对HUVECs内PI3K、p-PI3K、AKT和p-AKT蛋白表达水平的影响 Western blot实验结果显示,GNA作用HUVECs后,p-PI3K和p-AKT蛋白表达水平随着药物浓度的增加呈剂量依赖性下降(P
<0.05);而PI3K和AKT蛋白表达水平基本不变。见图4、表6。3.6.2 GNA对LY294002预处理HUVECs相关蛋白表达水平的影响 为了进一步研究GNA对HUVECs迁移的信号转导通路,本研究检测PI3K/AKT的上游负性调控蛋白PTEN的表达水平,见图5。同时,采用PI3K特异性抑制剂LY294002和不同浓度的GNA作用HUVECs 24 h后,检测eNOS的含量变化,见图6。结果表明,细胞内PTEN蛋白的表达水平随着GNA浓度的增加而呈浓度依赖性增加(P
<0.05),见表7。2 μmol/L GNA作用HUVEC 24 h后,eNOS表达水平下降(P
<0.05),而PI3K抑制剂LY294002与GNA联合使用具有协同作用,促进eNOS蛋白表达水平进一步降低(P
<0.05),见表8。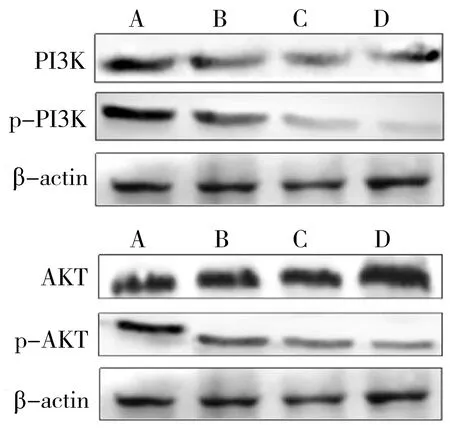
注:A.空白对照组;B. 1μmol/L GNA组;C. 2 μmol/L GNA组;D. 4 μmol/L GNA组

表6 GNA对HUVECs内p-PI3K、PI3K、p-AKT、AKT蛋白相对表达水平的影响

注:A.空白对照组;B. 1 μmol/L GNA组;C. 2 μmol/L GNA组;D. 4 μmol/L GNA组

表7 GNA对HUVECs血管生成相关蛋白PTEN相对表达水平的影响

注:A.空白对照组;B. 2 μmol/L GNA组;C. 50 μmol/L LY294002组;D. 2 μmol/L GNA+50 μmol/L LY294002组

表8 GNA对HUVECs血管生成相关蛋白eNOS相对表达水平的影响
3.7 GNA对转染PTEN-siRNA的HUVEC中VEGF mRNA表达水平的影响 电泳图和Image J软件的分析结果显示,与空白对照组比较,GNA组能下调VEGF mRNA的表达水平(P
<0.05),而与GNA组比较,PTEN-siRNA组及PTEN-siRNA+GNA组VEGF mRNA的表达水平上调(P
<0.05)。见图7、表9。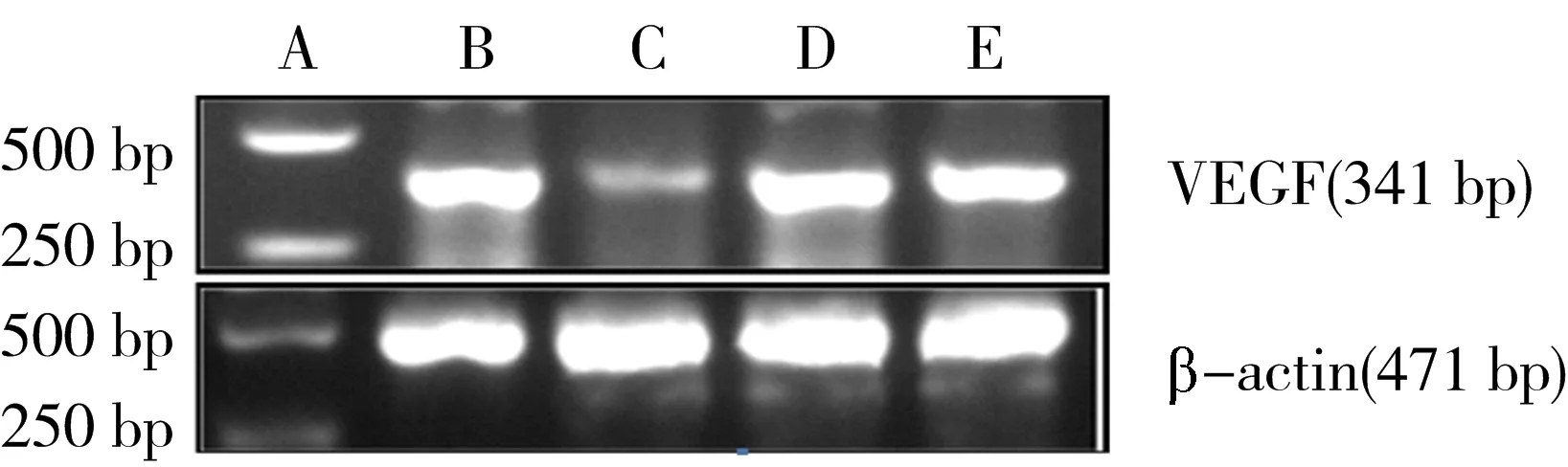
注:A.maker;B.空白对照组;C.GNA组;D.PTEN-siRNA组;E.PTEN-siRNA+GNA组

表9 GNA对转染PTEN-siRNA的HUVEC中VEGF mRNA相对表达水平的影响
4 讨论
PI3K家族是细胞内重要的信号传导分子,参与调控多种信号通路。PI3K/AKT信号通路在人类肿瘤谱中广泛失调,IA型PI3K和其下游分子AKT所组成的信号通路不仅调节肿瘤细胞的增殖和存活,与肿瘤的血管新生过程、侵袭转移行为也密切相关。PI3K/AKT信号通路受多种因子的调节,主要为负调节分子,如PTEN等抑癌蛋白。PTEN所编码的蛋白能使PIP3去磷酸化,阻断PI3K/AKT信号通路,从而促进细胞凋亡、抑制细胞增殖、抑制肿瘤血管新生和肿瘤迁移等作用。Jiang等研究表明,PI3K/AKT信号通路参与了血管生成,PETN可抑制这种效应。而PI3K/AKT通路与VEGF之间的关联在肿瘤血管生成中发挥了重要作用。研究表明,VEGF在多种肿瘤中高度表达,其通过诱导内皮细胞增殖、迁移,促进血管外基质降解等途径促进肿瘤血管生成。VEGF可提高血管通透性,促进血浆蛋白渗漏形成血管外纤维蛋白基质,为内皮细胞迁移提供网架;在多种细胞因子和蛋白酶协同作用下,使迁移出的内皮细胞延伸形成新生血管;经活化的蛋白水解酶降解肿瘤边缘细胞外基质,促使肿瘤细胞外渗而形成转移。
PI3K/AKT不仅是机体内重要的信号调控途径之一,并且是调控eNOS的关键信号途径之一。目前研究表明,第一个明确由AKT作用的促进血管形成的物质是eNOS。其表达与肿瘤侵袭和迁移、肿瘤血管分化和形成关系密切。AKT调节eNOS活性,与血管生成关系密切,在VEGF的作用下,活化的AKT和eNOS结合,eNOS被磷酸化丝氨酸激活,产生NO,从而引起血管舒张、血管重塑和血管生成。Ma等研究发现,PI3K/AKT的负调节分子PTEN可通过PI3K/AKT/VEGF/eNOS信号通路抑制肿瘤血管生成。
本课题组前期研究结果表明,GNA能够下调HUVECs的p-PI3K,p-AKT蛋白的表达水平且呈剂量依赖性,与对照组比较,差异具有统计学意义(P
<0.05)。同时,采用PI3K特异性抑制剂LY294002处理细胞后,Western blot法检测表明VEGF的蛋白表达水平显著下调,提示GNA抑制血管生成与PI3K/AKT信号通路有关,且下游通路中VEGF起着非常关键的作用。本实验在此基础上,通过抑制剂LY294002预处理HUVECs,Western blot法检测HUVECs内PTEN、eNOS蛋白水平的表达变化,结果显示,PTEN蛋白表达水平随着GNA的浓度增加而增加,eNOS蛋白表达水平下降,且GNA 2 μmol/L与LY294002联用后作用更强。用Boyden chamber小室分析GNA以及LY294002对HUVEC转移能力的影响,发现GNA以及LY294002都能抑制细胞转移。细胞划痕愈合实验结果表明,不同浓度GNA均可抑制血管内皮细胞迁移,且呈剂量依赖性。采用LY294002和eNOS特异性抑制剂L-NAME处理细胞,硝酸还原酶法检测eNOS的表达水平,结果表明,2 μmol/L GNA和LY294002联用以及2 μmol/L GNA和L-NAME联用均能显著降低eNOS的含量;RT-PCR结果表明,沉默PTEN基因会促进VEGF表达水平的上调。综上所述,GNA可能通过PTEN-PI3K/AKT/VEGF/eNOS通路影响HUVECs的迁移和血管形成。
