昆虫性别决定机制研究进展及展望
2021-02-23翟宗昭
彭 威,翟宗昭
(蛋白质化学与鱼类发育生物学教育部重点实验室/淡水鱼类发育生物学国家重点实验室/动物肠道功能调控湖南省重点实验室/湖南省动物肠道生态与健康国际科技创新合作基地,湖南师范大学,长沙 410081)
长期以来,性别决定的调控和进化是发育和进化生物学研究的一个重大问题。性别决定是物种进化选择的结果,也是生物生命活动的基本特征。昆虫性别决定机制具有多样性和复杂性,即使在相近的物种之间甚至是相同物种的不同种群间都存在不同的性别决定机制[1-4]。昆虫中普遍的性别决定模式是,早期胚胎性别决定原始信号(primary signal)激活性别决定级联基因特异性剪切,级联基因性别特异性产物调控个体分化为雄性或者雌性;缺少原始信号导致默认的基因剪切模式调控相反的性别发育[5-7]。在昆虫性别决定机制的进化过程中,性别决定级联底层基因高度保守,而性别决定原始信号多变[8,9]。性别决定原始信号主要有X染色体相连的信号元素(X chromosome-linked signal elements,XSE)、雄性决定因子(Male determiner factor,M-factor)、基因的纯合性或杂合性、piwi-interacting RNA(piRNA)等。性别决定原始信号调控关键基因transformer(tra)雌雄差异性表达,tra产物和transformer-2(tra-2)基因通过性别特异选择性剪切机制实现底层双性基因doublesex(dsx)雌雄特异表达,继而调控雌雄发育相关基因在两性中的表达,实现雌雄性别分化。昆虫性别决定级联基因如tra和dsx通过性别特异选择性剪切方式调控自身表达,进而传递性别发育信号。本文介绍了昆虫性别决定关键基因tra、tra-2和底层保守基因dsx的概况,对不同昆虫性别决定原始信号及其性别决定调控机制进行了综述,以期为靶标昆虫性别决定的害虫不育防治技术提供理论支持。
1 昆虫性别决定原始信号及其调控机制研究进展
昆虫具有多种机制决定性别,其性别决定原始信号差异巨大(图1)。早期胚胎性别决定原始信号激活级联基因性别特异选择性剪切,级联基因性别特异产物调控个体分化为雄性或者雌性。双翅目模式物种黑腹果蝇Drosophila melanogaster是XX/XY染色体性别决定系统,其性别决定通过XSE>Sex lethal(Sxl)>tra/tra-2>dsx级联基因调控。雌性个体双倍剂量的XSE作为性别决定原始信号启动Sxl基因表达,SXL蛋白调控tra基因mRNA前体(pre-mRNA)雌性特异选择性剪切产生功能TRA蛋白,TRA蛋白和辅助因子TRA-2蛋白共同促进dsx基因pre-mRNA雌性特异选择性剪切,雌性特异DSXF蛋白指导雌性分化。雄性个体单倍剂量的XSE不足以启动Sxl基因的表达,tra基因pre-mRNA在缺少SXL蛋白的情况下进行雄性特异选择性剪切,产生无功能TRA蛋白,进而调控dsx基因pre-mRNA产生雄性特异DSXM蛋白,促进雄性分化(图1)[10-13]。
双翅目昆虫家蝇Musca domestica和地中海实蝇Ceratitis capitata是XX/XY染色体性别决定系统,Y染色体相连的雄性决定因子(M-factor)是性别决定的原始信号。其性别决定通过M-factor>tra/tra-2>dsx级联基因调控,Sxl基因不参与家蝇和地中海实蝇性别决定。其性别决定由雄性决定基因male determiner(Mdmd)和Maleness-on the-Y(MoY)存在与否决定。XY雄性胚胎中父本继承的Mdmd基因和MoY基因阻止合子中母本tra基因的活化,dsx基因pre-mRNA在缺少TRA蛋白下进行雄性特异选择性剪切,产生雄性特异DSXM蛋白,进而实现雄性性别决定和分化。XX雌性胚胎缺少Mdmd基因和MoY基因,来源于合子中的母本tra基因建立正反馈自动调控循环,转录产生功能TRA蛋白,TRA蛋白和辅助因子TRA-2蛋白共同指导dsx基因pre-mRNA雌性特异选择性剪切,产生雌性特异DSXF蛋白,完成雌性性别决定和分化(图 1)[14,15]。地中海实蝇雄性决定基因MoY同时也是橘小实蝇Bactrocera dorsalis和橄榄果实蝇Bactrocera oleae的性别决定原始信号,其功能具有保守性[15]。
双翅目昆虫蚊子的性别决定原始信号是雄性决定因子(M-factor),由于蚊子缺少tra同源基因,其性别决定通过M-factor>dsx级联基因调控,雄性决定基因直接调控底层保守基因dsx的表达。埃及伊蚊Aedes aegypti、冈比亚按蚊Anopheles gambiae和斯氏按蚊Anopheles stephensi雄性决定基因分别是Nix、Yob和Guy1,三者在雄性胚胎早期转录表达,不具有序列同源性。Nix、Yob和Guy1基因调控dsx基因pre-mRNA雄性特异选择性剪切,产生雄性特异DSXM蛋白,实现雄性性别发育。雌性个体缺少Nix、Yob和Guy1基因,导致dsx基因pre-mRNA雌性特异选择性剪切,产生雌性特异DSXF蛋白,从而实现雌性性别发育(图1)[16-18]。埃及伊蚊雄性染色体缺少 Y染色体,其雄性决定基因Nix位于 1号染色体的非重组区域,Nix基因不调控剂量补偿。冈比亚按蚊和斯氏按蚊雄性决定基因Yob和Guy1不仅调控雄性性别决定,而且通过上调雄性单条X染色体上的基因表达量来实现剂量补偿。
膜翅目是单倍二倍体性别决定系统:雄性是从未受精卵发育而来的单倍体,只继承到母本的基因组;而雌性是从受精卵发育来的双倍体,继承到父本和母本的基因组。膜翅目昆虫性别决定机制主要是补偿型性别决定机制,如意蜂Apis mellifera,其性别决定的原始信号是complementary sex determiner(csd)基因的纯合性或杂合性,其性别决定通过csd>fem>dsx级联基因调控[19-21]。雌性个体中来源于杂合的csd基因产生功能Csd蛋白,指导feminizer(fem)基因pre-mRNA雌性特异选择性剪切,产生功能Fem蛋白,Fem蛋白调控dsx基因pre-mRNA雌性特异选择性剪切,产生雌性特异DSXF蛋白,推动雌性发育。fem基因是tra基因的同源基因。雄性个体中来源于纯合子或半合子的csd基因产生无功能Csd蛋白,导致fem基因pre-mRNA雄性特异选择性剪切,产生无功能Fem蛋白,进而导致dsx基因pre-mRNA雄性特异选择性剪切,产生雄性特异DSXM蛋白,推动雄性发育(图1)。最近,在丽蝇蛹集金小蜂Nasonia vitripennis中鉴定出性别决定基因wasp overruler of masculinization(wom),wom从父本提供的基因组中转录至受精卵中,以启动雌性发育。而wom母源沉默导致单倍体胚胎雄性发育[22](图1)。
鳞翅目物种表现出与双翅目、膜翅目等昆虫显著不同的性别决定系统,家蚕Bombyx mori是ZW性染色体系统,雄性是ZZ型,而雌性是ZW型[23]。来自于W染色体的一种雌特异fempiRNA是家蚕性别决定的原始信号,其性别决定通过fempiRNA>Masc>dsx级联基因调控。fempiRNA通过抑制来自于Z染色体Masculinizer(Masc)基因的表达,导致家蚕dsx基因pre-mRNA在缺少Masc蛋白和PSI蛋白下进行雌特异选择性剪切,产生雌性特异DSXF蛋白,从而实现雌性发育。雄性个体缺少fempiRNA,MascmRNA正常表达,家蚕dsx基因pre-mRNA在Masc蛋白和PSI蛋白指导下进行雄特异性选择性剪切,产生雄性特异DSXM蛋白,实现雄性发育(图1)[24]。在家蚕性别决定途径中,PSI基因通过结合dsx基因pre-mRNA雌性特异外显子上的CE1序列来调控dsx雄性特异选择性剪切。Imp基因通过增加PSIRNA结合能力提高dsx基因pre-mRNA雄性特异选择性剪切。PSI和Imp蛋白与已知的Ser/Arg(SR)蛋白,如TRA和TRA-2不具有序列相似性。
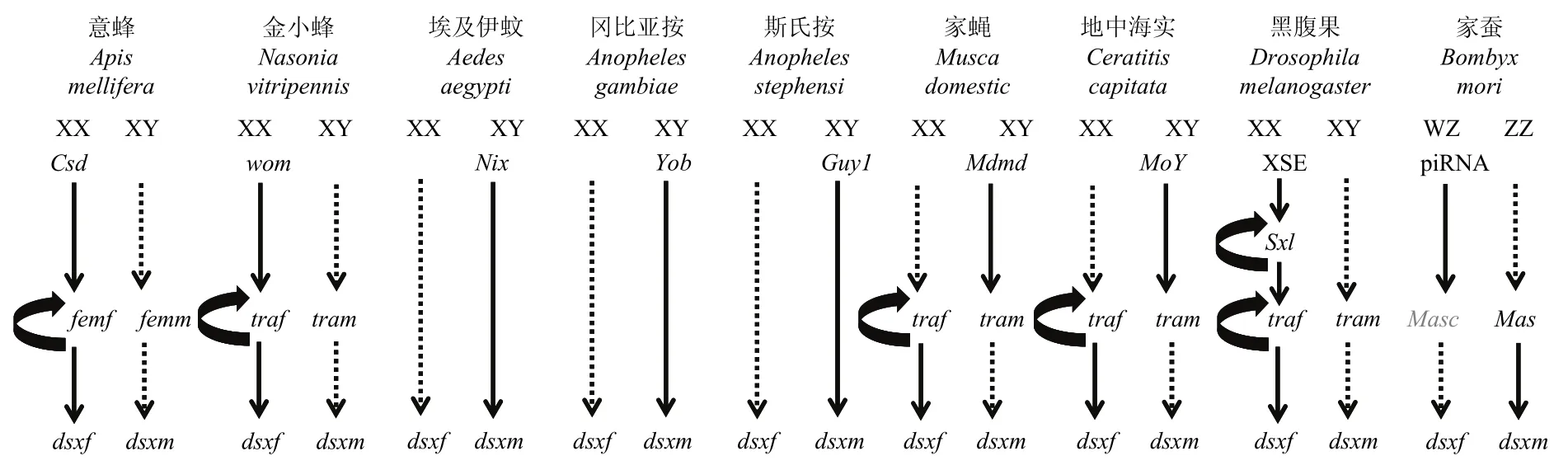
图1 昆虫性别决定机制Fig. 1 Sex determination mechanism in insects
2 昆虫性别决定底层基因doublesex概况
Dsx基因是昆虫性别级联系统中的底层基因,其结构和功能在不同昆虫中具有保守性,调控躯体性别分化[25,26]。不同昆虫编码的DSX蛋白主要包括两部分:共同的氨基端(N端)与雌雄特异的羧基端(C端)。N端包含一个能与DNA结合的保守基序DM(doublesexandmab-3)结构域,由 DNA结合结构域(DBD)和寡聚化结构域(OD1)组成,是一种由半胱氨酸和组氨酸组成的锌指结构,该结构域是 DSX蛋白与下游靶标基因结合的重要位点,而C端雌雄特异的OD2结构域激活或者抑制下游靶标基因的表达[27-32]。dsx基因在昆虫中通过自身可变剪切产生雌雄特异DSX蛋白(DSXF和DSXM蛋白),DSXF通过激活雌性发育相关基因和抑制雄性发育相关基因的表达调控雌性个体的发育,而DSXM通过激活雄性相关基因和抑制雌性发育相关基因的表达调控雄性个体的发育[2,33]。目前为止,dsx同源基因已在不同昆虫中得到鉴定,如双翅目黑腹果蝇、家蝇、铜绿蝇Lucilia cuprina、昆士兰实蝇Bactrocera tryoni、橄榄果实蝇、地中海实蝇、橘小实蝇、西印度按实蝇Anastrepha obliqua、埃及伊蚊、冈比亚按蚊、尖眼蕈蚊Sciara coprophila[34-46];膜翅目意蜂、菜叶蜂Athalia rosae、丽蝇蛹集金小蜂、红火蚁Solenopsis invicta和灰黑心结蚁Cardiocondyla obscurior[19,47-50];鳞翅目家蚕、玉带凤蝶Papilio polytes、斜纹夜蛾Spodoptera litura[51-56];鞘翅目赤拟谷盗Tribolium castaneum、食粪金龟Onthophagus taurus、双叉犀金龟Trypoxylus dichotomus和美他力弗细身赤锹甲Cyclommatus metallifer[57-62];半翅目烟粉虱Bemisia tabaci和褐飞虱Nilaparvata lugens[63,64]。大部分昆虫dsx基因pre-mRNA上存在由13个核苷酸组成的重复元件(dsxRE),雌性个体中TRA蛋白和TRA-2蛋白组成SR剪切因子作用于dsxRE,调控dsx基因pre-mRNA雌性特异选择性剪切产生一种雌性特异DSXF蛋白。而雄性个体由于缺少功能TRA蛋白,TRA-2蛋白不能结合dsxRE,从而导致dsx基因pre-mRNA进行默认的雄性特异选择性剪切产生一种雄性特异DSXM蛋白[65]。在其他昆虫如家蝇、意蜂、家蚕、埃及伊蚊和赤拟谷盗中dsx基因mRNA前体经过雌雄特异性选择剪切产生多个DSXF蛋白或者DSXM蛋白[36,43,47,66]。另外,一些昆虫通过调控dsx基因性别特异剪切体在雌雄个体中的差异表达,参与调控雌雄性别分化。如尖眼蕈蚊dsx基因可产生四个无性别特异性的可变剪切体,但其表达水平具有性别特异性[46]。灰黑心结蚁中dsx基因产生的剪切体不仅在雌雄个体中具有性别特异表达模式,而且在不同型个体中也具有特异的表达模式[48]。烟粉虱dsx基因可产生28个可变剪切体,其中16个剪切体编码14种DSX蛋白,其表达量在雌雄个体中具有差异性[63]。
Dsx基因在不同昆虫性别决定和分化中的功能具有保守性,参与包括雌雄躯体性别分化、外生殖器的形成、求偶行为、神经系统的发育等调控[58,67-70]。利用转基因技术异源过表达dsx基因或者利用RNAi技术干扰dsx基因表达发现DSXF和DSXM蛋白不仅结构保守且功能也同样保守。如家蝇和黑腹果蝇雄虫异源表达家蝇DSXF蛋白能够激活卵黄蛋白原vitellogenin基因的表达,而黑腹果蝇雌虫异源表达家蝇DSXM蛋白导致其后背板上形成类似雄性特异的色素沉积[36]。黑腹果蝇雌虫异源表达地中海实蝇DSXM蛋白导致雌性躯体和生殖细胞系部分雄性化[40]。黑腹果蝇双性个体过表达西印度按实蝇DSXF和DSXM蛋白诱导双性个体雌性和雄性性别分化,过表达 DSXF蛋白个体中卵黄蛋白基因yolk protein表达量增加,而过表达DSXM蛋白个体中yolk protein表达量降低[71]。利用转基因技术在雄性家蚕中异源表达dsxf能够激活雌性特异基因vitellogenin和storage protein的表达[52],而在雌性家蚕中异源表达dsxm导致雌性生殖器部分雄性化[72]。Chen等[41]利用RNAi技术干扰橘小实蝇dsxf表达导致yolk protein表达量和雌虫繁殖能力受到抑制。干扰赤拟谷盗dsx基因影响卵母细胞发育,雌虫产卵量和卵孵化率下降[58]。通过siRNA介导的方法干扰埃及伊蚊dsx基因表达,导致雌成虫雌性特异形态、生理和行为等方面的特征被破坏,其卵巢变小和生殖力下降等[45]。Xu等[70]通过CRISPR/Cas9基因编辑系统敲除家蚕dsxm表达,突变雄虫外生殖器出现严重缺陷,且失去交配能力,导致雄性家蚕不育。Guo等[63]沉默烟粉虱dsx基因能够降低雌虫vitellogenin基因表达,同时导致雄虫外生殖器畸形。不同昆虫DSXF和DSXM蛋白调控靶标基因表达是相互拮抗的,如黑腹果蝇DSXF蛋白促进yolk protein和腹部性别特异色素沉积bric-a-brac基因表达,而DSXM抑制yolk protein和bric-a-brac表达[73-75]。美他力弗细身赤锹甲Cyclommatus metalliferDSXF通过降低对保幼激素的敏感性抑制下颌骨的生长,而 DSXM则是通过增强对保幼激素的敏感性促进下颌骨的生长[60]。玉带凤蝶Papilio polytes雌性个体翅和躯体中dsx亚型不同,其表达与成虫翅型高度关联,可能是上游基因调控dsx时空表达差异从而实现不同的翅拟态形式[54]。最近的研究表明dsx基因可能参与社会性昆虫品级分化,如敲除意蜂dsx基因后工蜂yolk protein表达量降低、卵巢发育减缓和信息素生育信号合成受阻,且dsx基因还参与蜂王幼虫的发育[76]。另外,在CRISPR/Cas9基因编辑技术敲除家蚕dsx基因的品系中,信息素受体OR1基因表达量显著降低,导致家蚕对信息素性诱醇的感知能力下降和雄性家蚕求偶行为受阻,这是首次在鳞翅目昆虫中发现dsx基因调控信息素受体通路[77]。
3 昆虫性别决定关键基因transformer概况
Tra基因在包括双翅目、膜翅目、鞘翅目昆虫中高度保守,在性别决定级联系统中调控底层基因dsx的可变剪切参与性别决定和分化[78,79]。tra的同源基因已在黑腹果蝇[80]、地中海实蝇[81]、橄榄果实蝇[82]、西印度按实蝇[83]、铜绿蝇[84]、家蝇[85]、加勒比按实蝇[86]、赤拟谷盗[87]、丽蝇蛹集金小蜂[88]、对旋丽蝇Cochliomyia hominivorax[88]、螺旋锥蝇Cochliomyia macellaria[88]、丝光丽蝇Lucilia sericata[88]、昆士兰实蝇[89]、扎氏果实蝇Bactrocera jarvisi[89]、橘小实蝇[90,91]、番石榴实蝇Bactrocera correcta[92]和瓜实蝇Bactrocera cucurbitae[93]中鉴定出来,其剪切方式和功能具有保守性。不同昆虫tra基因pre-mRNA都含有雄性特异外显子,其包含使转录提前停止的终止密码子。雄虫中pre-mRNA雄性特异选择性剪切产物tram翻译产生短的、无功能蛋白,在性别决定调控中并不起作用。雌虫中pre-mRNA雄性特异外显子被剪切掉,其产物traf翻译产生功能TRA蛋白。尽管昆虫中tra基因核苷酸序列和氨基酸组分差异较大,但是作为dsx基因性别特异性剪切调控因子的功能是保守的。一方面,功能TRA蛋白和TRA-2蛋白结合dsx基因pre-mRNA上TRA/TRA-2结合位点指导其雌性特异选择性剪切,翻译产生DSXF蛋白。另一方面,功能TRA蛋白和TRA-2蛋白结合tra基因pre-mRNA上TRA/TRA-2结合位点启动一个自动反馈调控回路,从而实现traf的自我调控和雌性性别发育[71,94,95]。在地中海实蝇、橄榄果实蝇、铜绿蝇、家蝇、加勒比按实蝇、赤拟谷盗、对螺丽蝇、螺旋锥蝇、丝光丽蝇、昆士兰实蝇、橘小实蝇、番石榴实蝇胚胎发育早期干扰tra基因表达导致XX雌性个体出现不同程度雄性化(XX假雄性),而雄性个体发育没有受到影响[20,81,82,84-88,90-92,96]。最近的研究表明,黑腹果蝇tra基因通过刺激脑中胰岛素生成细胞分泌胰岛素类多肽来促进脂肪体生长,调控幼虫身体大小,这表明tra基因在性别决定和胰岛素信号通路中的功能具有相关性[97]。
Tra同源基因在双翅目、膜翅目和鞘翅目昆虫中都有发现,在鳞翅目中却没有鉴定到tra同源基因。在家蚕中,不仅没有发现tra同源基因,而且dsx基因上也缺乏dsxRE结合位点[23,51,98]。膜翅目意蜂tra同源基因已被发现,命名为fem。其雌性特异剪切产物femf编码FEM蛋白与其他昆虫如黑腹果蝇、地中海实蝇和家蝇traf编码的TRA蛋白拥有相同的精氨酸/丝氨酸(Arg/Ser)和脯氨酸(Pro)区域,调控下游dsx基因性别特异选择性剪切。雄性特异剪切产物femm含有终止密码子使其编码短的、无功能蛋白[19,21]。tra序列在不同昆虫中差异较大,表明tra主要表现为功能保守而非结构保守。根据TRA蛋白序列进行的物种种系进化关系比对发现tra进化遵循种系差异,证明其功能保守而非序列保守。对昆虫TRA同源基因的比对发现脯氨酸和精氨酸/丝氨酸富集区域高度保守,反映其作为性别调控剪切因子的功能保守性[78]。不同昆虫通过多种多样的性别决定原始信号调控tra基因性别特异选择性剪切,如雄性决定因子(M-factor),其对雄性发育是必须的,且主动或被动地抑制tra基因的激活表达[14-18,99]。XY个体父本继承的M-factor抑制tra的激活,导致其被剪切成一个含有终止密码子的雄性特异转录产物tram,进而翻译成一个短的无功能蛋白。性别决定级联下游基因dsx在缺少TRA蛋白下进行雄性特异选择性剪切,实现雄性发育。而XX个体缺少M-factor,母本tra基因雌性特异剪切产生的转录产物traf,翻译产生功能TRA蛋白,进而调控dsx基因雄性特异选择性剪切,实现雄性发育。在膜翅目如丽蝇蛹集金小蜂中,受精卵中早期合子启动父本来源的wom基因转录表达,启动tra基因的自动调控回路,产生功能TRA蛋白,进而调控dsx基因雌性特异选择性剪切,实现雌性发育。未受精卵中缺少wom基因,无法启动tra自动反馈调控回路,dsx基因进行雄性特异选择性剪切,实现雄性发育。和双倍体性别决定系统相反,单倍二倍体性别决定系统中父本提供的wom基因启动二倍体雌性发育,且主动或被动地促进tra基因的激活[22,100,101]。
4 昆虫性别决定关键基因transformer-2概况
Tra-2基因是性别决定级联中的关键基因,参与tra调控dsx基因性别特异选择性剪切。tra-2同源基因已在黑腹果蝇[102]、家蝇[103]、家蚕[104]、铜绿蝇[84]、地中海实蝇[105]、西印度实蝇[106]、尖眼蕈蚊[107]、意蜂[108]、赤拟谷盗[109]、橘小实蝇[90,91]、丽蝇蛹集金小蜂[110]、斑翅果蝇[111]、南瓜实蝇Bactrocera tau[112]、白纹伊蚊Aedes albopictus[113]中鉴定出来。这些昆虫tra-2基因编码的蛋白都包含三个结构域:RNA识别结构域(RNA Recognition Motif,RRM)和两个丝氨酸/精氨酸结构域(serine/arginine,SR),其中RRM能够和Tra蛋白结合形成Tra/Tra-2复合物,参与dsx基因性别特异选择性剪切[114-116]。TRA-2蛋白氨基酸序列长度各异,但 RRM 结构域相对保守,由两个核糖核蛋白域(ribonucleoprotein domain,RNP)或 RNA结合域(RNA-binding domain,RBD)组成[117]。不同昆虫tra-2基因的可变剪切体数量不一,如黑腹果蝇tra-2基因具有四个可变剪切体,其中三个可变剪切体在雌雄个体中都有表迖,一个可变剪切体是雄性特异的[102]。家蚕和意蜂tra-2基因具有6个可变剪切体,丽蛹集金小蜂有4个可变剪切体,赤拟谷盗有3个可变剪切体,但以上昆虫tra-2可变剪切体都不是雌雄特异性表达[104,108,110,118]。在家蝇、铜绿蝇、橘小实蝇、地中海实蝇、西印度实蝇等昆虫中,tra-2基因只有一种可变剪切体[84,90,91,103,105,106]。黑腹果蝇TRA-2蛋白通过RRM和SR结构域与dsxpre-mRNA上的dsxRE位点结合,并与Tra蛋白组成Tra/Tra-2剪切调控复合物,调控dsx基因雌性特异可变剪切[67]。另外,黑腹果蝇tra-2基因作用于精子形成关键基因alternative testis transcripts和exuperantia,参与雄虫精子和生殖能力的形成[119-121]。在其他双翅目如家蝇、地中海实蝇、加勒比按实蝇等昆虫中,tra-2基因参与tra基因的自我调控和dsx基因雌性特异可变剪切。胚胎期敲除家蝇、地中海实蝇和加勒比按实蝇tra-2基因表达,产生具有生殖能力的XX基因型雄虫和具有两性特征的成虫。另外,tra-2还调控家蝇和地中海实蝇雄虫的交配行为[103,105,122,123]。膜翅目意蜂和丽蛹集金小蜂胚胎干扰tra-2基因表达导致dsx基因雄性特异可变剪切(dsxm)的出现和胚胎的大量死亡,表明膜翅目tra-2基因不仅参与调控dsx雌雄特异可变剪切,而且影响胚胎发育[108,110,124]。鳞翅目家蚕胚胎期干扰tra-2基因表达不能引起dsx雌性特异可变剪切和雌性性别的改变,而利用CRISPR/Cas9基因编辑技术敲除tra-2导致胚胎死亡。此外,tra-2基因参与雄性家蚕精巢发育[118,125]。鞘翅目赤拟谷盗tra-2基因参与tra基因自我调控和dsx基因性别特异可变剪切调控,且tra-2在赤拟谷盗胚胎和幼虫发育中起着重要作用[109]。
5 展望
近年来分子遗传学的发展使人们对于性别决定系统的进化有了初步的了解。但昆虫性别决定机制丰富多样,不仅不同昆虫通过不同的基因和调控机制决定性别分化,甚至在同种昆虫不同品系之间性别决定机制也不尽相同。通过更多昆虫性别决定机制的比较研究,可以为探索物种性别分化通路上类似基因的功能以及确定新的性别决定基因提供参考,对揭示物种的进化关系具有十分重要的意义。这些将为最终建立不依赖辐射的昆虫不育技术(sterile insect technique,SIT)提供理论和实践基础,突破传统SIT在生产实践中的限制。传统昆虫不育技术的主要策略是通过大量人工饲养靶标害虫,经过辐射处理后,连续释放不育雄性个体,与野生靶标雌性害虫个体交配,产生不育后代,将靶标害虫种群数量控制在经济阈值之下,甚至彻底根除靶标害虫。但传统的SIT由于使用辐照技术造成雄虫在野外生存能力和交配竞争力降低,而且在释放过程中缺乏有效的雌雄分离手段,因此在害虫防治中有诸多限制。而通过靶标昆虫性别决定构建转基因性别品系的SIT将极大提高害虫的防治和治理。首先,昆虫性别决定级联基因功能研究表明tra和dsx基因在调控雌雄性别决定和分化中功能保守,胚胎期干扰或敲除其表达导致后代出现雄性化。因此,可以利用性别决定级联基因构建雌虫雄性化转基因性别品系。CRISPR/Cas9技术是一种操作简单,高效精确的基因组编辑技术,通过CRISPR/Cas9技术敲除性别决定级联基因可以实现雌虫雄性化。而基于CRISPR/Cas9的基因驱动(gene drive)系统能够将特定的突变性状快速扩散到整个种群中,如利用CRISPR/Cas9系统靶标冈比亚按蚊dsx基因导致雌性纯合突变体具有双性表型且完全不育,同时不会影响雄性发育和可育性。进一步通过基因驱动系统能够逐渐减少雌蚊产卵量直至种群数量崩溃[126]。因此,利用CRISPR/Cas9技术建立昆虫雄性化的基因驱动转基因品系,靶标性别决定级联基因如tra和dsx导致后代雌虫雄性化,并通过释放竞争力更强的不育雄虫后代,能够提高昆虫不育技术对害虫的防治。其次,性别决定关键基因tra在雌雄中存在不同的剪切模式,tra经过选择性剪切产生雄性特异和雌性特异亚型,雌性特异亚型能翻译成功能TRA蛋白,而雄性特异亚型由于终止密码子的存在不能翻译成功能TRA蛋白。因此,利用tra基因的选择性剪切可以用于实现雌虫特异性致死。将含有内部终止密码子的雄性特异tra序列插入到四环素抑制系统序列中,然后将其整合到昆虫基因组中即可构建雌性特异致死转基因系统。tra雄性特异剪切产物含有终止密码子,导致四环素系统不会表达,因而雄虫不会致死;tra雌性特异剪切产物不包含终止密码子,启动四环素抑制系统的表达,导致雌性致死。雌性特异致死系统已在多种昆虫得到应用,如家蚕、棉红铃虫Pectinophora gossypiella、地中海实蝇等[127-130]。最后,昆虫雄性决定因子调控雄性化活动及发育。因此,通过测序技术对性别决定因子所在的Y染色体进行分析,将促进其特有结构和雄性性别决定因子的发现。对不同性别决定机制中Y染色体序列比较分析,可以研究不同性别决定机制在演化过程中的起源及转变。近年来相继在埃及伊蚊、冈比亚按蚊、斯氏按蚊、家蝇和地中海实蝇中鉴定出雄性性别决定基因Nix、Yob、Guy1、Mdmd和MoY,极大丰富和完善了昆虫性别决定调控分子机制[14-18]。通过调控性别决定基因的表达从而改变昆虫性别,使其性别分化向着有利于人类的方向发育,如全部产生雄性后代,使害虫种群不能繁衍,发展不依赖辐射处理的不育防治技术;或全部产生雌性后代,扩大害虫天敌的种群数量,为害虫天敌的遗传改良提供有效途径。特别是发展基于CRISPR/Cas9基因驱动系统的遗传改造性别品系,将加快害虫遗传调控和不育防治技术的发展。
