纳米载导RNAi技术在害虫防治中的研究和应用
2021-02-23王晓迪冀顺霞申晓娜刘万学万方浩张桂芬吕志创
王晓迪,冀顺霞,申晓娜,刘万学,万方浩,张桂芬,吕志创
(中国农业科学院植物保护研究所/植物病虫害生物学国家重点研究室,北京 100193)
据统计,我国常见农作物病虫害有 1700多种,且我国每年都有重大病虫害流行和暴发,其中常见农作物病害有775种、害虫739种、杂草109种、鼠害42种,其具有分布范围广、成灾频率高、突发性强等特点,随之引发农作物大面积减产,甚至绝收,同时病虫害也会导致农作物品质严重下降,尤其是外来生物入侵种更增加了对农业的危害性[1-4]。2017年 8月在我国新疆伊犁地区首次发现的番茄潜叶蛾Tuta absoluta具有非常强的快速传播和适应能力,现已在新疆、云南、贵州、四川、广西、重庆、湖南、江西等8个省/直辖市/自治区的130多个县(市、区)均有发生,发生面积逾10万亩次/年,潜在受害面积逾9700万亩,对番茄和马铃薯潜在直接经济损失逾370亿元[5,6]。2018年12月草地贪夜蛾Spodoptera frugiperda入侵我国[7],目前已扩散至我国西南、华南、江南、长江中下游、黄淮、西北、华北地区的 26 省(自治区、直辖市)的1518个县(区、市)[8],2019年草地贪夜蛾在我国的发生面积高达1500多万亩,玉米受害面积占比98%,直接经济损失约100亿元[9-11]。由此可见农业害虫的危害力之大,危害范围之广,因此对其进行有效防控十分必要。
目前的防治方法主要包括:农业防治、生物防治、物理机械防治、化学防治等[12]。农业防治技术基于合理的轮作、灌溉及科学的施肥等栽培技术和管理技术,虽可起到害虫防治的效果,但需精细化管理,费时费力;生物防治技术基于天敌昆虫和致病微生物,采用“以虫治虫”的方式虽对环境无污染,但杀虫作用缓慢,且训化、繁殖天敌较难;物理防治技术基于灯光诱杀或温度灭虫以及人工捕杀等方式,该方法操作简单、成本低,但防治效率及效果有限;化学防治技术基于一种或几种化学药剂起到防治害虫的效果,具有方便、见效快的优点,但过度依赖或滥用化学农药导致有害虫的抗药性显著增强、农药残留超标、环境污染以及危害健康等一系列问题[13-15]。因此,为对农业害虫进行有效防控,探索新的绿色、安全、高效的的害虫防治技术具有十分重要的意义。RNAi技术具有昆虫选择性和基因特异性,通过对昆虫的基因研究,筛选出控制生长发育的关键靶基因,结合RNAi技术,对相关基因进行沉默,从而达到有效防控害虫的目的。
1 RNAi在害虫防治中的潜力
RNAi(RNA interference)在2001年和2002年连续两次被《Science》评为十大科学技术之一。RNAi能够特异性地降低或关闭靶基因表达,不仅是基因功能研究的重要手段,也是至今为止最有可能应用于害虫防治的生物工程技术[16]。1998 年,Fire等[17]在对秀丽隐杆线虫Caenorhabditis elegans的研究中,发现并定义了RNA干扰。 RNAi是指由双链RNA(double-strand RNA,dsRNA)所诱发导致同源mRNA高效特异性降解的现象,是转录后水平的基因沉默机制[18]。其基本原理是:外源性的 dsRNA进入细胞后,被受体介导的内吞作用吸收后[19,20],首先由RNaseⅢ核酸酶家族的Dicer与dsRNA结合,随后dsRNA被降解成19~21 bp长度的小干扰RNA(small interfering RNA,siRNA),然后siRNA与RNA沉默复合体(RNA-induced silencing complex,RISC)结合,再解旋成单链RNA,并由该复合体主导RNAi效应。RISC被活化后,受siRNA引导,通过碱基配对特异性的结合在同源mRNA(靶标)上切断靶标mRNA,引发靶标mRNA的分解,从而产生靶标基因的表达沉默[21,22],作用过程如图1所示[23]。
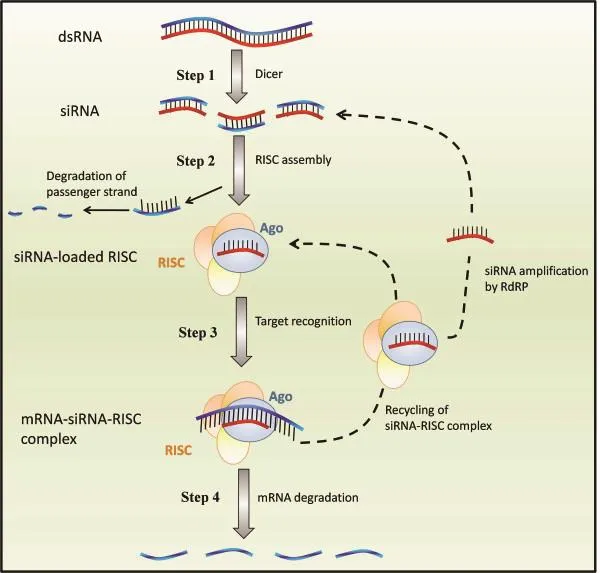
图1 dsRNA的作用机制[23]Fig. 1 Mechanism of action of dsRNA[23]
昆虫主要包括外源性siRNA、内源性siRNA和miRNA共3种RNAi途径(图2)[24]。研究表明抑制昆虫生长发育过程中重要基因的表达,可以引起昆虫生长发育障碍或者死亡,因此RNAi被认为是一种有效的防控害虫的潜在方法,从而可避免化学杀虫剂的过度使用,利于促进可持续农业的发展[25-28]。昆虫摄入dsRNA是有巨大潜力进行害虫治理的防控方法,其特点为:特异性高、抗虫精准;操作简便、周期短,极大地节省人力和时间成本;安全,对非靶标昆虫影响较小,RNA易降解,无残留,是环境友好型的试剂;实用性高,dsRNA可被制备成用于喷雾或灌溉施用的制剂,大面积的施用于田间等[29,30]。
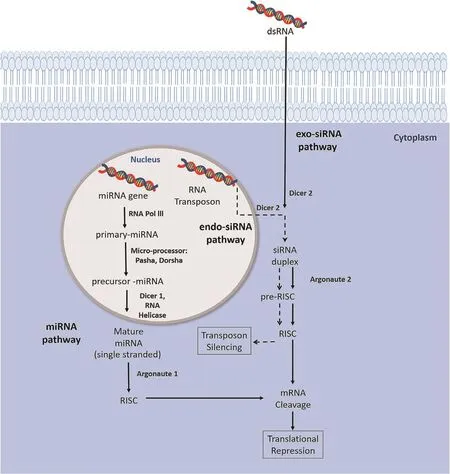
图2 昆虫3种RNAi途径示意图[24]Fig. 2 Schematic diagram of 3 RNAi pathways in insects[24]
RNAi已在多种鳞翅目昆虫中成功应用[31]。2002年首次报道了鳞翅目昆虫的RNAi方法,Bettencourt等[32]将dsRNA注入罗宾蛾Hyalophora cecropia蛹的血腔内,结果发现血红素基因沉默导致胚胎死亡,并因此证明了血红素在罗宾蛾胚胎发育过程中的重要作用。Quan等[33]将家蚕Bombyx mori白基因(white,Bmwh3)的dsRNA注入野生型家蚕的卵中,发现可导致Bmwh3位点基因沉默,并诱导出白卵和半透明肤色幼虫表型,表明Bmwh3dsRNA的作用导致了卵细胞中Bmwh3mRNA积累水平的降低,证明了注射dsRNA可用于昆虫的基因组功能分析。在斜纹夜蛾Spodoptera litura幼虫中注射氨肽酶(slapn)dsRNA,发现幼虫的apn的表达量减少,对于Cry1C毒素的敏感性相应降低。通过将同源dsRNA导入斜纹夜蛾幼虫体内,抑制了斜纹夜蛾apn的表达,证明RNAi在整个幼虫体内起作用[34]。Ellango等[35]检测了小菜蛾Plutella xylostella酪氨酸羟化酶(tyrosine hydroxylase,TH)基因作为RNAi 靶基因的潜力。他们将dsRNA涂抹到卷心菜Brassica oleracea叶片上,让小菜蛾幼虫取食,结果发现,幼虫取食dsRNA 3 d后死亡,与对照组相比死亡率显著增高,且幼虫死亡率随dsRNA浓度的增加而增加,最高可达90%。在干扰草地贪夜蛾细胞色素P450的试验中,发现饲喂dsRNA可诱导其2龄幼虫产生RNAi效应,dsRNA对靶基因的沉默率为38.9%~54.3%,与对照组相比差异显著[36]。以上研究结果表明,RNAi可成为防治不同鳞翅目害虫的潜在有力工具,在害虫管理实践中具有广阔的应用前景。2015年,Camargo等[37]对番茄潜叶蛾的研究表明其体内具有RNAi体系,且对RNAi具有较好的效应。进一步基于转录组信息筛选5个不同发育时期高表达的靶基因,体外合成dsRNA,并将番茄叶片浸泡于含有靶基因dsRNA的溶液中,然后用于饲喂1龄幼虫,检测结果表明,饲喂dsRNA后,5个靶基因均导致幼虫体质量显著下降。Camargo等[38]在2016年通过浸泡和PITGS(Plant-induced Transient Insect Gene Silencing)两种方法将dsRNA导入到番茄叶片中,让番茄潜叶蛾幼虫取食含有V-ATPase(Vacuolar ATPase-A)和AK(Arginine kinase)靶基因的dsRNA的叶片,72 h后检测转录产物积累量分别降低了35% 和40%,24 d后平均死亡率分别达到50%和43%,叶片的损伤率降低,由此可见RNAi作为一种控制番茄害虫的替代方法是可行的。2019年,Majidiani等[39]通过注射和根传递dsRNA的方法,对在番茄潜叶蛾神经系统和神经传递过程中发挥重要作用的3个基因——RyRs(ryanodine receptors)、AChE(acetylcholinesterase subunit 1)和nAChRs(nicotinic acetylcholine receptor α6)进行了RNA干扰,试验结果显示注射dsRNA能够显著降低靶基因的表达量,注射2 µg和5 µg dsRNA可使基因表达降低62.7%~75.4% ,最大死亡率为92.59%;根系吸收5 µg dsRNA后靶基因表达量降到47%~69%,其死亡率可达到67.1%~80.5%。RNAi在番茄潜叶蛾上的成功应用,为今后利用dsRNA防治该害虫提供了保障。
RNAi也被广泛的应用于其他昆虫。例如,2012年,dsRNA干扰首次在鞘翅目昆虫玉米根萤叶甲Diabrotica virgifera virgiferaLeConte中应用[40],通过饲喂DvSnf7 dsRNA,5 d后DvSnf7 蛋白水平显著降低,同时发现dsRNA效率与靶基因序列的特异性、浓度以及时间等密切相关[41]。最近的研究表明,通过RNAi 可降低与灰飞虱Laodelphax striatellus节律行为相关的tim(timeless)基因的表达,并导致灰飞虱成虫昼夜节律紊乱[42]。Santos-Ortega和Killiny[43]对柑橘木虱Diaphorinacitri蔗糖水解酶同系物基因DcSuh进行了鉴定并通过RNAi 技术对其功能进行分析。他们分别将不同剂量的DcSuh-dsRNA注射到木虱体内,结果发现100 ng 的dsRNA 就能引起木虱幼虫死亡,在dsRNA 处理后的幼虫体内检测到蔗糖水解酶活性降低,而成虫则出现了腹水症的现象。
以上研究结果均表明,抑制昆虫生长发育过程中重要基因的表达,可以引起昆虫生长发育障碍或者死亡,说明RNAi 作为新型防治技术应用于害虫防治具有巨大潜力。相较于其他昆虫,目前存在的问题是,RNAi在鳞翅目昆虫中应用效率较低,其主要原因是dsRNA被细胞吸收的效率较低[44],因为dsRNA在鳞翅目昆虫体内被降解的速率显著高于其他昆虫如鞘翅目昆虫[45]。大部分 dsRNA进入昆虫体内后会首先被血淋巴或中肠中存在的核酸酶降解,使其不能进入RNAi途径发挥沉默靶标基因的功能,因此如何解决这类核酸酶的降解作用是提高RNAi效率的关键[46-50]。
2 RNAi在昆虫中的研究状况
为达到有效利用RNAi技术防控害虫的目的,提高RNAi的效率是首要前提。首先要筛选有效的靶基因,因为不同基因的RNAi效率差别显著;同时需要提高dsRNA在昆虫体内的稳定性,从而达到沉默靶基因的效果。
2.1 昆虫关键功能基因解析
深度解析调控昆虫生长发育、繁殖和行为等方面的关键基因,充分利用害虫特有的基因和特异性基因序列,是利用RNAi 进行害虫防治策略成功的关键。昆虫关键功能基因一般分为以下几种:干扰保幼激素或蜕皮激素相关信号通路,导致幼虫不能正常发育提前进入蛹期或直接导致死亡[51,52],如干扰保幼激素受体(Met和Gce等)和转录因子基因(Kr-h1),可导致幼虫提前蛹化或直接死亡[53-58];干扰蜕皮激素相关信号通路,抑制昆虫的正常化蛹和羽化,如干扰几丁质合成,促使昆虫发育不良,不能正常蜕皮甚至死亡[59-61],干扰蜕皮激素受体基因(如EcR和USP等)和转录因子(如Br)也会导致昆虫产生蜕皮缺陷而死亡[62,63];扰乱生殖和产卵相关信号通路,实现控制害虫种群数量,如干扰羟基-3-甲基戊二酰辅酶A[64]、卵黄原蛋白受体[65]、表皮蛋白基因[66]、ATP水解酶基因[67]、亲环蛋白B基因[68];扰乱昆虫免疫和抗性机制,如对农药抗性、沉默解毒代谢和免疫相关基因等干扰,降低害虫对靶标农药的抗性,常见的基因有小G 蛋白Ras基因[69]、细胞色素 P450CYP6AE14、CYP6BG1、CYP321A8、CYP321B1和CYP6AE44基因[70-73]。
保幼激素(Juvenile hormones,JHs)是昆虫咽侧体(corpora allata,CA)合成并分泌的一种倍半萜烯类物质,在昆虫体内不仅调控幼虫生长特性、促进卵巢成熟、阻碍幼虫过早的进入下一龄期[74],而且参与昆虫体型外观、蜕皮、滞育、刺激雌性成虫体内卵黄形成等生理生化过程[75]。蜕皮激素(Ecdysone,Ecd)是由昆虫的前胸腺合成并分泌的一种类固醇激素,对调节昆虫的生长发育、代谢和生殖等具有重要作用[76-78]。保幼激素和蜕皮激素协同调控昆虫变态发育[79],幼虫期高滴度JH确保高滴度20E(20-hydroxyecdysone)只触发幼虫间的蜕皮,但是末龄幼虫,JH 滴度下降,同时,高滴度20E 触发幼虫-蛹或幼虫-成虫的变态发育[51,63,80-84]。保幼激素和蜕皮激素在昆虫生长发育过程中必不可少,因此,干扰这两类物质使其不能正常发挥作用,是利用RNA干扰防治害虫的最有效途径之一。
Methoprene是保幼激素的类似物,1986年,Wilson等[85]首次报道了Met(methoprene-tolerant)突变体果蝇对JH抗性研究,发现过量的JH处理可以诱导果蝇幼虫生成假瘤(pseudotumor),而Met突变体对这种诱导作用的耐受能力远强于正常果蝇。2013年Jindra等[82]确定了Met转录因子是JH的核内受体,提示保幼激素主要在细胞核中作用于基因的表达和功能,使得 JH的分子机制被慢慢揭开。进一步研究发现Met有一个旁系同源基因Gce(Germ cell-expressed)[86],Gce也是一种bHLH-PAS(basic helix-loop-helix Per-AhR/Arnt-Sim)蛋白,能够结合JH[87-89]。昆虫咽侧体(CA)合成并分泌JH,在血淋巴中形成JH-JHBP聚合物,随着体液循环,JH-JHBP识别结合靶细胞,之后JH脱离JHBP进入细胞质,与Met结合激活下游信号[90]。果蝇中存在Gce,当胞质内JH浓度较低时,Met聚合为同源二聚体Met-Met 或者异源二聚体Met-Gce,当胞质内JH 浓度较高时,JH与Met 结合,导致Met-Met/Met-Gce解离[88,91,92],随后Met结合SRC(steroid receptor coactivator)或FISC(βFtz-F1 interacting steroid receptor coactivator)等形成转录复合体Met/SRC或Met/FISC 结合到下游基因JH反应元件JHRR(位于Kr-h1 启动子区域,包含3个E-box-like序列)区域,调控Kr-h1(Krüppel-homolog1)的表达[84,93-95],保幼激素级联调控的模式如图 3[96]。Kr-h1作为JH 信号通路中下游关键应答基因,编码含有C2H2锌指结构的转录因子从而调控JH的合成。Kr-h1通过受体Met和Gce传递保幼激素信号,维持幼虫状态,调控幼虫的生长发育与变态,通过注射dsRNA降低梨小食心虫Grapholita molesta GmMet和GmKr-h1的表达,结果出现幼虫的存活率显著降低、蛹畸形以及存活成虫的繁殖力降低的现象[56]。GmMet和GmKr-h1的氨基酸序列与其他鳞翅目昆虫,特别是棉铃虫Helicoverpa armigeraHübner具有高度同源性,同时JH在发育、变态和繁殖中的功能在完全变态和不完全变态的昆虫中的进化中都是保守的,因此JH信号通路为害虫dsRNA防控提供了合适的靶标位点[56,82]。Tai(Taiman)也是bHLH-PAS转录因子家族中的一员,Met/Tai异源二聚体介导JH信号,触发Kr-h1,调节幼虫发育,防止早熟[97]。对德国小蠊Blattella germanica[98]和始红蝽Pyrrhocoris apterus[99]中的Tai进行RNAi,结果导致幼虫100%的死亡率。在赤拟谷盗Tribolium castaneum[100]和果蝇Drosophila melanogaster[92]的试验中也出现了类似的结果。在马铃薯甲虫Leptinotarsa decemlineata三龄幼虫体内连续注射Tai-dsRNA可导致约20%的幼虫死亡率和80%的化蛹失败率,因此Tai在JH通路中发挥重要作用,也是一个潜在的RNAi基因[101,102]。
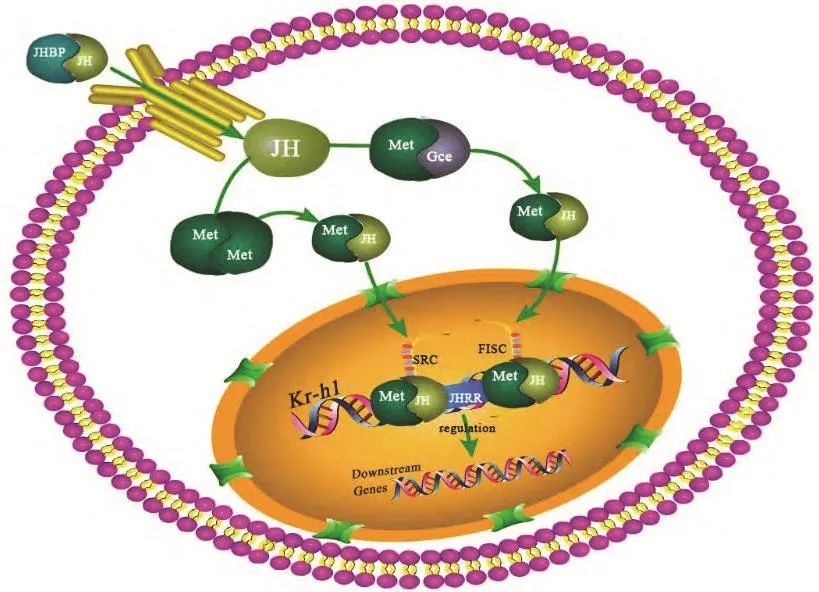
图3 保幼激素级联调控[96]Fig. 3 Juvenile hormone cascade regulation diagram[96]
2.2 基于纳米载体的RNAi应用
传统的 dsRNA递送技术包括显微注射、转基因植物、饲喂或浸泡。显微注射可以避免表皮或肠道上皮的屏障作用,将dsRNA精确地递送到靶细胞处,通过注射方法在番茄潜叶蛾中验证了潜在的RNAi的靶基因[39],但是此方法仅适用于RNAi靶基因的功能分析,却不能在田间进行推广应用。植物介导的转基因植物,如转基因玉米,在害虫防控方面取得了突破性进展,但是需要在多种谷物中开发叶绿体转化协议,扩大转基因技术的作物范围,且大多数国家仍将转基因作物视为转基因产品,由于其潜在的环境风险,需要对其进行严格的评估[28]。与植物介导的dsRNA传递相比,非转化传递策略因其时间短、开发成本低、抗性风险低、调控过程简单、对所有作物都具有可行性而受到青睐[103]。
dsRNA在体内表皮的穿透能力和稳定性有限,因此需要进一步提高其穿透效率和稳定性,进而提高对靶标的干扰效率,以满足害虫防治的实际需要。目前在提高 dsRNA稳定性方面的研究主要集中在脂质体或纳米粒子对 dsRNA进行包裹以保护其不被消化系统内的各种酶降解[28,104,105]。纳米颗粒介导的 dsRNA递送系统在提高RNAi效率方面具有突出的优势[28,106-109]。在大多数情况下,纳米颗粒的阳离子基团可通过静电相互作用与dsRNA的磷酸基团结合形成dsRNA/纳米颗粒复合物[110,111]。阳离子核壳型荧光纳米颗粒(cationic core-shell fluorescent nanoparticles,FNP)、支化两亲肽胶囊——BAPCs(Branched Amphiphilic Peptide Capsules)和壳聚糖(chitosan,CS)等已成功应用于生物工程dsRNA研究领域[28]。其中壳聚糖是一种天然的高分子材料,来源于海洋生物[112],具有良好的安全性、生物相容性和生物可降解性等特点,CS 分子中带正电荷的葡糖胺基可与带负电荷的DNA、dsRNA等产生静电作用,形成较为稳定的多聚复合物,它作为一种极有前途的 dsRNA、siRNA、质粒 DNA、寡核苷酸、多肽甚至蛋白质的递送系统而受到人们的关注[113-118]。
近十几年来,纳米技术迅速发展,并且广泛渗透于各个学科领域,形成了一系列既相对独立又互相联系的分支学科。纳米材料是指在三维空间中,至少有一维处于纳米尺度范围(1~100 nm)或者由它们作为基本单元所构成的材料,尺度大概相当于 10~100个原子紧密地排列在一起[119]。纳米材料由于较小的尺寸,较大的比表面积,优异的光学、力学、电学、磁学及化学反应性能,使其应用研究正在半导体芯片、癌症诊断、光学新材料和生物分子追踪等领域高速发展[120,121],被誉为21世纪最有前途的材料,并在生物学和医学领域得到了广泛应用[122]。纳米颗粒载导的dsRNA/siRNA的传递过程主要包括纳米颗粒与核酸的结合或纳米颗粒将核酸包裹、细胞的摄取、内涵体逃逸、以及核酸释放或纳米复合物的降解四个步骤。其具体过程为纳米颗粒的阳离子基团可以通过静电相互作用与dsRNA的磷酸基团结合形成dsRNA/纳米颗粒复合物,当昆虫摄入后,dsRNA/纳米颗粒复合物先与细胞膜结合,然后通过内吞作用进入细胞。在细胞摄取复合物后,会形成一个包含复合物的小泡,该小泡沿着微管移动到达内涵体,阳离子聚合物能够保护dsRNA/siRNA,避免其被核酸酶降解,最终dsRNA/siRNA从内涵体中释放出来并在细胞质中发挥作用,如图3所示[28]。
纳米颗粒介导的RNAi在许多昆虫中得到了成功应用[28]。2013年,He等[107]报道了一种阳离子核壳型荧光纳米颗粒(cationic core-shell fluorescent nanoparticle (FNP)),他们以亚洲玉米螟Ostrinia furnacalis为研究对象,让幼虫取食含有FNP/CHT10-dsRNA混合物的饲料,进而成功抑制几丁质酶基因CHT10的表达,该结果表明FNP可作为一种高效的基因载体,能成功载导dsRNA抑制关键靶基因的表达,阻碍幼虫的生长发育,进而起到防控害虫的效果。这是首例通过纳米荧光颗粒载导dsRNA应用于害虫的研究。自此后,纳米载体载导 dsRNA在不同的害虫中均有成功应用的报道。Zhang等[115]的研究表明,幼虫摄取了chitosan/interfering RNA纳米颗粒与食物结合的混合物后,成功地抑制冈比亚按蚊Anopheles gambiae和埃及伊蚊Aedes aegypti幼虫的多个基因表达,进一步qRT-PCR或原位杂交证明,喂养幼虫后,对相关基因的抑制至少可以持续到蛹晚期。此试验验证了壳聚糖纳米颗粒可用于dsRNA及siRNA的递送的有效性,壳聚糖因其成本低、无毒、可生物降解等优势,可以作为害虫防治的优质材料,拥有广阔的应用前景。德国小蠊对dsRNA的注射高度敏感,通过RNAi可有效抑制相关基因的表达,因此充分利用这一特征可对其进行有效防控,通过脂质体包裹dsRNA以延缓其在中肠内的降解,试验结果显示饲喂脂质体包裹的dsRNA后,德国小蠊α-tubulin基因的表达被抑制,导致死亡[123,124]。Avila等[125]运用一种全肽纳米材料——BAPCs(Branched Amphiphilic Peptide Capsules)结合dsRNA饲喂豌豆蚜Acyrthosiphon pisum和赤拟谷盗Tribolium castaneum,与摄入相同量的BiP-dsRNA相比,食用BiP-dsRNA与BAPCs复合物可导致豌豆蚜幼虫过早的死亡;采用BiP-dsRNA和Armet-dsRNA与BAPCs复合物可有效杀死赤拟谷盗,大多数(约75%)在幼虫期或羽化期死亡,单独喂养dsRNA死亡率较低(约30%)。此结果显示通过与纳米材料的有效结合,可以提高dsRNA的干扰效率。Parsons等[108]在草地贪夜蛾中测试了一种合成的鸟苷酸聚合物(poly-[N-(3-guanidinopropyl) methacrylamide],(pGPMA)),发现 Polymer-dsRNA interpolyelectrolyte complexes(IPECs)能够有效地被细胞吸收,触发RNAi,并驱动高效的基因抑制,抑制效率可达80%,进而致使昆虫的死亡率达35%。Christiaens等[126]使用鸟苷酸聚合物作为载体可防止dsRNA被鳞翅目昆虫碱性肠溶液降解,饲喂甜菜夜蛾Spodoptera exigua纳米颗粒dsRNA复合物后,可有效干扰几丁质合成酶B(chitin synthase B,ChSB)基因,使得该害虫的死亡率从16%提升到了53% 。Zheng等[127]在大豆蚜Aphis glycines上建立了一种纳米材料介导的dsRNA体壁渗透系统,在大豆蚜体壁上喷洒该复合物获得了95.4%的RNAi效率和80.5%的种群抑制效应。Yan等[128]在前期研究的基础上以星形阳离子聚合物为载体,通过局部施用和喷洒的方式使得dsRNA有效穿过大豆蚜Aphis glycines的体壁,其死亡率分别达到了81.67%和78.5%。以上成功的试验案例可以看出RNAi作为重要的研究工具通过与纳米载体结合为害虫防治提供了新的前景,尤其在鳞翅目昆虫中可通过纳米载体提高干扰效率。基于Yan等[28]的综述,对近几年来纳米粒子介导的RNAi技术在重要害虫中的研究及应用进行了补充和总结,详见表1。

表1 纳米粒子介导的 RNA干扰(RNAi)在昆虫中的成功应用Table 1 Successful applications of nanoparticle-mediated RNA interference (RNAi) in insects
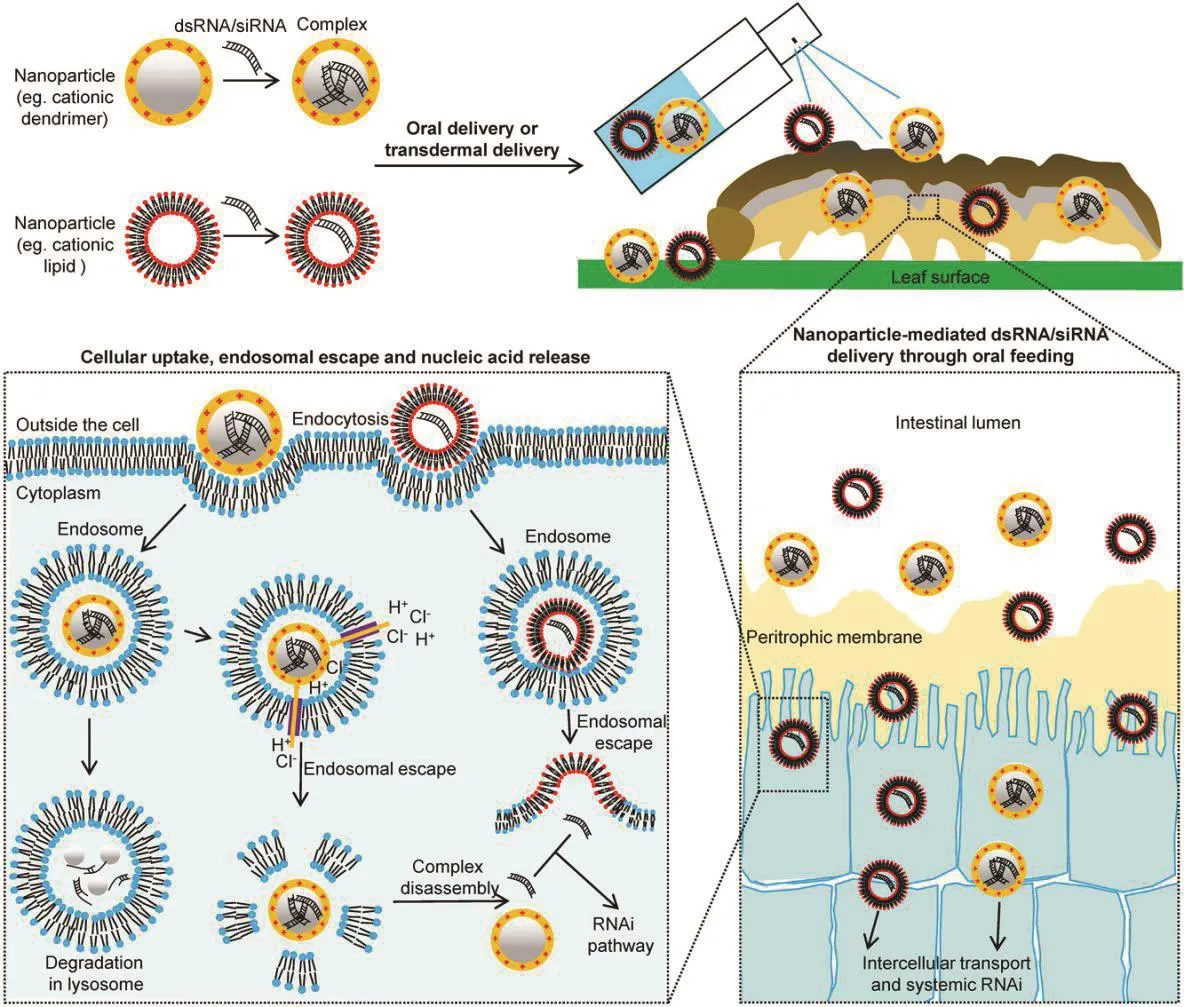
图4 纳米颗粒介导的双链RNA/小分子RNA(dsRNA/siRNA)传递系统示意图[28]Fig. 4 Schematic representation of nanoparticle-mediated double-stranded RNA/small interfering RNA (dsRNA/siRNA) delivery system[28]
3 基于工程菌高效合成靶向昆虫的dsRNA
利用RNAi技术在农业害虫防控方面研究已经取得了一定进展,但目前RNAi技术在田间应用的主要限制因素是 dsRNA的合成成本过高,因此不利于产品的推广。中国农业大学沈杰教授的研究团队利用L4440 质粒和大肠杆菌HT115(DE3)菌株,建立了一种经济、高效的昆虫靶标基因dsRNA合成方法。该团队以异色瓢虫Harmonia axyridis(Pallas)vestigial为试验对象通过构建有目的基因片段的RNAi载体,利用IPTG诱导大肠杆菌HT115(DE3)表达合成vg-dsRNA,vg-L4440 重组表达载体的构建以及vg-dsRNA诱导过程如图5所示,与商业化的dsRNA合成试剂盒相比,工程菌合成dsRNA的方法大幅降低了dsRNA 的合成成本[145]。通过将dsRNA与纳米载体结合,保护其进入昆虫体内不被核酸酶降解,从而产生RNAi,以达到绿色、安全、高效的害虫防控目标。最近该团队通过去除大肠杆菌BL21(DE3)中的编码核糖核酸内切酶RNase III的rnc基因,并与含有单一T7启动子的RNAi表达载体进行连接,构建了一种新型的pET28-BL2(DE3)RNase III系统,其表达效率是L4440-HT115(DE3)的3倍,该系统为大规模生产dsRNA提供了一种低成本、高效率的新方法,将会更好地促进基因功能分析以及基于RNAi害虫防治的发展[146]。
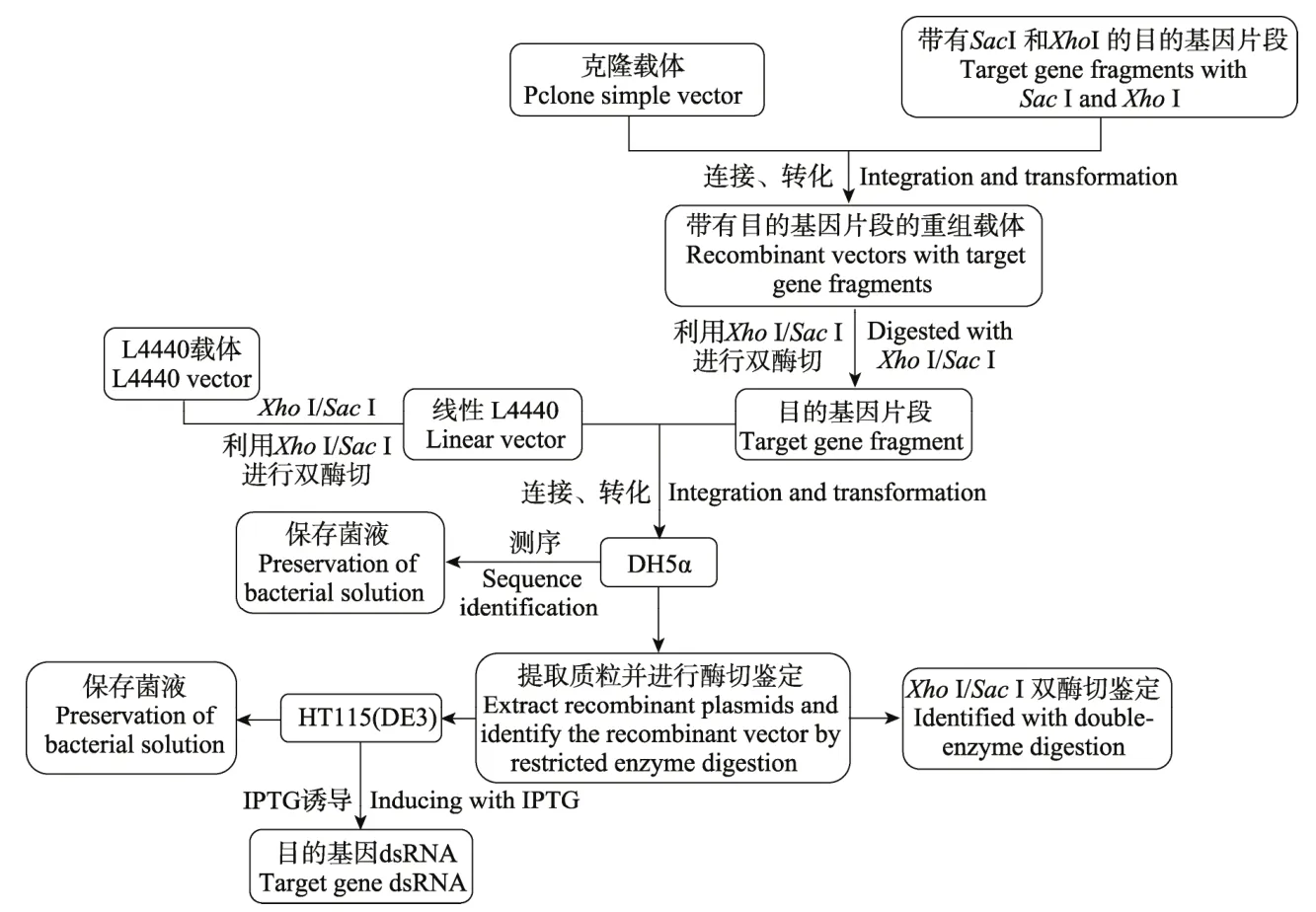
图5 Vg-L4440 重组表达载体的构建以及vg-dsRNA 诱导过程[145]Fig. 5 Construction of Vg-L4440 recombinant expression vector and vg-dsRNA induction process
4 展望
每年害虫扩散和暴发引起的农作物产量降低、品质下降而导致的经济损失巨大,因此对农业害虫的防控不容忽视,同时,抗药性、残留、污染等问题备受关注,因此需选择绿色、安全、高效的防控措施进行防控。RNAi是近几年来迅速发展的一项抑制基因表达的技术,在基因治疗和害虫的遗传学控制方面表现出了很好的应用潜能,同时也是一种潜在的防治害虫的工具,而利用RNAi进行有效的害虫防治的最大挑战是开发高效可靠的dsRNA生产和递送技术。以纳米粒子为载体,可有效防止dsRNA在昆虫体内被核酸酶降解,保护 dsRNA安全到达靶标位点后有效释放并发挥 RNAi作用,同时工程菌高效合成靶向昆虫dsRNA的方法,降低了dsRNA的合成成本,为dsRNA的大量合成提供了技术支撑,推动了RNAi核心技术在害虫防治方面的新发展,最终可通过叶面喷洒、根灌、树干注射等[147]多种方式进行推广应用,充分发挥RNA干扰的效应。本文对采用纳米载导dsRNA技术进行害虫防控的相关研究及应用进行了综述,以期为害虫防控提供新的思路,达到有效的防控效果,减少害虫暴发造成的农业经济损失,保证农作物的安全生产。
