木薯中lncRNA-CRR5在低温胁迫下的功能分析
2021-02-22沈婕董世满李淑霞彭明
沈婕 董世满 李淑霞 彭明

摘 要:低温胁迫严重影响木薯的生长、产量以及块根品质。长链非编码RNAs((lncRNAs)lncRNAs) 作为关键的调节因子,在植物响应非生物胁迫过程中发挥重要的功能。然而,lncRNAs在木薯中的功能和调控机制尚无报道。因此,为了研究木薯lncRNAs在低温胁迫应答中的功能,本研究以木薯主栽品种‘60444为材料,利用低温处理前后的叶片转录组数据,鉴定到一个受低温胁迫调控的lncRNA(cold-responsive lncRNA5,CRR5)。通过对其序列比对进行同源性分析, RNA二级结构预测和共表达分析鉴定来分析lncRNA-CRR5响应低温胁迫的分子功能。并根据基因的共表达分析推测CRR5的顺式作用和反式作用靶基因。这些结果为更进一步研究CRR5的功能提供了理论依据。
关键词:木薯;低温胁迫;lncRNA;功能分析;同源性分析;RNA二级结构预测;共表达基因分析;靶基因
中图分类号:S533 文献标识码:A
Abstract: Low temperature stress seriously affects the growth and yield of cassava and the quality of roots. Long non-coding RNAs (lncRNAs) function as major regulators, have been shown to play essential roles in plants in response to abiotic stresses. However, the function and regulation mechanism in cassava has not been reported yet. Therefore, in order to investigate the function of lncRNAs in low-temperature response, we identified a cold-responsive lncRNA 5 (CRR5) from the transcriptome data using cassava cultivars ‘60444as the material. We analyzed the molecular function of lncRNA-CRR5 in response to low temperature stress by homology analysis, RNA secondary structure prediction and co-expression analysis. The cis-acting target gene and trans-acting target gene of CRR5 were predicted based on the analysis of gene co-expression. The results would provide a new perspective theoretical basis for further exploring the response of CRR5 to low temperature.
Keywords: cassava; cold stress; lncRNA; functional analysis; homology analysis; RNA secondary structure; co-expression gene analysis; target genes
DOI: 10.3969/j.issn.1000-2561.2021.01.006
木薯(Manihot esculenta Crantz)是热带、亚热带地区重要的经济作物,在中国广东、广西、海南等省份被广泛种植。木薯块根用途广泛,可食用、饲用及作为工业原料生产乙醇和制取淀粉,即便是生产后的木薯渣残,亦可用作饲料、肥料被开发与利用。然而,中国热带地区地处热带北缘,经常遭受寒流侵袭。低温是一种常见的影响植物地理分布、生长发育和品质产量的非生物胁迫因素,严重时会导致植物死亡[1-2]。木薯对低温非常敏感,在受到低温胁迫时,顶端生长受抑制、植株萎蔫、茎杆坏死,在薯块形成后受低温胁迫则导致块根膨大和淀粉累积受限、产量下降[3-4]。近年来,木薯虽为中国热区种植面积最大的薯类作物,但受寒流侵襲和区域性气候的限制,中国热区生产的木薯自给严重不足,远远无法满足国内的产业发展需要,需大量从国外进口。因此,开展耐低温育种基础性研究,培育耐低温、抗旱木薯品种,使木薯种植北移,满足我国和世界能源工业对木薯原材料的需求,是我国木薯产业发展的迫切需求。
长链非编码RNA(long non-coding RNA,lncRNA)是一类长度在200 nt以上的非编码RNA。根据其在基因组上的位置可将其分为三3种类型:基因间长链非编码RNA(long intergenetic noncoding RNA,linc RNA)、天然反向转录本(natural antisense transcript,NAT)以及内含子长链非编码 RNA(intronic long noncoding RNA)[5-6]。由于lncRNA不具备蛋白质编码功能,因此,很长一段时间,人们认为它是转录过程中的“噪音”。然而,越来越多的研究结果表明,lncRNAs作为功能调控元件在真核生物的基因表达调控中起着非常重要的作用[6]。目前关于长链非编码RNA的工作主要集中在动物中,哺乳动物lncRNAs参与调控多种生物学过程,包括X染色体沉默、基因组印迹、染色体修饰、转录激活、转录干扰、核内运输等[7-8]。在植物长链非编码RNA的生物学功能和作用机制的研究主要集中在模式作物,如拟南芥、水稻等。相对于研究较多的非编码小RNA,目前大部分lncRNAs的功能尚不清楚。近年来,有研究发现植物lncRNA参与了春化作用、根瘤形成、光形态建成及逆境响应等生物学过程[9-12]。例如:植物春化开花途径中的关键调控基因FLC(Flowering locus C),其mRNA的转录受到两个lncRNA(COOLAIR和COLDAIR)的调控[13-14]。在豆科植物中,人们鉴定到一个非常保守的lncRNA,命名为ENOD40(EARLY NODULIN 40)。研究发现ENOD40参与到共生根瘤的形成过程,在结瘤过程中,ENOD40作为RNA分子可以影响Mt RBP1(RNA binding protein 1)蛋白的核质转运[15]。
得益于高通量测序技术的发展,使大量植物基因组信息的解读成为可能,同时通过多组学数据的整合,研究者可以清晰地认识基因的功能,研究基因的转录和调控机制。目前,利用组学数据,人们在众多植物物种中鉴定到大量的lncRNA,这些lncRNA或参与了植物的发育调控、或介导了逆境胁迫响应过程[16-18]。例如:拟南芥中已经发现1832个lncRNAs在干旱、低温、高盐或脱落酸处理后表达量发生显著改变[19-20]。小麦中鉴定到125个胁迫(白粉菌感染和热胁迫)响应的lncRNAs[21]。Lv等[22]在玉米中鉴定到7245个lncRNA,其中637个与氮营养胁迫相关。本研究中,前期利用组学数据筛选到一个低温响应的lncRNA,命名为CRR5(Cold-responsive lncRNA 5)。运用序列比对进行同源性分析以及RNA二级结构预测,对CRR5的潜在功能和靶基因进行了预测和分析。结果表明,木薯中CRR5对低温胁迫作出了应答,通过对lncRNAs作用机制的研究,从而筛选特异的功能基因,将为木薯的转基因遗传育种提供新的思路。
虽然木薯在块根作物中研究基础较好,但仍远远落后于水稻等粮食作物,挖掘木薯特异功能基因,进行转基因木薯品质改良,是木薯品种改良的有效方法之一。
1 材料与方法
1.1 材料
实验材料为木薯主栽品种,来自中国热带农业科学院热带生物技术研究所研究基地提供。
将组培瓶中的木薯茎去叶片留腋芽和顶芽切成1 cm左右,插入MS培养基中,置于温室培养,培养温度为((26±2)26±2)℃,光照16 h和黑暗8 h。培养1个月后,分别收集叶片、茎尖、茎段和根等组织部位用于RNA抽提。对于低温处理组,把木薯组培苗放于4 ℃分别处理1、3、6、12、24、48、72 h,并且和不做低温处理的MS固体培养为空白对照,3次重复,分别取处理组和对照组的叶片,液氮速冻后储存在?80 ℃冰箱用于提取组织总RNA。
1.2 方法
1.2.1 叶片总RNA的提取 取木薯叶片,加入液氮后,迅速充分的地将叶片研磨成粉末状,再将磨完后的粉末装入2 mL离心管中,加入500 μL裂解液SL,立即涡旋剧烈震荡混匀。12000 r/min离心2 min。将上清液转移至过滤柱CS上,12000 r/min离心2 min,小心吸取收集管中的上清液至新的RNase-Free的离心管中,吸头尽量避免接触收集管中的细胞碎片沉淀。缓慢加入0.4倍上清液体积的无水乙醇,混匀,将得到的溶液和沉淀一起转入CR3中,12000 r/min离心15 s,倒掉收集管中的废液,将吸附柱CR3放回收集管中。向吸附柱CR3中加入350 μL去蛋白液RW1,12000 r/min离心15 s,倒掉收集管中的废液,将吸附柱CR3放回收集管中。向吸附柱CR3中央加入80 μL的DNase 1工作液,室温放置15 min(DNase 1工作液的配置:取10 μL DNase 1储存液放入新的RNA-Free离心管中,加入70 μL RDD缓冲液,轻柔混匀)。向吸附柱CR3中加入350 μL去蛋白液RW1,12000 r/min离心15 s,倒掉收集管中的废液,将吸附柱CR3放回收集管中。向吸附柱CR3中加入500 μL漂洗液RW,12000 r/min离心15 s,倒掉收集管中的廢液,将吸附柱CR3放回收集管中,并重复1次。12000 r/min离心2 min,将吸附柱CR3放入一个新的RNase-Free的离心管中,向吸附柱中央部位悬空滴加50 μL RNase-Free ddH2O,室温放置2 min,12000 r/min离心1 min,得到RNA溶液。
1.4 1. 2.2 RNA反转录成cDNA
cDNA反转录体系(50 ng~-2 μg)总RNA可建立20 μL体系。先进行基因组DNA去除体系配制混合液,彻底混匀简短离心,并置于42 ℃孵育3 min,然后放到冰上。(1)gDNA去除反应体系:每个样品使用5 gDNA Buffer 2 μL,将Total RNA补足50 ng,随后使用RNase-Free ddH2O补足到10 μL。(2)反转录反应体系:
每个样品使用10 Fast RT Buffer 2 μL,RT Enzyme Mix 1 μL,RNase-Free ddH2O 7 μL。
将反转录反应中的Mix加到gDNA去除步骤的反应液中,充分混匀,42 ℃孵育15 min,95 ℃孵育3 min之后放于冰上,得到的cDNA可用于后续的实验。
1.51.2.3 实时荧光定量PCR的检测
(1)20 μL反应体系:
2 SYBRⅡ 10 μL,Primer(正反向) 1.6 μL,ddH2O 7 μL,cDNA 1 μL,SYBR ROX DYe 50 0.4 μL。
(2)反应步骤:第一步,95 ℃预变性30 s,第二步(45个循环),95 ℃:5 s,60 ℃:30 s,第三步,95 ℃:15 s,60 ℃:1 min,95 ℃:15 s。
1.61.2.4 CRR5二级结构预测
目前有多种算法可以用来预测RNA的二级结构,其中最小自由能算法(Minimum Free Energy,MFE)作为典型代表使用最为广泛。本文利用RNA fold软件,利用最小自由能算法对CRR5进行二级结构特征进行分析。
2 结果与分析
2.1 CRR5的筛选与分析
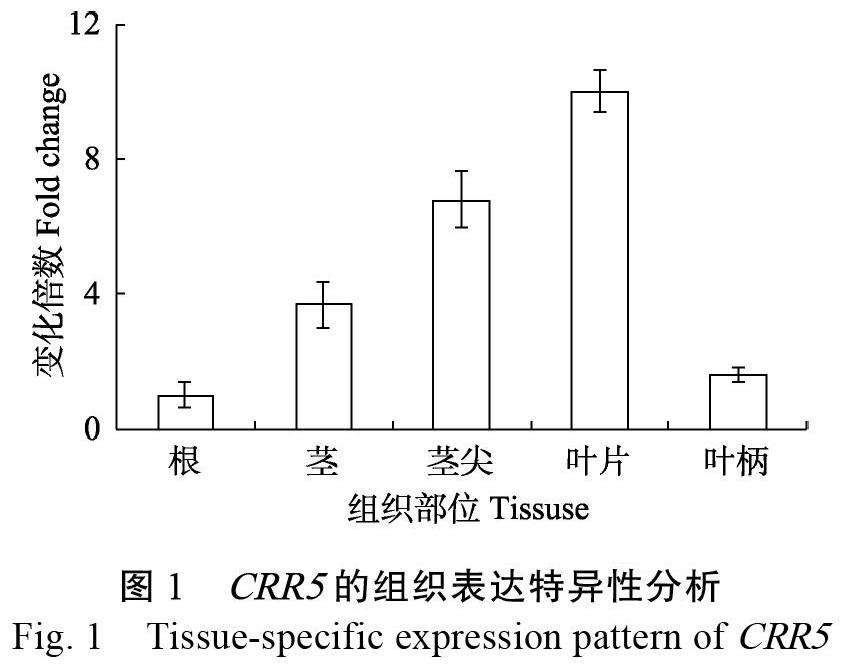
利用木薯茎尖及幼嫩叶片的转录组数据,鉴定到682个lncRNA,其中318个受低温调控表达[23],并重点筛选出lncRNA-CRR5展开后续功能研究。CRR5全长976 bp,含有3个外显子,位一号染色负链表达,上下游邻近蛋白质编码基因分别是Manes.01G155600和Manes.01G155500。通过设计特异性PCR引物,以木薯cDNA为模板,经过特异性的PCR扩增,最终克隆到CRR5全长序列。为了验证CRR5的组织表达特征,分别采集了在温室培养30 d,温室温度为(26±2)℃,光照16 h和黑暗8 h的木薯叶、茎段、根等不同的组织部位,抽提RNA后检测CRR5的表达水平。结果发现CRR5基因具有较为明显的组织表达特异性,在根中表达最低、茎次之、茎尖和叶片中最高,叶柄这种表达量与根中接近(图1)。
2.2 CRR5同源序列比对以及系统进化树的构建
为研究木薯CRR5的序列保守程度,从而在进化层面上对其进行功能注释。以CRR5的全长序列为检索对象搜索NCBI数据库,选取了12个与CRR5同源性较高的木薯及其他植物的序列,用MEGA6通过Neighbor joining(NJ)法构建了系统发育树(图2)。结果显示,CRR5与木薯中的组氨酸酰化转移酶的同源程度较高,且已有研究结果表明,组蛋白乙酰化修饰在参与并调控植物的生长发育过程中起着重要的调控作用。此外, CRR5和木薯中一个功能位置的蛋白质编码基因(Manes.01G194100)同源性最为接近。与此同时,其在橡胶树、赤豆中也存在同源基因。
2.3 CRR5二级结构预测
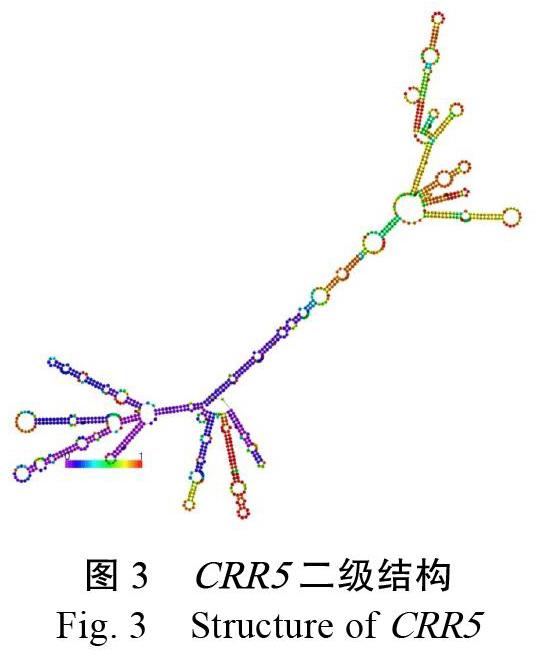
对CRR5的一级序列的分析,促使我们获得其部分信息,而对二级结构的研究可以进一步探索其具有的生物学功能。研究表明,单链的RNA自身折叠配对形成螺旋区和环,对RNA二级结构的预测是生物信息学领域的研究焦点问题。CRR5的二级结构预测结果如下图3所示,从图中可以看出,CRR5二级结构是多茎环发夹结构,其中,3个主要的分支环包含12个茎环、2个凸环结构。蓝色区域是5端,红色的则是3端。蓝色区域表示碱基对的匹配程度较高,自由能值低,稳定性好(图3)。以往研究表明,RNA的茎环结构在与RNA结合蛋白相互作用过程中至关重要[5]。因此,对CRR5二级结构的预测,可以为研究其功能和作用机制等提供重要数据。
2.4 对不同低温时间处理下木薯CRR5表达的实时荧光定量分析
为了研究CRR5响应低温胁迫的动态表达情况,本实验用荧光定量PCR的方法对CRR5进行验证。结果发现,低温处理后CRR5的表达量呈现出整体的上升趋势。在低温胁迫1 h后,处理组中CRR5的相对表达量约为对照组的7倍;3、6、12 h处理后的相对表达量约为对照组的10倍;在低温处理24 h后,差异表达最显著,相对表达量约为处理前的20倍。处理48 h和72 h后CRR5的相对表达量略有下降(图4)。
2.5 CRR5共表达基因鉴定
基于lncRNA与邻近基因可能存在协同表达或调控关系,因此,着重分析了CRR5上下游邻近蛋白质编码基因Manes.01G155600、Manes. 01G155500的表达。结果表明,二者在低温条件下表达变化不显著,因此推测CRR5和临近的上下游基因不存在共表达或调控关系。而基于基因共表达的方法,通过分析转录组中与CRR5的表达关联系数大于0.9的蛋白编码基因的功能。可以对CRR5进行功能注释。利用该方法,在木薯基因组中鉴定了29个蛋白质编码基因,它们的表达量与CRR5高度相关,将这些编码基因进行功能注释。其中29个基因参与代谢过程。6个基因与分子运输相关,15个基因参与转录调节。8个基因参与激素应答与信号转导((表1)表1)。从而推测位于编码基因上下游的这些lncRNA可能参与转录调节、代谢、激素应答和信号转导等生物过程来响应低温胁迫。
在低温胁迫下,植物细胞至少有3种温度感受及信號传导途径:膜流动性的改变,叶绿体能量转换失衡和蛋白磷酸化的植物冷响应[1, , 24]。钙离子作为细胞内的第二信使会引起一系列代谢及基因表达的变化,激活相应的转录因子,如MYB、WRKY等来诱导基因的表达[25-26]。此外,蛋白磷酸化酶和蛋白激酶等也是信号传导分子。在转录水平上的调控途径,阐述最清楚的是CBF基因家族的调控,经过转录组分析,ICE1可结合在CBF3的启动子MYC元件区域激活基因转录,转录的产物再结合在COR基因的启动子元件上,激活了冷响应有关基因的转录从而增强植物的耐寒性[27]。在低温胁迫下,木薯内CRR5与一些重要的蛋白激酶基因存在协同表达,比如谷胱甘肽S-转移酶,AUX/IAA蛋白等,还有与RNA转录相关的蛋白((表1)表1)。
3 讨论
低温和寒害对热带作物木薯的影响巨大。因此,解析低温响应关键基因的功能和作用机理,将会为木薯抗逆性研究提供分子基础,有助于木薯更好地适应寒冷环境。在过去的10年里,诸多证据表明,lncRNA在植物开花调控、根瘤形成、逆境胁迫响应等方面发挥重要功能[5]。近年来,随着新一代测序技术的进步,许多新的非编码RNA在不同的植物物种中被发现,如水稻、玉米等[18, 22, 28]。然而,由于植物对低温胁迫表现出复杂的生理、生化和分子反应,以及实验技术的局限性,其功能研究一直未得到深入验证,尤其是在木薯中。近年来,科研人员对lncRNA的研究的大部分还停留在对不同植物的识别或调控现象等方面。根据lncRNA的一级结构推测其二级结构,是功能蛋白质与RNA互作的重要依据,或成为lncRNA的功能研究的途径之一。
采用链特异性RNA-seq的方法,寻找在低温胁迫下表达显著变化的lncRNA,根据严格的筛选标准,筛选到了候选lncRNA-CRR5。本研究从木薯叶片中克隆得到CRR5的cDNA全长,基于CRR5的一级序列,发现其在植物物种间同源性较低,但系统发育树结果显示,在木薯中存在12个与之同源性较高的蛋白质编码基因,这一结果暗示CRR5可能与这些基因的功能高度相关。另外CRR5的二级结构预测其存在12个稳定的茎环结构,通过对CRR5二级结构的预测,将为寻找与其存在相互作用的蛋白、蛋白质复合体提供参考和理论依据。
研究表明,lncRNA的表达具有组织特异性,本研究发现,CRR5在茎尖、叶片中表达丰度相对较高,表明其在茎尖分生组织的维持、叶片分化及形态建成过程中可能发挥功能。木薯的茎顶端和叶片是感受温度变化的重要部位,对低温最为敏感。低温处理后,茎顶端和叶片分别呈现出坏死和萎蔫的症状。CRR5在这两2个部位的高表达,表明其在低温胁迫响应中担任重要角色。利用基因组共表达方法,注释了29个与CRR5共表达的蛋白质编码基因,并根据这些基因的功能,推测CRR5主要参与了转录调节、代谢、激素应答和信号转导等生物过程。本研究中的发现为未来开展CRR5的功能与分子机制的研究及提高木薯抗逆性奠定基础。
CRR5與邻近蛋白质编码基因的表达并不存在协同或相关性,表明其并不通过顺式作用方式调控靶基因。而共表达基因网络分析显示CRR5与真菌素金属肽酶(M36),Di-葡萄糖结合内质网,不分生顶端蛋白,短链脱氢酶,木瓜蛋白酶家族半胱氨酸蛋白酶,WRKY转录因子的共表达系数较高,我们推测CRR5与这些基因的表达有关。这些功能基因与激素的调节,蛋白质的转运等功能息息相关。研究这些基因一方面可以了解低温胁迫下CRR5如何发挥功能,也可以通过验证这些功能基因的功能推测木薯抵御低温胁迫的分子遗传通路,为揭示植物响应低温胁迫提供新思路。目前CRR5介导木薯抗低温的分子机制尚不清楚,随后我们还将遗传转化技术,构建CRR5高/低表达转基因植株,并通过分析转基因株系在低温胁迫下的抗寒表型检验,以及低温胁迫前后各项生理指标的变化确定CRR5的生物学功能。并通过RNA荧光原位杂交技术确定其行使功能的具体部位、结合转录组学分析该lncRNA的分子机制。
参考文献
Xiong L, Schumaker K S, Zhu J K. Cell signaling during cold, drought, and salt stress[J]. Plant Cell, 2002, 14(Suppl): S165-183.
Mahajan S, Tuteja N. Cold, salinity and drought stresses: An overview[J]. Archives of Biochemistry & Biophysics, 2005, 444(2): 139-158.
El-Sharkawy M A. Cassava biology and physiology[J]. Plant Molecular Biology, 2004, 56(4): 481-501.
An D, Yang J, Zhang P. Transcriptome profiling of low temperature-treated cassava apical shoots showed dynamic responses of tropical plant to cold stress[J]. BMC Genomics, 2012, 13(1): 1-25.
Zhang Y C, Chen Y Q. Long noncoding RNAs: New regulators in plant development[J]. Biochemical and Biophysical Research Communications, 2013, 436(2): 111-114.
Chekanova J A. Long non-coding RNAs and their functions in plants[J]. Current Opinion in Plant Biology, 2015(27): 207-216.
Loda A, Heard E. Xist RNA in action: Past, present, and future[J]. PLoS Genetics, 2019, 15(9): e1008333.
Zhang X, Hong R, Chen W, et al. The role of long noncoding RNA in major human disease[J]. Bioorganic Chemistry, 2019, 92: 103214.
Heo J B, Sung S. Vernalization-mediated epigenetic silencing by a long intronic noncoding RNA[J]. Science, 2011. 331(6013): 76-79.
Ding J, Lu Q, Ouyang Y, et al. A long noncoding RNA regulates photoperiod-sensitive male sterility, an essential component of hybrid rice[J]. Proceedings of the National Academy of Sciences, 2012, 109(7): 2654-2659.
Flynn R A, Chang H Y. Long noncoding RNAs in cell-fate programming and reprogramming[J]. Cell Stem Cell, 2014, 14(6): 752-761.
Wang Y, Fan X, Lin F, et al. Arabidopsis noncoding RNA mediates control of photomorphogenesis by red light[J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(28): 10359-10364.
Csorba T, Questa J I, Sun Q W, et al. Antisense COOLAIR mediates the coordinated switching of chromatin states at FLC during vernalization[J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(45): 16160-16165.
Marquardt S, Raitskin O, Wu Z, et al. Functional consequences of splicing of the antisense transcript COOLAIR on FLC transcription[J]. Molecular Cell, 2014, 54(1): 156-165.
Campalans A, Kondorosi A, Crespi1 M. Enod40, a short open reading frame–containing mRNA, induces cytoplasmic localization of a nuclear RNA binding protein in Medicago truncatula[J]. Plant Cell, 2017, 29(4): 1047-1059.
Li L, Eichten S R, Shimizu R, et al. Genome-wide discovery and characterization of maize long non-coding RNAs[J]. Gary Journal Muehlbauer, 2014, 15(2): R40.
Shuai P, Liang D, Tang S, et al. Genome-wide identification and functional prediction of novel and drought-responsive lincRNAs in Populus trichocarpa[J]. Journal of Experimental Botany, 2014, 65(17): 4975-4983.
Wang H, Chung P J, Liu J, et al. Genome-wide identification of long noncoding natural antisense transcripts and their responses to light in Arabidopsis[J]. Genome Research, 2014, 24(3): 444-453.
Liu J, Jung C, Xu J, et al. Genome-wide analysis uncovers regulation of long intergenic noncoding RNAs in Arabidopsis[J]. The Plant Cell, 2012, 24(11): 4333-4345.
Amor B B, Wirth S, Merchan F, et al. Novel long non-protein coding RNAs involved in Arabidopsis differentiation and stress responses[J]. Genome Research, 2009, 19(1): 57-69.
Xin M M, Wang Y, Yao Y Y, et al. Identification and characterization of wheat long non-protein coding RNAs responsive to powdery mildew infection and heat stress by using microarray analysis and SBS sequencing[J]. BMC Plant Biology, 2011, 11(1): 61.
Lv Y, Liang Z K, Ge M, et al. Genome-wide identification and functional prediction of nitrogen-responsive intergenic and intronic long non-coding RNAs in maize (Zea mays L.)[J]. BMC genomics, 2016, 17(1): 350.
Li S X, Yu X, Lei N, et al. Genome-wide identification and functional prediction of cold and/or drought-responsive lncRNAs in cassava[J]. Scientific Reports, 2017, 7(1): 45981.
Yamaguchi-Shinozaki K, Shinozaki K. Transcriptional regulatory networks in cellular responses and tolerance to dehydration and cold stresses[J]. Annual Review of Plant Biology, 2006, 57(1): 781-803.
Saijo Y, kinoshita N, Hata S, et al. A Ca2+-dependent protein kinase that endows rice plants with cold- and salt-stress tolerance functions in vascular bundles[J]. Plant Cell Physiol, 2001, 42(11): 1228-1233.
Huang G T, Ma S L, Bai L P, et al. Signal transduction during cold, salt, and drought stresses in plants[J]. Molecular Biology Reports, 2012, 39(2): 969-987.
Agarwal P K, Agarwal P, Reddy M K, et al. Role of DREB transcription factors in abiotic and biotic stress tolerance in plants[J]. Plant Cell Reports, 2006, 25(12): 1263-1274.
Zhang Y C, Liao J Y, Li Z Y, et al. Genome-wide screening and functional analysis identify a large number of long noncoding RNAs involved in the sexual reproduction of rice[J]. Genome Biology, 2014, 15(12): 1-16.
責任编辑:白 净
