生大黄与清蒸大黄的大承气汤对血清内毒素、NO和TNF-α含量变化的影响
2021-02-22杨桂林刘承统曾海生何思陆周歧骥莫昕莹陈冬莲陆玉丹
杨桂林,刘承统,曾海生,何思陆,周歧骥,莫昕莹,陈冬莲,陆玉丹
(右江民族医学院附属医院,广西 百色 533000)
大承气汤始载于汉代张仲景的《伤寒论》和《金匮要略》,由大黄、枳实、厚朴和芒硝组成,是泻法的代表方剂[1,2],其具有泻下热结的作用,主治阳明腑实证和里热实证等[3]。目前临床上主要用于治疗急腹症、肠梗阻与胃肠道功能障碍等疾病,此外,该方剂在辅助改善脑血管病人意识、有机磷农药急性中毒抢救等方面也有很好的疗效[4,5]。研究表明,其具有泻下、降低炎性细胞因子、抑制血清内毒素、抗炎、提高机体免疫力和调节胃肠激素分泌等药理作用,对脑、肺等脏器具有明显的保护作用。大黄在大承气汤方剂中作君药,其安全性则由组成复方的中药决定,中药炮制后药性改变,毒副作用降低[6]。
大黄经过不同的方法炮制,其化学成分及其药效变化差异很大,甚至产生相反的药效[7]。目前报道的大多是大黄与多味药配伍前后药效的变化[8,9],不能证明大黄不同炮制品与多味药配伍后其泻下功效的改变及在不同配伍中体现的共性关系。本试验主要研究生大黄与清蒸大黄的大承气汤对ABP小鼠体内内毒素和NO的影响以及对炎性介质肿瘤坏死因子(TNF-α)的干扰,尝试说明大承气汤对其的作用与相关机理。
1 材料与方法
1.1 材料
1.1.1 仪器 UV-1800型紫外分光光度计(日本岛津公司);全波长酶标仪(美国BIOTEK-Epoch);低温离心机(上海安亭科学仪器厂);PRACTUM224-KN SOP电子分析天平(赛多利斯科学仪器(北京)有限公司);离心机(德国Thermo Fisher);水浴锅(上海一恒公司,HWS12);旋涡混合器。
1.1.2 药物与试剂 显色基质鲎试剂盒(厦门市鲎试剂试验厂有限公司,批号:180525);氨苄西林胶囊(联邦制药厂有限公司,批号:20300);一氧化氮(NO)测试盒(南京建成生物工程研究所,批号:20180406);炎性介质肿瘤坏死因子(TNF-α)(南京建成生物工程研究所,批号2018/06);生理盐水(贵州天地药业有限责任公司,批号:H18051906);试验用水为纯水。
1.1.3 药材 中药饮片大黄(产地:四川,批号170307002)、枳实(产地:江西,批号170101773)、姜厚朴(产地:陕西,批号 170507021)、芒硝(产地:青海,批号170307612)。生大黄、枳实、厚朴及芒硝购于广东康美药业有限公司,经广西中医药大学药用植物教研室李斌副教授鉴定,中药大黄为蓼科植物药用大黄(Rheum officinaleBaill.)的干燥根和根茎,枳实为芸香科植物酸橙(Citrus aurantiumL.)的干燥幼果,厚朴为木兰科植物厚朴(Magnolia officinalisRehd.et Wils.)或凹叶厚朴(Magnolia officinalisRe⁃hd.et Wils.var.bilobaRehd.et Wils.)的干燥干皮、根皮及枝皮,以上3味中药粉碎过10目筛。芒硝,中药名,经鉴定为硫酸盐类矿物芒硝族芒硝,为结晶体,主要含十水硫酸钠(Na2SO4·10H2O)。
1.1.4 动物 清洁级昆明小鼠,体量(20±2)g,雌雄对半。动物质量合格证号:0001757,生产许可证号:SCXK桂2014-0002,均由广西医科大学试验动物中心提供。
1.2 试验方法
1.2.1 试验药液提取 采用上述药材,按处方比例取厚朴药材粉末24 g,枳实12 g,大黄12 g,芒硝9 g,厚朴与枳实加纯水500 mL浸泡30 min,加热煮沸后保持微沸30 min,用500目滤布过滤,剩下的药渣再加纯水500 mL后浸泡30 min,然后加热煮沸保持微沸30 min,再过滤,合并两次滤液,然后加入大黄粉末,浸泡20 min后,再加热煮沸,保持微沸20 min,用500目滤布过滤,药渣再加入纯水300 mL,加热煮沸后保持微沸20 min,过滤,合并滤液,趁热加入芒硝,搅拌使溶解,浓缩成浓度为0.3∶1的药液(含生药0.3 g/mL),置于2~8℃冰箱储存备用。
同“1.2.1”项制备药液方法,将药液浓缩成浓度为0.5∶1的药液(含生药0.5 g/mL),置于2~8℃冰箱储存备用。生大黄的大承气汤记为生DCQT,清蒸大黄的大承气汤记为清蒸DCQT。
1.2.2 ABP小鼠动物模型的建立 参考文献[10]以及结合预试验,随机选取15只健康小鼠为正常对照组,腹腔注射氯化钠注射液0.5 mL/只。取小鼠粪便6 g,加入100 mL生理盐水,研磨均匀,静置30 min,取上层混悬液,腹腔注射,0.5 mL/只;腹腔注射后20 h,小鼠出现眼角分泌物浓稠、口唇发紫、少动、竖毛、蜷曲蹲伏、腹部鼓胀、不进食和大便极干等症状。解剖腹腔可见腹腔内有少量浑浊液体,多数肠管膨胀,肠管充血,部分肠管痉挛,即表示造模成功。在临床上可出现阳明腑实证,需用寒下法通里攻之。
1.2.3 分组给药 取体重为(20±2)g健康小鼠105只,雌雄各半,小鼠适应性喂养4 d后,随机分组,每组15只,分为以下7组:①生DCQT 6、10 g/kg剂量组;②清蒸DCQT 6、10 g/kg剂量组;③空白对照组;④模型组;⑤阳性对照组(氨苄西林,20 mL/kg体重,60 mg/mL)。
DCQT不同剂量组在造模成功后给药,连续2 d,1次/d。
阳性对照组给予氨苄西林,浓度60 mg/mL,20 mL/kg体重,造模成功后给药,连续2 d,1次/d。
空白对照组,20 mL/kg体重,腹腔注射生理盐水20 h后给予去离子水灌胃,连续2 d,1次/d。
模型组,20 mL/kg体重,造模成功后给予去离子水灌胃,连续2 d,1次/d。
给药后测定小鼠血清内毒素、NO和肿瘤坏死因子(TNF-ɑ)的含量。
1.2.4 血清内毒素含量测定 各实验动物组在造模成功42 h后,吸取鲎试剂检测配套的血液抗凝剂于无热源试管中,在无菌操作下进行眼球取血,血液放到无热源试管中与抗凝剂混匀,置冰水中,加盖,低温离心(3 000 r/min,10 min),精密吸取适量上清液,用内毒素检查用水配制成2倍稀释液储存备用。取2倍稀释液0.2 mL加入到0.8 mL样本处理液,混匀,制成10倍稀释液备用。将10倍稀释液于70℃恒温水浴中加热10 min(水浴加热需要封闭管口以避免水珠流入样品中),将加热后的10倍稀释液用冰水浴冷却后,在常温条件下离心(3 000 r/min,10 min),取上清液检测,检测步骤见显色基质鲎试剂盒说明书。以鲎试剂偶氮基质显色法定量测定,结果以EU/mL表示。
取(20±2)g健康小鼠 105只,雌雄各半,按“1.2.3”方法随机分组给药,按剂量6、10 g/kg,容积20 mL/kg灌胃给药,腹腔注射小鼠粪液20 h后灌胃给药,1次/d,连续2 d。
1.2.5 一氧化氮(NO)含量测定 试验采用的是硝酸还原酶法,试验按照试剂盒说明书操作。取(20±2)g健康小鼠105只,雌雄各半,按“1.2.3”方法随机分组给药,按剂量6、10 g/kg,容积20 mL/kg给药,腹腔注射小鼠粪液20 h后灌胃给药,1次/d,连续2 d。
1.2.6 炎性介质肿瘤坏死因子(TNF-α)测定 本试验采用酶联免疫吸附试验双抗体夹心法,严格按照试剂盒说明书操作。取(20±2)g健康小鼠105只,雌雄各半,按“1.2.3”方法随机分组给药,按剂量6、10 g/kg,容积20 mL/kg给药,腹腔注射小鼠自家粪液20 h后给药,1次/d,连续2 d。
1.2.7 统计学处理 试验数据均以(平均数±标准差)表示,采用SPSS 21.0统计软件进行数据分析。进行完全随机设计的多个样本均数比较的单因素方差分析,如差异具有显著性意义,则采用SNK-q检验进行多个样本均数间多重比较。P<0.05,则具有显著差异。
2 结果与分析
2.1 内毒素标准溶液配制与标准曲线的制作
细菌内毒素标准溶液配制与标准曲线(图1)的制作参照试剂盒说明书要求:分别加细菌内毒素(ET)检查用水0.00、0.50、0.75、0.90、1.00 mL,阴性对照及稀释后测得的吸光度数据详见表1。
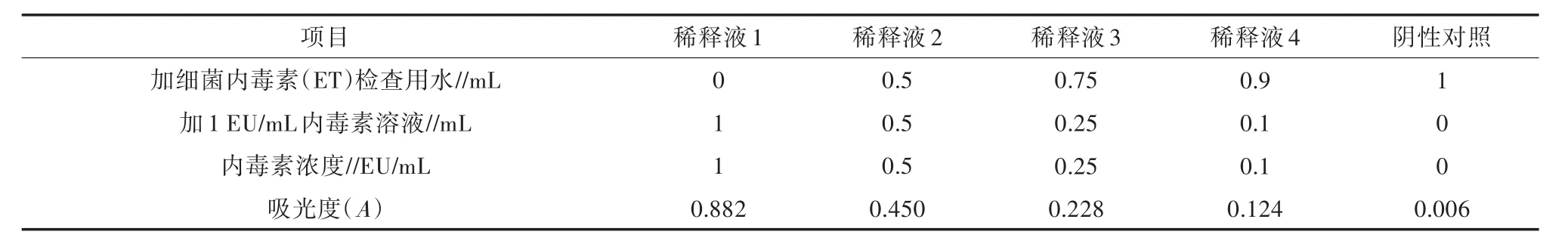
表1 内毒素(ET)标准曲线溶液
2.2 血清内毒素含量测定结果
由表2可知,生DCQT 10 g/kg剂量组与空白组相比较,其血中内毒素含量与空白组相近,无显著差异(P>0.05);生DCQT 6 g/kg剂量组、清蒸DCQT 6、10 g/kg剂量组、模型组和阳性组与空白组比较,其与空白组血中内毒素含量差异极显著(P<0.01)。
表2 大承气汤对ABP小鼠外周血内毒素含量的影响(±S,n=15)
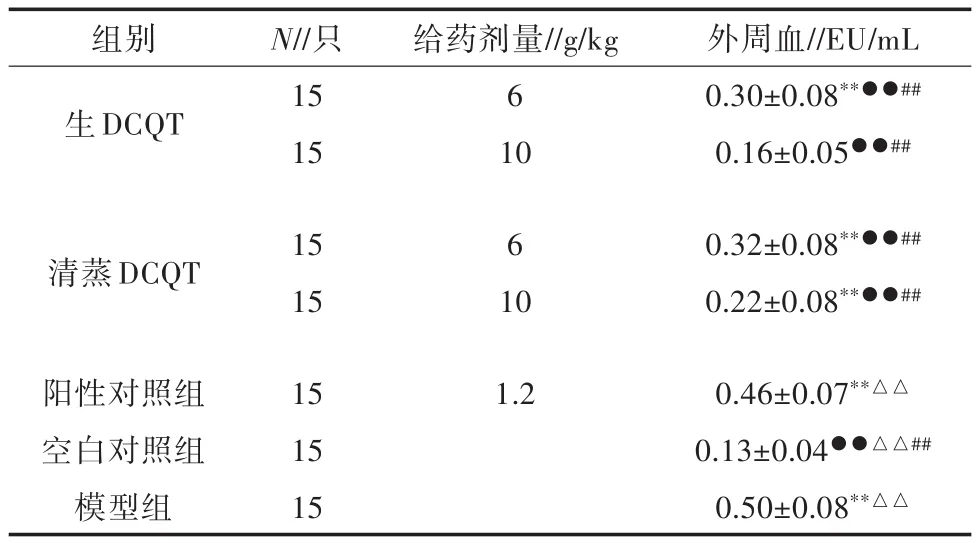
表2 大承气汤对ABP小鼠外周血内毒素含量的影响(±S,n=15)
注:与空白对照组比较,“*”为差异显著(P<0.05),“**”为差异极显著(P<0.01);与模型组比较,“●”为差异显著(P<0.05),“●●”为差异极显著(P<0.01);与生 DCQT组比较,“△”为差异显著(P<0.05),“△△”为差异极显著(P<0.01);与阳性组比较,“#”为差异显著(P<0.05),“##”为差异极显著(P<0.01);表3、表4同
组别生DCQT N//只15 15给药剂量//g/kg 6 10外周血//EU/mL 0.30±0.08**●●##0.16±0.05●●##清蒸DCQT 15 15 6 10 0.32±0.08**●●##0.22±0.08**●●##0.46±0.07**△△0.13±0.04●●△△##0.50±0.08**△△阳性对照组空白对照组模型组15 15 15 1.2
生 DCQT 6、10 g/kg剂量组、清蒸 DCQT 6、10 g/kg剂量组和空白组与模型组中内毒素含量比较,其与模型组血中内毒素含量差异极显著(P<0.01)。

图1 内毒素(ET)标准曲线
空白组与生DCQT 10 g/kg剂量组相比较,其血中内毒素含量与空白组相近,无显著性差异(P>0.05);空白组与生DCQT 6 g/kg剂量组相比较,其血中内毒素含量与空白组相近,差异不显著(P>0.05);清蒸DCQT 6 g/kg剂量组与生DCQT组中内毒素含量比较无显著差异(P>0.05)。
与阳性组比较,生DCQT 6、10 g/kg剂量组、清蒸DCQT 6、10 g/kg剂量组和空白组与其血中内毒素含量比较,具有极显著差异(P<0.01)。
2.3 一氧化氮(NO)含量测定结果
由表3可知,生DCQT 6、10 g/kg剂量组、清蒸DCQT 6、10 g/kg剂量组、模型组和阳性组与空白组比较,其与空白组血清NO含量都具有极显著差异(P<0.01);生DCQT 6、10 g/kg剂量组、清蒸DCQT 6、10 g/kg剂量组、空白组和阳性组与模型组比较,其与模型组血清NO含量都具有非常显著性差异(P<0.01);清蒸DCQT 6、10 g/kg剂量组与生DCQT组血清NO含量无显著差异(P>0.05);生DCQT 6、10 g/kg剂量组、清蒸DCQT 6、10 g/kg剂量组、空白组和模型组与阳性组比较,其与阳性组小鼠血清NO含量具有极显著差异(P<0.01)。
表3 大承气汤对ABP小鼠血清NO含量的影响(±S,n=15)

表3 大承气汤对ABP小鼠血清NO含量的影响(±S,n=15)
组别生DCQT N//只15 15给药剂量//g/kg 6 10 NO//μmol/L 183.52±14.71**●●##286.39±24.28**●●##清蒸DCQT 15 15 6 10 182.81±10.54**●●##287.83±25.07**●●##阳性对照组空白对照组模型组15 15 15 1.2201.03±10.05**●●△△42.57±5.24●●△△##72.26±6.41**△△##
2.4 炎性介质肿瘤坏死因子(TNF-α)测定结果
由表4可知,生DCQT 6、10 g/kg剂量组、清蒸DCQT 6、10 g/kg剂量组、模型组和阳性组与空白组比较,其与空白组小鼠血清TNF-α含量都具有极显著差异(P<0.01);生 DCQT 6、10 g/kg剂量组、清蒸DCQT 6、10 g/kg剂量组、空白组和阳性组与模型组比较,其与模型组小鼠血清TNF-ɑ含量都具有极显著差异(P<0.01);清蒸DCQT 6、10 g/kg剂量组与生DCQT组比较,其与生DCQT组小鼠血清TNF-α含量无显著差异(P>0.05);生DCQT 6、10 g/kg剂量组、清蒸DCQT 6、10 g/kg剂量组、空白组和模型组与阳性组比较,其与阳性组小鼠血清TNF-α含量都具有极显著差异(P<0.01)。
表4 大承气汤对ABP小鼠血清TNF-α含量的影响(±S,n=15)
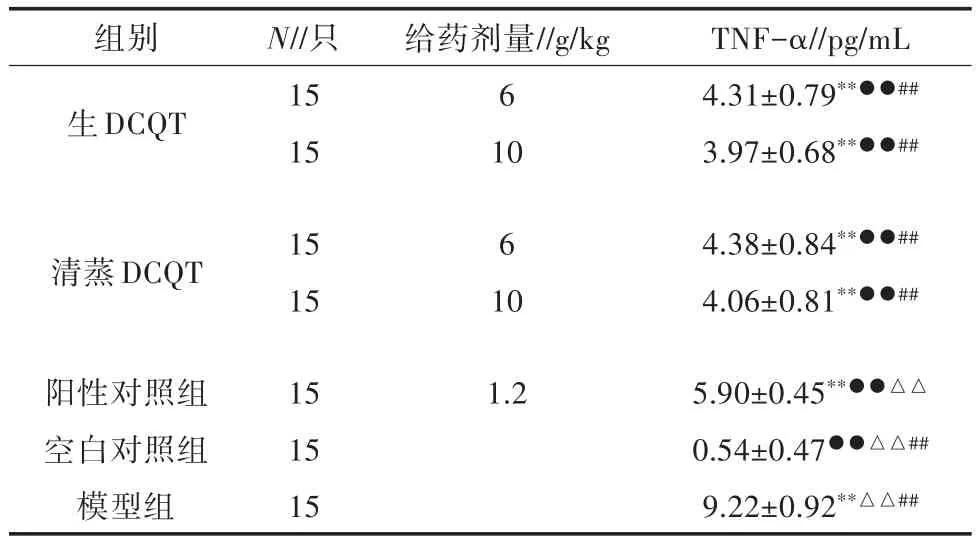
表4 大承气汤对ABP小鼠血清TNF-α含量的影响(±S,n=15)
组别生DCQT N//只15 15给药剂量//g/kg 6 10 TNF-α//pg/mL 4.31±0.79**●●##3.97±0.68**●●##清蒸DCQT 15 15 6 10 4.38±0.84**●●##4.06±0.81**●●##阳性对照组空白对照组模型组15 15 15 1.25.90±0.45**●●△△0.54±0.47●●△△##9.22±0.92**△△##
3 小结
相关研究表明[11],急性感染性疾病和急腹症等表现多是内毒素生物活性的体现,或者由其诱生的细胞因子与其他炎症介质所致。实热便秘是阳明腑实证的一种,实热便秘的致病因素之一即为内毒素(ET)。一氧化氮(NO)具有广泛的生物学活性,广泛分布于生物体内各组织中,它是一种新型生物信使分子,其在肠道内导致的多器官功能衰竭综合征(MODS)发病过程中起到关键作用[12]。肿瘤坏死因子的生成释放是机体对各种外源性或内源性物质刺激的反应,内毒素是肿瘤坏死因子释放的物质,内毒素和肿瘤坏死因子都能对机体造成伤害,两者结合能产生协同之作用[10]。肿瘤坏死因子可通过内分泌的作用进入血液循环,还可通过旁分泌的形式对邻近肠上皮细胞发生影响,从而对肠道的屏障功能产生一定的影响[13]。
试验研究结果表明,生大黄与清蒸大黄的大承气汤作用于实热壅滞的粪性腹膜炎(ABP)小鼠,其血中NO增加、血清内毒素和炎性介质肿瘤坏死因子(TNF-α)显著降低。相关研究表明[14,15],降低炎症介质的可能机制总结为:提高机体免疫力和网状内皮系统的吞噬能力;降低巨噬细胞的活性,继而减少NO和TNF-α等炎症因子的产生和释放;能增强胃肠道运动功能,增加肠血流量,降低肠粘膜通透性;保护溶酶体和线粒体膜,防止其损失,维持机体内的稳态平衡;降低机体氧自由基的存在,减少过氧化损伤。
