磁化水灌溉对镉胁迫下欧美杨Ⅰ-107苗期氮素营养代谢的影响
2021-02-22张志浩孔令刚毕思圣王华田孟诗原刘秀梅
张志浩 孔令刚 朱 红 毕思圣 王华田 孟诗原 刘秀梅
(1山东农业大学/黄河下游森林培育国家林业局重点实验室,山东 泰安 271018; 2 济南市林业科技推广站,山东 济南 271100;3广州市林业和园林科学研究院,广东 广州 510405;4上海市环境学校,上海 200135)
生物磁学已在医学、环保、农业及生物工程等领域得到了广泛应用[1]。近年来,国内外关于磁现象在种子处理、作物抗逆性以及土壤质量改善等领域开展了大量研究与应用,并在促进种子萌发、增强抗逆性以及提高作物产量和品质等方面取得了一定的研究成果。研究发现,磁化水易进入细胞,促进细胞新陈代谢,增强细胞活力,从而促进种子萌发与幼苗生长,并提高作物产量。如,利用磁化水浸种或灌溉幼苗,不仅可以提高种子发芽率、发芽势以及产量和品质[2-4],而且可以提高α-淀粉酶和蛋白酶等代谢酶的活性[5]。此外,磁化水能增加生物膜的渗透性,改善植物对营养物质的吸收,并提高植物抗逆性[6-8]。研究表明,磁化作用改变了水的pH 值、电导率及硬度等特性,这有利于无机盐类的溶解[9-11],从而为植物生长提供有利的环境条件。
镉(Cd)是一种广泛分布的重金属元素,易被植物吸收并累积,是植物生长的非必需元素,可改变植物的多种生理过程,干扰植物新陈代谢,影响植物的生长和发育[12-15]。另外,Cd 胁迫会影响植物对氮素的吸收、转运和分配[16],导致植株和籽粒中营养元素组成的变化。由此可见,Cd 的存在不仅影响植物对土壤养分的吸收利用,而且可形成Cd 与养分同时限制植物生长的恶性循环[17]。但由于研究材料、试验设计以及Cd处理浓度的差异导致所得研究结果不同,目前,关于植物养分代谢对Cd 胁迫的响应机理尚不明确。Cd 胁迫条件下,磁化水灌溉对植株生长以及耐Cd 能力均有一定的促进作用。张瑛等[18]发现磁化处理可以增加杨树幼苗中光合色素的含量,减轻Cd 胁迫对光合机构的伤害,促进植株生物量的累积,增强杨树对Cd 的耐受能力。Chen 等[19]发现,磁化处理降低了Cd 胁迫下绿豆(Vigna radiate)幼苗体内H2O2、O2-、丙二醛含量以及电解液外渗量,提高了一氧化氮合成酶(nitric oxide synthase,NOS)活性,以及提高了植株的光合特性。上述研究结果初步证明了磁化水可减轻Cd 对植物的伤害。因此,本研究以欧美杨I-107(Populus×euramericanaNeva)为试材,通过外源Cd 的添加,探索磁化水灌溉对杨树氮素吸收、转化与代谢的影响;通过对铵 态 氮(ammonium nitrogen, NH4+-N)、 硝 态 氮(nitrate nitrogen, NO3--N)和全氮(total nitrogen, TN)含量、氮代谢酶活性、游离氨基酸代谢以及根系形态指标的测定,阐明磁化水对Cd 胁迫后杨树营养代谢的影响以及欧美杨Ⅰ-107 作为林木修复树种在Cd 污染土壤中栽培的作用,以期为重金属污染土壤的修复和改良提供新的思路和可能性。
1 材料与方法
1.1 试验材料与试验地概况
盆栽试验于2017年3 ―5月在山东农业大学林学试验站(117°08′E,36°11′N)日光温室内进行,其面积为400 m2,温度为20 ~25℃,相对湿度为60% ~70%,光合量子通量密度为800 ~1 000 μmol.m-2.s-1。试验材料为1年生欧美杨Ⅰ-107,采自山东农业大学欧美杨Ⅰ-107 采穗圃。
1.2 试验设计
3月下旬选取1年生欧美杨Ⅰ-107 苗干中段直径为1.5±0.1 cm、长度为12.0 cm 的插穗扦插于营养袋(20 cm×22 cm)内,栽培基质为珍珠岩,每盆扦插2株,前期进行统一水分管理,于发芽后浇灌1/2 改良Hoagland 营养液。同年4月初待小苗生长稳定后,选取长势均匀的小苗进行Cd 胁迫处理。
以Cd(NO3)2.4H2O 作为Cd 源,溶解于1/2 改良Hoagland 营养液中用于磁化和非磁化水灌溉。试验共设置4 个处理,分别为磁化100 μmol∙L-1Cd(NO3)2.4H2O灌溉处理(M100)、非磁化100 μmol∙L-1Cd(NO3)2.4H2O灌溉处理(NM100)、磁化0 μmol∙L-1Cd(NO3)2.4H2O 灌溉处理(M0)、非磁化0 μmol∙L-1Cd(NO3)2.4H2O 灌溉处理(NM0)。磁化处理组利用U050 磁化装置(United Arab Emirates Branch, 俄罗斯)处理灌溉溶液,磁化器出水量为5 m3.h-1,磁场强度为300 Gs。
采用随机区组试验设计,每小区6 盆,重复5 次。每隔5 d 灌溉一次,每盆灌溉用水量为200 mL;30 d 后取中上部幼嫩叶片和新生细根,部分细跟4℃保存,用于根系形态测定,另一部分用去离子水冲洗干净后,于-80℃保存,用于氮素含量、氮代谢酶活性以及游离氨基酸合成量的测定。每处理至少重复测定3 次。
1.3 测定项目与方法
1.3.1 NO3--N、NH4+-N 和TN 含量测定 NO3--N 含量采用水杨酸-硫酸法测定[20];NH4+-N 含量采用水合茚三酮法测定[21];TN 含量采用凯氏定氮法测定[21]。
1.3.2 酶活性测定 硝酸还原酶(nitrate reductase,NR)活性和亚硝酸还原酶(nitrite reductase,NiR)活性采用张瑛等[22]的方法测定;谷氨酰胺合成酶(glutamine synthetase,GS)和谷氨酸合成酶(glutamate synthetase,GOGAT)活性采用王小纯等[23]的方法测定。
1.3.3 游离氨基酸含量测定 半胱氨酸(cysteine,Cys)、谷氨酸(glutamate,Glu)、谷氨酰胺(glutamine,Gln)以及甘氨酸(glycine,Gly)采用高效液相色谱法测定[24]。
1.3.4 根系形态测定 利用WinRHIZO PRO 2007 根系分析软件对根系长度、根表面积、平均直径、根体积以及不同径级根长和根尖数等形态学参数进行统计分析。
1.4 数据分析
采用Excel 2013 和SAS 9.0 进行数据处理,利用单因素方差分析(one-way ANOVA)和Duncan 新复极差法(Duncan’s multiple-range)进行差异显著性分析(P<0.05)。
2 结果与分析
2.1 杨树叶片和根系中氮素含量变化
由图1 可知,Cd 胁迫后(M100、NM100) 叶片中NH4+-N、NO3--N 及TN 含量较M0和NM0显著降低,且NH4+-N 含量下降比例最大,为61.3%~64.0%。磁化水灌溉处理均有利于叶片中氮素含量的积累,与NM0相比,M0叶片的NH4+-N、NO3--N 及TN 含量均提高;与NM100相比,M100叶片中3 种形态氮含量提高4.1%~53.5%;此外,磁化水灌溉与非磁化水灌溉叶片中NH4+-N 和NO3--N 含量差异均达显著水平(P<0.05),且磁化水灌溉中NH4+-N 含量提高比例较大,为53%~66%。
根系中氮素含量变化与叶片中表现略有不同(图1)。与M0和NM0相比,Cd 胁迫后(M100、NM100),根系中NH4+-N 和NO3--N 含量显著下降(P<0.05),且NH4+-N 含量下降比例较大,平均降低43.1%;TN含量变化则相反,Cd 胁迫后TN 含量均提高,且M100较M0显著提高(P<0.05)。与非磁化水灌溉处理相比(NM0、NM100),磁化水灌溉处理(M0、M100)提高了NH4+-N 和TN 在根系中的累积。其中,NH4+-N 含量提高比例最大,呈显著差异水平;TN 含量提高比例相对较小,但M100与NM100根系中TN 含量的差异仍达显著水平(P<0.05);与NH4+-N 和TN 变化趋势相反,与非磁化水灌溉处理(NM0、NM100)相比,磁化水灌溉处理(M0、M100)后根系中NO3--N含量显著降低(P<0.05),且Cd 胁迫后降低比例较大。

图1 磁化水灌溉对Cd 胁迫下杨树叶片和根系中NH4+-N、NO3--N 以及TN 含量的影响Fig.1 Changes in the contents of ammonium nitrogen (NH4+-N), nitrate nitrogen (NO3--N), and the total nitrogen (TN) in the leaves and roots, respectively, of Neva after irrigating with magnetic or non-magnetic treatment of water under cadmium stress
2.2 杨树叶片和根系中氮代谢酶活性变化
由图2 可知,与M0和NM0相比,Cd 胁迫(M100、NM100)对叶片中不同氮素代谢酶的活性影响不同。Cd 胁迫诱导NR、GS 活性提高。NiR 活性则相反,Cd胁迫后略有降低,但下降幅度较小。与非磁化水灌溉处理(NM0、NM100)相比,磁化水灌溉处理(M0、M100)后刺激氮代谢酶活性提高,且GS 和GOGAT 活性差异达显著水平。
Cd 胁迫下,根系中不同氮素代谢酶对Cd 胁迫的反应不同(图2)。Cd 胁迫提高了NR、GS 活性,且对NR 活性的促进作用最强,平均提高29.0%,对NR 和GS 活性有显著影响(P<0.05);Cd 胁迫对NiR 有抑制作用,但其活性变化较小。与非磁化水灌溉处理(NM0、NM100)相比,磁化水灌溉处理(M0、M100)有利于提高NR、GS 活性,且磁化水灌溉后根系中GS 活性提高比例最大,平均提高52.2%。NiR 和GOGAT 活性则与之相反,磁化处理后其活性降低,但差异较小。
2.3 杨树叶片和根系中游离氨基酸含量变化
通过对叶片中游离氨基酸含量(Cys、Glu、Gln、Gly)分析可知(图3),Cd 胁迫(M100、NM100)后,叶片中Cys、Gln 和Gly 含 量 较M0和NM0显著降 低(P<0.05);其中,Cd 胁迫后杨树叶片Gly 含量降低比例最大,平均降低61.2%。但Cd 胁迫后有利于Glu 含量的积累,Cd 胁迫处理较非Cd 处理显著提高4%~201%。与非磁化水灌溉处理(NM0、NM100)相比,磁化水灌溉处理(M0、M100)提高了叶片中Cys 和Gln 含量,但抑制了Glu 和Gly 的合成;且磁化水灌溉后叶片中Cys 含量提高比例最大,平均提高104.8%,而Gly 含量降低比例最小,平均降低48.2%。
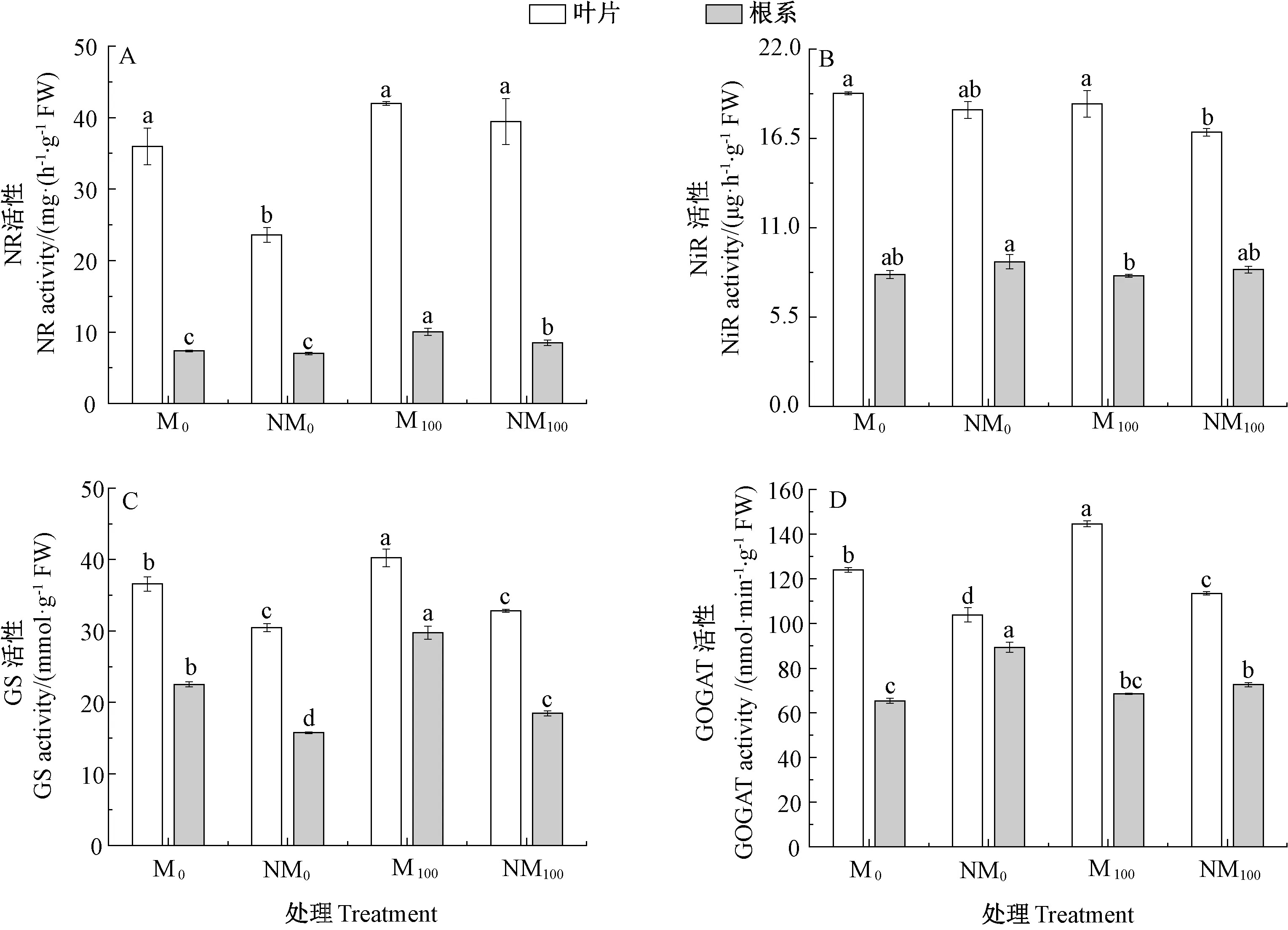
图2 磁化水灌溉对Cd 胁迫下杨树叶片和根系中硝酸还原酶(NR)、亚硝酸还原酶(NiR)、谷氨酰胺合成酶(GS)以及谷氨酸合成酶(GOGAT)活性的影响Fig.2 Changes in the enzyme activities of nitrate reductase (NR), nitrite reductase (NiR), glutamine synthetase (GS) and glutamate synthase (GOGAT) in the leaves and roots, respectively, of Neva after irrigating with magnetic or non-magnetic treatment of water under cadmium stress
Cd 胁迫条件下,根系中不同种游离氨基酸含量变化表现不同。与M0相比,M100根系中Cys、Glu、Gln 和Gly 含量均提高,Cys 含量提高幅度最大,Gln 含量变化幅度较小。与非磁化水灌溉处理(NM0、NM100)相比,磁化水灌溉处理(M0、M100)根系中Cys、Glu、Gln 和Gly含量均提高;其中,Cys 含量变化较小;而Gly 含量提高比例最大,平均提高18.8 倍。
2.4 杨树根系形态指标变化
通过对杨树根系形态指标(根系长度、根表面积、平均直径、根体积、根尖数、≤1.5 cm 短根数量分析可知(表1),与M0相比,M100的根系长度、根表面积、平均直径、根体积和根尖数均降低;但短根数量提高18.8%。NM100的根系长度、根表面积、根体积和短根数量均较NM0提高,但平均直径和根尖数则降低。另外,磁化水灌溉处理后杨树根系形态指标升高,且根尖数的提高幅度最大。
3 讨论
3.1 磁化水灌溉对Cd 胁迫条件下杨树根系形态特性的影响
根系形态性状会因植物环境变化而改变。研究发现,磁化水灌溉有利于Cd 胁迫条件下根系形态发育(表1),有利于杨树根系建成,对根系长度、根表面积、平均直径、根体积、根尖数、短根数量等均有促进作用。Meng 等[25]发现外源不同浓度的植物生长调节剂可促进Cd 胁迫下油菜(Brassica napusL.)根系伸长生长,Xu 等[26]发现外源施入100 μmol.L-1硝普钠(sodium nitroprusside,SNP)可有效维持Cd 胁迫下蒺藜苜蓿(Medicago truncatula)幼苗质膜的完整性,降低其对Cd的吸收并促进其根系生长;本研究结果与之相似,说明在Cd 胁迫下,杨树将植物体有限的资源分配到根系中,促进根系的生长,以提高对逆境胁迫的适应能力[27-28]。另外,磁化水灌溉能够维持良好的根系形态性状从而有利于水分和养分的吸收,这表示磁化水灌溉处理对Cd 胁迫后杨树根系的生长发育起到了一定的保护作用。

表1 Cd 胁迫下磁化与非磁化水灌溉后杨树根系形态指标变化Table 1 Changes in roots morphological characteristics of Neva when irrigating with magnetic or non-magnetic treatment of water under cadmium stress
3.2 磁化水灌溉对Cd 胁迫条件下杨树氮代谢的影响
氮素是植物必需营养元素之一,氮素代谢也是植物生命活动的基本过程[29]。NH4+-N 和NO3--N 是植物从土壤中吸收的主要氮素形态,其中NO3--N 可直接被植物吸收利用[30-31]。NR 和NiR 活性高低在初级氮同化调控中起着非常重要的作用,显著影响植物的生长发育[32]。研究表明,Cd 胁迫提高了杨树叶片和根系的NR 活性,抑制了NiR 活性;同时杨树体内TN含量提高,磁化处理后叶片中较高的TN 含量可以保证叶片的生产性能。
磁化作用诱导叶片中NO3--N 含量提高,但在根系中其含量降低;另外,根系中的NH4+-N 含量高于叶片;同时,磁化作用提高了叶片和根系中的NR 活性,且叶片中NR 活性是根系的4 ~5 倍;叶片NiR 活性是根系的2 倍多。一方面是因为,磁化作用下,杨树根系吸收的NH4+不能直接运输到叶片,而根系中NO3-向叶片中优先运输,从而使根系中NO3-含量降低而叶片中升高;NO3-是诱导NR 和NiR 活性的主要信号,一定范围内,NR 和NiR 活性主要取决于营养物质中NO3-浓度;磁化作用诱导杨树叶片中充足的NO3-供应,其对NR 和NiR 活性皆有促进作用[33]。另一方面,磁化水灌溉处理提高了叶片中的NR 和NiR 活性,有利于硝酸盐向亚硝酸盐的转化;且叶片中NiR 活性的提高可以避免亚硝酸盐累积造成对叶片组织的毒害;根系中NiR 活性降低为氨基酸的合成提供原料物质。
3.3 磁化水灌溉对Cd 胁迫条件下杨树游离氨基酸合成与转化的影响
GS-GOGAT 循环是铵离子同化的主要途径之一,铵的同化不仅可以解除铵离子对植物组织的毒害作用,而且能够满足植物对氮营养的需求[34]。GS 是GSGOGAT 循环中氮代谢中心的关键酶,对植株体内氮同化和代谢效率有重要影响[35-36]。研究发现,Cd 胁迫会抑制GS-GOGAT 循环效率[37];而磁化水灌溉会诱导叶片和根系中GS 活性提高,可促使GS 与大量NH4+结合生成Gln,起到缓解铵毒和补充Glu 的作用[38]。另外,磁化作用诱导根系组织中Glu、Gln 和Gly 含量显著提高,其中Gly 平均合成量为非磁化水灌溉处理的18 倍左右,这可能是由于磁化水灌溉处理加速了根中的GS 和GOGAT 循环,加快了NH4+同化,使得氨基酸含量增加,同时提高了叶片NR 活性,加快硝态氮的转化速率。
Cd 胁迫下,磁化作用诱导根系中Cys、Gln、Glu 和Gly 四种游离氨基酸含量显著上升,说明磁化作用可通过调节组织氨基酸代谢以缓解高浓度Cd 富集造成的根系损伤以及离子稳态失衡等生理伤害;氨基酸作为NO3--N 还原后的同化产物,对氮代谢具有反馈调节作用,值得注意的是,磁化水灌溉后根系中Gly 合成量提高、NO3--N 浓度降低以及TN 含量的增加,可以使植株各部位累积的碳水化合物即碳架得到合理和高效利用,Cd 胁迫条件下,磁化水灌溉处理提高了叶片中的Cys 含量,可为蛋白质的合成提供原料物质;磁化作用下,较高的GS 活性对Glu 的需求量增多,消耗更多的Glu 以合成Gln,从而造成Glu 合成量降低;Glu与Gln 相比增加比例较大,这可能是Gln 对NH4+的蓄积能力较强,对解除游离铵毒害中起一定作用;而关于磁化作用诱导叶片中Gly 合成量降低的原因Gly 与其他游离氨基酸之间的作用关系及其在氮同化中的作用则有待进一步研究。
4 结论
研究结果表明,磁化水灌溉有利于Cd 胁迫下杨树根系形态的建成;另外,磁化水灌溉改变了杨树叶片和根系中氮素营养的吸收和转运,对促进叶片和根系中氮素代谢以及降低亚硝酸盐的累积有明显效果;进而提高了杨树对Cd 胁迫环境的适应能力。但目前本研究仅是盆栽基质栽培试验,与实际生产过程中所得试验效果存在一定的差异,今后还需在大田条件下进一步揭示磁化水灌溉条件下杨树对Cd 污染土壤的适应机理。
