槲皮素对异烟肼诱导肝细胞毒性的保护作用及其机制
2021-02-22陈廷玉陈大印富徐燕卢春凤
陈廷玉,陈大印,沈 洪,富徐燕,卢春凤,
(1.湖州师范学院医学院,浙江 湖州 313000;2.佳木斯大学,黑龙江 佳木斯 154007)
近年来,结核病发病率在全球又呈迅速回升趋势,已成为世界性的公共卫生问题。在抗结核治疗方案中异烟肼(isonicotinyl hydrazide,INH)是不可替代的一线抗结核药。临床和实验研究已证明INH可引起肝损伤,有时甚至发生急性肝衰竭,其明显的肝毒性严重限制了它的临床应用。虽然有关INH肝毒性作用及其机制已有研究,但对其认识目前仍不十分清楚,导致临床在防治INH肝毒性时存在明显盲目性,甚至出现了滥用保肝疗法的情况。因此,阐明INH肝毒性机制,寻找合适的肝保护剂已成为抗结核治疗亟需解决的问题。
槲皮素作为一种天然黄酮类化合物,具有抗氧化及清除自由基、调节免疫功能及抗肿瘤、抗肝纤维化、抗菌、抗血小板聚集等多种药理作用,且易于提取,使用安全,具有理想的临床应用前景。课题组前期研究发现INH可诱导肝细胞凋亡及氧化损伤,并且槲皮素对其具有保护效应,但其具体作用机制尚未阐明。因此,本研究以L-02正常人肝细胞为实验对象,建立INH诱导的肝细胞损伤模型,以线粒体为靶点,以活性氧(reactive oxygen species,ROS)为切入点,通过应用ROS清除剂谷胱甘肽(glutathion,GSH)后,比较槲皮素处理细胞前后INH对ROS介导的氧化应激的影响,探讨ROS介导线粒体氧化损伤在INH肝细胞毒性中的作用及槲皮素对INH肝细胞毒性的保护效应,为寻找有效防治INH肝毒性药物及进一步研究槲皮素的临床应用提供实验基础和科学依据。
1 材料与方法
1.1 细胞和主要试剂
L-02细胞购自中国科学院上海细胞生物研究所;DMEM培养基为Gibco公司产品;FBS为Hyclone公司产品;异烟肼、槲皮素、GSH(ROS清除剂)、DCFHDA、Rh-123等为Sigma公司产品;8-羟基脱氧鸟嘌呤核苷(8-hydroxydeoxyguanine nucleoside,8-OHdG)ELISA试剂盒、蛋白质羰基含量测定试剂盒为Abcam公司产品;丙二醛(malondialdehyde,MDA)检测试剂盒为南京建成生物工程研究所;BCA蛋白定量试剂盒为杭州碧云天公司产品。
1.2 方法
1.2.1 实验分组及处理
L-02细胞用含10%胎牛血清的DMEM培养液常规培养,将细胞随机分为:异烟肼组,给予10 mmol/L INH;槲皮素处理组,给予10mmol/L INH和50 μmol/L槲皮素;谷胱甘肽预处理组,先用ROS清除剂GSH 20 mg/mL预处理细胞1 h,然后给予10 mmol/L INH和50 μmol/L槲皮素;谷胱甘肽组,用ROS清除剂GSH 20 mg/mL处理细胞1 h;对照组,给予等体积的无血清培养基。将生长良好的指数生长期细胞,按上述分组进行处理,培养24 h,收集细胞进行相关指标检测。1.2.2 荧光探针DCFH-DA检测细胞线粒体ROS水平
细胞按上述实验分组进行处理,收集各组细胞,采用差速离心法制备细胞线粒体。将上述各组细胞线粒体用HEPES缓冲液重悬,并吹打均匀制成线粒体悬液,加入荧光探针DCFH-DA 10 μmol/L,37℃孵育30 min,使用多功能酶标仪,在激发波长490 nm下,测定其荧光强度D
(490)。ROS水平以相对值表示,即D
(490)/D
(490)×100%。1.2.3 荧光探针Rho-123检测细胞线粒体膜电位
将上述线粒体悬液,加入Rho-123染色液,使其终浓度为5 mg/L,置于培养箱内避光孵育20 min,冷PBS漂洗去除非特异性荧光后,使用多功能酶标仪测定其荧光强度(激发波长490 nm)。线粒体膜电位以相对值表示,即D(
490)/D(
490)×100%。1.2.4 氧化损伤指标检测
细胞按上述分组处理后,采用TBA比色法测定脂质过氧化产物MDA含量;应用DPNH比色法测定蛋白氧化损伤产物蛋白质羰基的含量;采用ELISA法检测mtDNA氧化损伤的产物8-OHdG含量,评价细胞线粒体氧化损伤状态。应用BCA法测定细胞样品蛋白含量。1.3 统计学分析

2 结果
2.1 槲皮素和GSH处理后L-02细胞线粒体ROS相对水平
荧光探针DCFH-DA检测结果见图1。与对照组相比,INH处理细胞后细胞线粒体ROS相对水平升高(P
<0.01),表明INH可诱导线粒体ROS的生成。与异烟肼组相比,槲皮素处理组细胞线粒体ROS相对水平降低(P
<0.01),表明槲皮素可抑制细胞线粒体ROS的生成;谷胱甘肽预处理组细胞线粒体ROS相对水平低于槲皮素处理组(P
<0.05),表明ROS清除剂GSH能明显抑制INH对线粒体ROS生成的促进作用。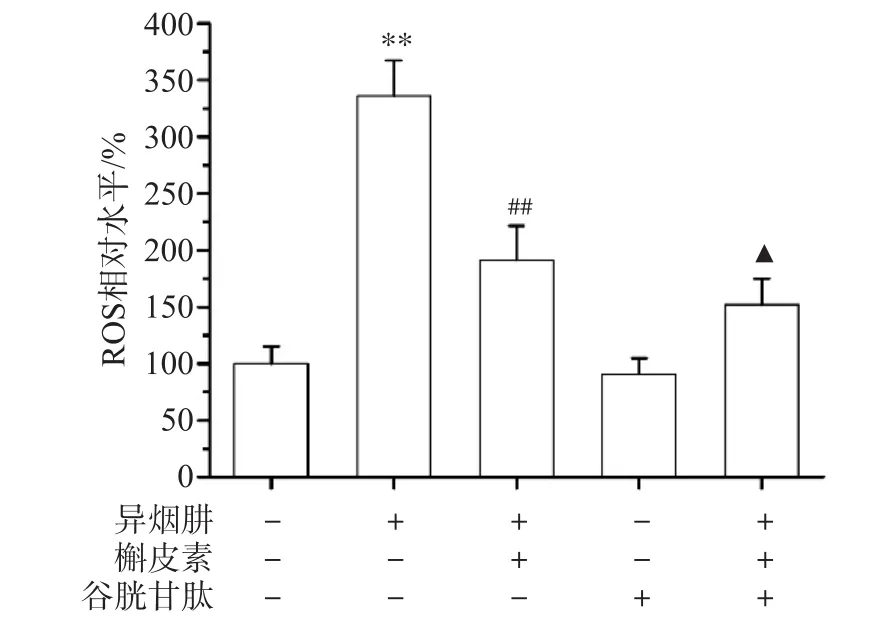
图1 L-02细胞线粒体ROS相对水平
2.2 槲皮素和GSH处理后L-02细胞线粒体膜电位相对水平
荧光探针Rho-123检测结果见图2,与对照组相比,细胞经INH处理后线粒体膜电位降低(P
<0.01),表明INH可造成线粒体损伤。槲皮素处理组细胞线粒体膜电位高于异烟肼组(P
<0.05),表明槲皮素对INH诱导的细胞线粒体损伤有保护作用;谷胱甘肽预处理组细胞线粒体膜电位高于槲皮素处理组(P
<0.05)。此结果提示ROS参与INH引起的细胞线粒体损伤。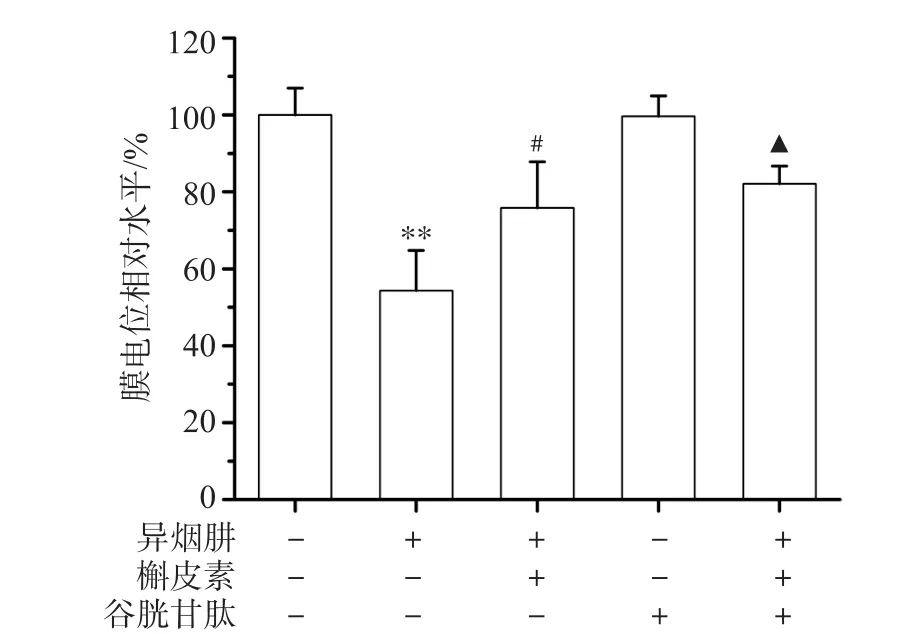
图2 L-02细胞线粒体膜电位相对水平
2.3 槲皮素和GSH处理后L-02细胞中的MDA含量
TBA比色法检测结果见图3,与对照组相比,细胞经INH处理后MDA含量增加(P
<0.01),表明INH可诱导脂质过氧化反应。与异烟肼组比较,应用槲皮素后可使MDA含量减少(P
<0.01),表明槲皮素可以抑制INH诱导的脂质过氧化反应;谷胱甘肽预处理组MDA含量低于槲皮素处理组(P
<0.05),表明给予ROS清除剂GSH能明显抑制INH诱导的脂质过氧化反应。此结果提示,ROS参与了INH引起的肝细胞线粒体脂质过氧化反应。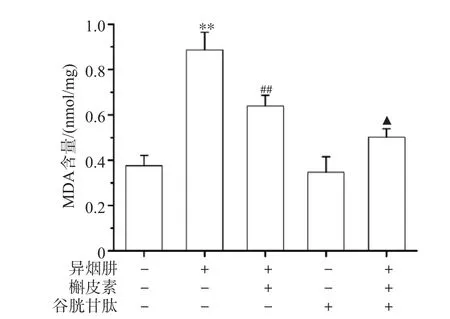
图3L-02细胞MDA含量
2.4 槲皮素和GSH处理后L-02细胞中的蛋白质羰基含量
DPNH比色法检测结果见图4,与对照组比较,INH处理细胞后,可增加细胞蛋白羰基含量(P
<0.01),表明INH可造成蛋白氧化损伤。与异烟肼组比较,槲皮素可使蛋白羰基含量减少(P
<0.01),表明槲皮素对INH诱导的蛋白氧化损伤有保护作用;谷胱甘肽预处理组蛋白羰基含量低于槲皮素处理组(P
<0.05),表明给予ROS清除剂GSH能明显抑制INH诱导的蛋白氧化损伤。此结果提示,ROS参与INH引起的蛋白氧化损伤。2.5 槲皮素和GSH处理后L-02细胞中的8-OHdG含量
ELISA检测结果见图5,与对照组比较,INH处理细胞后8-OHdG含量增加(P
<0.01),表明INH可造成mtDNA氧化损伤。应用槲皮素可使8-OHdG含量低于异烟肼组(P
<0.01),表明槲皮素对INH诱导的mtDNA氧化损伤具有保护作用;谷胱甘肽预处理组8-OHdG含量低于槲皮素处理组(P
<0.05),表明给予ROS清除剂GSH能明显地抑制INH诱导的mtDNA氧化损伤。此结果提示,ROS参与INH引起的mtDNA氧化损伤。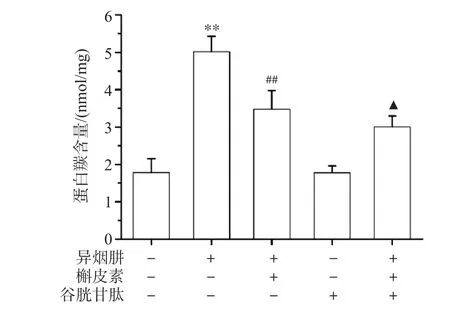
图4 L-02细胞蛋白质羰基含量
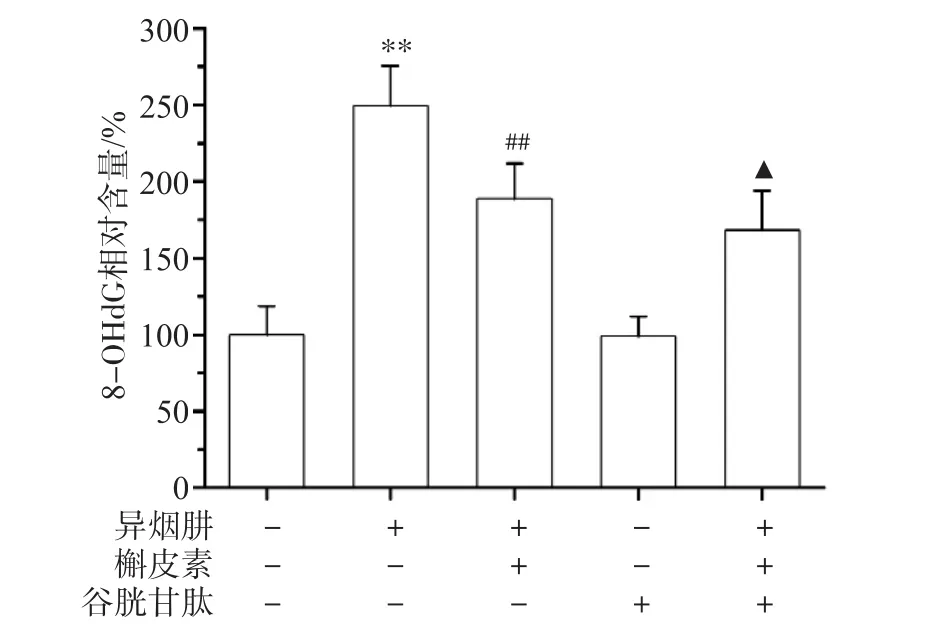
图5 L-02细胞8-OHdG含量
3 讨论
INH对肝脏的损伤机制是多重和复杂的,确切机制至今仍不是很清楚,但普遍认为,INH的肝毒性是由其代谢产物介导的。Ergul等研究发现,INH可引起肝脏氧化损伤,而抗氧化剂能够对抗INH引起的肝损伤。课题组前期研究应用大鼠从整体动物水平观察了INH对大鼠肝脏的影响,结果发现INH可造成大鼠肝脏氧化损伤。这些研究表明,氧化损伤在INH肝毒性中具有重要作用。INH在体内代谢过程中通过氧化还原反应产生ROS,过量ROS有可能是INH产生肝毒性的主要因素。研究表明,ROS过多生成可损伤线粒体膜,导致线粒体膜电位降低。因此,本实验检测了L-02细胞线粒体ROS水平及线粒体膜电位。结果显示,L-02细胞经INH处理后,线粒体ROS水平升高,膜电位降低,表明INH可促进线粒体ROS生成,造成线粒体损伤。那么INH导致的肝细胞损伤是否与ROS介导的线粒体氧化损伤有关?本研究进一步检测了细胞线粒体氧化损伤的重要指标:脂质过氧化产物MDA、蛋白质氧化产物蛋白羰基、mtDNA氧化损伤产物8-OHdG,其含量的多少可反映细胞线粒体氧化损伤的程度。本实验研究发现,L-02细胞经INH处理后,MDA、蛋白质羰基及8-OHdG含量增加,表明在本实验条件下,INH可促进线粒体ROS产生,导致线粒体氧化损伤。这与Bansal等的研究结果一致。
研究表明,槲皮素在体外可通过清除氧自由基、抑制DNA损伤等发挥抗氧化作用,有希望成为抗超氧阴离子的新药。本实验结果显示,槲皮素能明显减少L-02细胞线粒体ROS生成,并增加线粒体膜电位,表明槲皮素可抑制ROS生成,改善线粒体功能。结果还发现,应用槲皮素后可使MDA、蛋白羰基、8-OHdG含量减少,表明槲皮素对INH诱导的细胞线粒体氧化损伤具有保护效应,其机制可能与槲皮素减少细胞线粒体ROS生成,抑制细胞线粒体氧化损伤有关。Zou等研究发现槲皮素具有逆转HO引起的细胞氧化损伤和凋亡作用,其机制与抗氧化和稳定线粒体膜,阻止促凋亡途径有关,提示槲皮素对线粒体氧化损伤有保护作用。在其他实验模型研究中也发现,槲皮素也可以通过抑制细胞线粒体膜通透性转换孔开放和ROS生成,减轻肝细胞线粒体氧化损伤。因此,我们认为槲皮素清除细胞线粒体ROS,抑制线粒体氧化损伤可能是其抗INH肝毒性的主要机制之一。
为了明确ROS在INH诱导肝细胞线粒体损伤中的作用,并探讨ROS介导的线粒体氧化损伤在槲皮素抗INH肝细胞毒性中的作用,本研究通过应用ROS清除剂GSH清除肝细胞内ROS,分析槲皮素处理细胞前后INH对ROS介导的线粒体氧化应激的影响,以评价ROS介导的线粒体氧化损伤在INH肝细胞毒性及槲皮素抗INH肝细胞毒性中的作用。本研究结果显示,当加入ROS清除剂后,细胞线粒体ROS水平、MDA、蛋白羰基、8-OHdG的含量进一步降低,而线粒体膜电位升高。表明在INH处理细胞前给予ROS清除剂GSH能明显抑制INH诱导的细胞线粒体氧化损伤,提示ROS参与了INH导致的肝细胞线粒体氧化损伤,证实了ROS介导的线粒体损伤在INH诱导肝细胞毒性中发挥了重要的作用。本研究还发现,应用ROS清除剂后,槲皮素对INH诱导的线粒体氧化损伤的抑制作用更明显,进一步证实ROS介导的氧化损伤在槲皮素抗INH肝细胞毒性中发挥重要的作用。本研究结果还提示,槲皮素对INH肝细胞毒性的保护效应除了与其能清除ROS有关外,可能还有其他的机制参与。
总之,在本实验条件下,INH可诱导L-02肝细胞线粒体发生氧化损伤,ROS介导的线粒体氧化损伤在INH诱导肝细胞毒性中发挥了重要作用;槲皮素对INH诱导的线粒体氧化损伤具有保护效应,其机制可能与清除线粒体ROS,抑制ROS介导的线粒体氧化损伤有关。但具体机制尚有待进一步深入研究。
