转移性结直肠癌患者外周血及肿瘤组织RAS 基因突变一致性对西妥昔单抗治疗疗效的影响*
2021-02-15王永洪王健贺万斌付榆但杰朱明杰
王永洪 王健 贺万斌 付榆 但杰 朱明杰
(四川省乐山市人民医院 乐山 614000)
结直肠癌(CRC)是常见的胃肠道恶性肿瘤之一,发病早期临床症状缺乏典型性,具有发病率高、致死率高等特点[1]。目前,临床上治疗CRC 以手术切除根治为主,虽然能切除病灶组织,但是30%以上患者确诊时已经发生转移,即发展为转移性结直肠癌(mCRC)(肝脏是CRC 血行转移主要靶器官),mCRC 成为我国居民死亡的重要原因。mCRC 治疗中,借助单克隆抗体西妥昔单抗或帕尼单抗能竞争性阻断表皮生长因子(EGF)和其他配体的结合,抑制癌细胞的增殖,诱导癌细胞凋亡[2]。循环游离DNA(cfDNA)是一种天然存在于血细胞中的物质,且越来越多的研究证实,实体瘤的基因突变可能是由携带循环肿瘤DNA 的癌症细胞进入血浆引起。本研究以mCRC 患者为研究对象,探讨mCRC 患者外周血及肿瘤组织RAS 基因突变一致性对西妥昔单抗治疗疗效的影响。现报道如下:
1 资料与方法
1.1 一般资料 选择2017 年5 月~2018 年12 月收治的mCRC 患者69 例作为研究对象,男37 例,女32 例,年龄20~84 岁,平均(57.85±5.79)岁;原发肿瘤部位:左半结直肠51 例,右半结肠18 例;转移类型:同时性48 例,异时性21 例;腹膜转移:有9例,无60 例。纳入标准:(1)符合mCRC 诊断标准,均经病理学、影像学检查确诊;(2)肿瘤原发灶及转移灶部位明确;(3)均处于姑息性一线或二线化疗;(4)具备一个可用的mCRC 用于肿瘤组织突变分析诊断。排除标准:(1)精神异常、凝血功能异常或认知功能异常者;(2)血液系统疾病、严重肝肾功能异常或伴有自身免疫系统疾病者。
1.2 研究方法
1.2.1 标本采集 所有患者的肿瘤组织均采用石蜡包埋进行常规处理,肿瘤组织区域的选择由病理学专家评估。同时应考虑肿瘤组织标准化所需样本量。外周血血浆和血液中制备标本如下:入组患者借助DETA 管采集血浆10 ml,60 min 离心,采用两步血液离心操作进行10 min 离心,速度1 600 rpm,操作完毕后采集上清;将剩余的细胞在室温下完成10 min 离心,速度3 000 rpm,血浆上清转移到EP 管1.5 ml 中,储存在-80℃冰箱中,备用。所有患者肿瘤组织经石蜡包埋后进行突变分析,并由医院病理科专家评估、确认肿瘤细胞数;10 μm 切片制备前,56℃下利用二甲苯、乙醇提取物对脱蜡面积>15%肿瘤组织进行过夜,并给予蛋白酶K 消化。
1.2.2 RAS 基因突变分析 采用放射免疫法和实时荧光定量PCR 技术对血浆和肿瘤组织进行RAS状态检测。从mCRC 患者中的组织中提取DNA,并完成相关检测;采用放射免疫法评估RAS 基因突变情况。当检测结果不一致时,可查询历史RAS 检测报告,若组织可用,再转移时利用SOC 技术再次完成RAS 基因检测。(1)DNA 纯化。借助循环核酸试剂盒完成DNA 的提取、纯化。采用DNA 纯化试剂盒完成FFPE 样品提取与自动化系统maxwell16 FFPE 浓度测定。采用Nanodrop 1000 分光光度仪完成DNA 浓度提取。(2)肿瘤组织中ctDNA 的BEAMing 技术。从2 ml 血浆中获得检测样本,利用oncobeam RAS CR 检测试剂盒检测。利用流式细胞仪获得的数据通过FCS Express TM 软件进行分析;突变率>0.02%~0.04%的样品为阳性。采用荧光标记探针完成敏感基因位点的检测,并利用流式细胞仪获得实时荧光定量(PCR)相关产物,采用FCS Express 软件比较突变体与野生型等位基因的比例;突变率在1%以上为阳性[3]。
1.2.3 实时荧光定量PCR 技术检测 (1)总RNA的提取。向样品中加入200 μl 氯仿,15 s 振荡后进行15 min 离心,速度4 500 rpm。离心完毕后去除上清,加入预冷乙醇1 ml,常温下干燥7 min;在A260吸光值下完成总RNA 测定。(2)检测。采用PCR 法测定RAS 基因突变位点,50 ng 的DNA 被用于外部引物扩增,95℃下连续完成14 个循环,每个循环30 s,根据相应的温度下进行30 s 退火,最后在72℃下完成RT-PCR 反应扩增30 s。扩增的DNA 作为PCR 模板,点突变分析的引物用于探针的检测[4]。
1.2.4 治疗方法及RAS 基因对疗效的影响 患者均采用西妥昔单抗治疗,初始剂量西妥昔单抗注射液(注册证号S20130004)400 mg/m2,静脉滴注,之后每周用药250 mg/m2,每4 天重复给药。疗程结束后完成30 个月随访。
1.3 统计学分析 采用SPSS24.0 软件处理,计数资料行χ2检验,采用%表示,计量资料行t检验,采用()表示,P<0.05 为差异有统计学意义。
2 结果
2.1 mCRC 患者RAS 基因突变检测分析 69 例mCRC 患者均完成RAS 基因突变检测,结果表明:患者中RAS 基因突变26 例,RAS 基因野生型患者17 例,占65.38%,突变型患者9 例,占34.62%。其中,12 号密码子GGT 突变为GTT 10 例,突变为GAT 8 例;突变为AGT、CGT、TGT、GCT 患者1 例;13 号密码子GGC 突变为GAC 3 例,突变为TCG 4例。见图1。

图1 mCRC 患者RAS 基因突变位点
2.2 mCRC 患者外周血及肿瘤组织中RAS 基因突变一致性分析 所有患者均完成外周血及组织中RAS 基因突变检测,结果表明:mCRC 患者组织中RAS 基因突变检出率高于外周血中(P<0.05)。见表1。
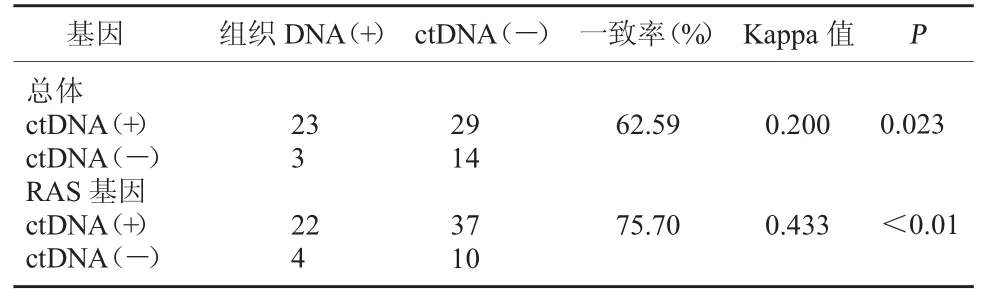
表1 mCRC 患者外周血及肿瘤组织中RAS 基因突变一致性分析
2.3 不同RAS 基因突变类型mCRC 患者西妥昔单抗疗效分析 对所有mCRC 患者均常规给予西妥昔单抗治疗,并对患者进行30 个月随访,结果表明:mCRC 患者中野生型患者利用西妥昔单抗后患者平均生存期为(21.49±5.64)个月,长于突变型患者的(16.23±3.59)个月(P<0.05)。见图2。
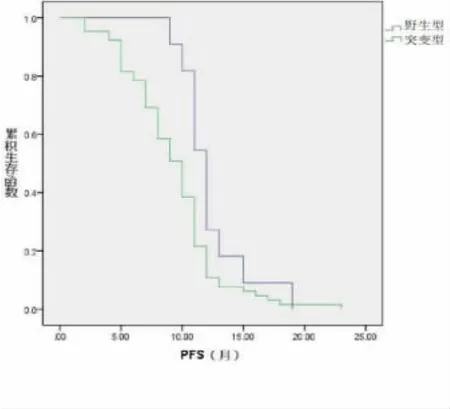
图2 不同RAS 基因突变类型mCRC 患者西妥昔单抗生存期比较
3 讨论
肿瘤细胞内信号传导是一个相对复杂的网络,RAS 基因则是表皮生长因子受体(EGFR)依赖的下游信号转导通路Ras-Raf-MAPK 途径的重要基因。国内学者研究表明,所有mCRC 患者均应进行KARS 基因状态检测,且只有KRAS 野生型患者临床建议接受EGFR 抑制剂治疗[5]。肿瘤细胞发生凋亡时常伴有遗传物质的释放,造成血中存在游离的肿瘤DNA,且与原发肿瘤遗传信息相同。同时,RAS基因的测定以外周血、组织测定为主,但是临床上对其一致性存在争议。本研究中,患者中RAS 基因突变26 例,RAS 基因野生型患者17 例,占65.38%,突变型患者9 例,占34.62%。其中,12 号密码子GGT突变为GTT 10 例,突变为GAT 8 例;突变为AGT、CGT、TGT、GCT 1 例;13 号 密码子GGC 突变为GAC 3 例,突变为TCG 4 例,说明RAS 基因在mCRC 患者中突变率较高,且突变类型较多,均会增加临床诊疗难度。循环肿瘤DNA 主要源于肿瘤细胞自主分泌、坏死及凋亡后的DNA 片段,其片段上常携带突变信息。本研究中,mCRC 患者组织中RAS 基因突变检出率高于外周血中(P<0.05),可以看出mCRC 患者病灶组织中RAS 基因突变率高于外周血中,对于难以获得结直肠癌组织或耐药突变人群,可测定外周血中循环肿瘤DNA[6]。西妥昔单抗属于一种针对EGFR 的人鼠嵌合单克隆抗体,主要由鼠的抗EGFR 抗体可变区和人的IgG1 重链与κ 轻链的恒定区组成,药物与EGFR 具有较强的亲和力,能阻断EGF、EGFR 结合,引起下游酪氨酸激酶活性降低,阻止肿瘤生长,发挥肿瘤细胞杀伤作用。本研究结果说明mCRC 患者外周血及肿瘤组织RAS 基因突变类型会对西妥昔单抗治疗效果产生影响,治疗前应加强患者RAS 基因测定,制定详细的治疗方案,使得患者的治疗更具科学性。
综上所述,mCRC 患者外周血及肿瘤组织RAS基因突变存在一定的差异,会对患者西妥昔单抗治疗疗效产生一定影响,应根据RAS 基因突变类型制定针对性治疗方案,提高治疗疗程。
